基质金属蛋白酶9和颈动脉内膜剥脱术中微栓子脱落的相关性
吴立飞,来志超,李天佳,王子军,邵 磊,刘 暴
1北京市房山区第一医院心血管外科,北京 1024002中国医学科学院 北京协和医学院 北京协和医院血管外科,北京 100730
颈动脉内膜剥脱术(carotid endarterectomy,CEA)已被证实能有效治疗颈动脉狭窄和预防脑卒中的发生,但CEA本身可引起严重的术后并发症卒中和死亡,2017年1篇Meta分析中,3064例CEA患者中有100例出现围手术期卒中或死亡事件,其发生率为3.3%[1]。而CEA术中由于动脉粥样硬化斑块自发性破裂或手术操作不当致微栓子脱落所导致的脑缺血性损伤是引起CEA术后卒中和死亡的主要原因之一。另外,微栓子脱落造成的局部脑组织灌注不足还可引起认知功能下降等亚临床症状[2]。目前,对于CEA术后出现的脑缺血性损伤,缺乏快速有效的诊断方法,临床上也需要有效的预警方法以便早期发现CEA相关的脑缺血性损伤。基质金属蛋白酶(matrix metalloproteinases,MMP)- 9是一种锌和钙依赖的内肽酶,可降解胶原Ⅳ和胶原Ⅴ,在胚胎发育、细胞复制、组织重建中发挥分解细胞外基质作用,MMP- 9同样参与炎症和肿瘤转移等病理活动,尤其与炎症反应关系密切。有研究表明,MMP- 9在卒中发生后表达升高[3- 5],其可能是脑缺血性损伤的一种有效生化标志物。CEA围手术期脑缺血性事件的发生同卒中发生有共同的机制,但目前尚无研究对MMP- 9在CEA围手术期的动态表达以及MMP- 9和 CEA术后脑缺血性损伤的关系做相关探讨。因此,本研究前瞻性探讨MMP- 9在CEA患者中的表达变化情况及其临床预警作用。
对象和方法
对象选取2012年2至9月在北京协和医院血管外科行CEA治疗的颈动脉狭窄患者。纳入标准:同意参与本研究并签署知情同意书;年龄40~80岁;术侧颈动脉狭窄≥70%;术前60 d内未发生脑血管事件;经颅多普勒超声(transcranial doppler,TCD)监测存在颞窗;术前已行颈动脉CT血管造影证实狭窄程度。排除标准:拒绝签署知情同意书;无颞窗,不能在CEA术中监测微栓子脱落情况;颈动脉支架置入术后再狭窄;非动脉粥样硬化性颈动脉狭窄,如大动脉炎、纤维肌性发育不良;对抗血小板和他汀类药物过敏。
临床资料共纳入40例患者,收集患者的一般情况、病史等资料,包括年龄、性别、高血压、糖尿病、冠心病、高脂血症、短暂脑缺血发作(transient ischemia attacks,TIA)发作史、卒中发作史等。根据术中TCD监测,8例术中监测到微栓子脱落者纳入栓子组,32例未监测到微栓子脱落者纳入无栓子组。
手术步骤所有CEA均在全麻下进行,并以TCD持续监测术侧微栓子脱落情况。颈动脉完全暴露后,普通肝素80~100 IU/kg入壶。另外,在颈动脉夹闭之前,在入室血压的基础上将血压提升20%,以提高对侧颈动脉的代偿作用,保证患侧颈动脉夹闭期间脑组织血供。根据术中情况,16例采用经典CEA术式,即纵行切开颈总动脉及颈内动脉进行斑块剥除,其中2例使用转流管;24例采用翻转式CEA术式,即环形切开颈内动脉起始部进行斑块剥除。
血清检测在CEA术前(入室后,麻醉开始前)、颈动脉开放前、开放后30 min、术后12 h分别采集大隐静脉血5 ml,均使用促凝管。采集成功后室温静置1 h,613 ×g 离心10 min,抽取上清并分装至离心管,分装完成后立即置于-80℃冰箱保存并避免反复冻融。血清MMP- 9浓度使用酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)进行检测,ELISA试剂盒(Beijing 4A Biotech Co. Ltd.,Beijing)所有样本均设3个复孔,试剂盒检测灵敏度为30 pg/ml,板间及板内检测变异系数均<10%。血清MMP- 9活性使用明胶酶谱试剂盒进行检测(Life Technologies,USA),以MMP- 2为内参,上样量为未经稀释血清1 μl/孔。MMP- 9浓度及活性检测均严格按照试剂盒说明书进行。
统计学处理应用SPSS 13.0统计软件进行统计分析,定量变量采用均数±标准差表示,两组之间定量资料比较使用t检验,定性资料采用χ2检验或Fisher’s精确检验。P<0.05为差异有统计学意义。
结 果
一般情况共纳入40例患者,栓子组8例(共监测到27个微栓子脱落,均在夹闭颈动脉期间出现),非栓子组32例,两组患者在年龄、性别、糖尿病、高血压、冠心病、高脂血症、TIA发作史、卒中发作史、术式方面差异均无统计学意义(P均>0.05)(表1)。至术后30 d,所有患者均未出现术后卒中或TIA发作。
血清检测CEA术前、开放前、开放后30 min、术后12 h 4个时间点MMP- 9浓度分别为(367.44±182.15) ng/ml、(213.69±169.42) ng/ml、(254.51±207.65) ng/ml、(559.05±336.94) ng/ml。在术前、开放前、开放后30 min 3个时间点,MMP- 9在无栓子组和栓子组差异无统计学意义。而术后12 h,MMP- 9在栓子组的浓度显著高于无栓子组(t=-3.741,P=0.001)(表2)。在无栓子组,术前、术后12 h MMP- 9的血清浓度差异无统计学意义(t=-1.643,P=0.081);而在栓子组,术后MMP- 9的血清浓度较术前明显升高(t=4.132,P=0.001)。
此外,所有血清标本均使用明胶酶谱法对MMP- 9活性进行检测,检测结果同ELISA结果一致,在无栓子组,术前和术后12 h MMP- 9活性无变化,而在栓子组,MMP- 9活性在术后12 h明显升高(图1)。

表 1 两组一般资料比较Table 1 Comparisons of the general information between two groups
TIA:短暂脑缺血发作;CEA:颈动脉内膜剥脱术
TIA:transient ischemia attacks;CEA:carotid endarterectomy
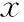
表 2 两组不同时间点患者MMP- 9浓度比较(-±s,ng/ml)Table 2 Comparisons of the MMP- 9 concentration at different time points between two groups(-±s,ng/ml)
MMP:基质金属蛋白酶;和术前比较,at=4.132,aP=0.001
MMP:matrix metalloproteinases;at=4.132,aP=0.001 compared with preoperative

Emboli(-):无栓子组;Emboli(+):栓子组;Pre-op:术前;12 h Post-op:术后12 h
Emboli(-):embolic-negative group;Emboli(+):embolic-positive group;Pre-op:preoperative;12 h Post-op:12 hours post-operative
图1栓子组和无栓子组术前和术后12 h MMP- 9活性
Fig1Preoperative and 12 hours postoperative MMP- 9 activity in the embolic-positive group and the embolic-negative group
讨 论
动脉粥样硬化斑块由胆固醇结晶、钙化灶、脂质核以及纤维帽等构成,在CEA手术过程中,可由于斑块自发性破裂或手术操作原因而发生微栓子脱落,引起颅内动脉栓塞和脑组织局部灌注不足,导致CEA相关的脑缺血性损伤,包括无症状脑梗灶、卒中甚至死亡事件的发生。有研究显示近期发生卒中或TIA的患者中,有25%的患者监测到自发性微栓子脱落,这部分患者中又有23%的患者再次发生卒中或TIA,证实微栓子脱落同脑缺血性损伤关系密切[6]。不过,目前对于CEA围手术期脑缺血性损伤的诊断主要依据临床症状和影像学检查,如CT和磁共振成像,但这些影像学检查并不能在早期有效地发现脑缺血性损伤,尽管有研究显示CT可在急性脑梗死发病6 h内发现脑组织中缺血半暗带,但其技术相对复杂且难以普遍应用[7]。对于未导致明显临床症状的微栓子脱落,更是只能通过术中TCD监测发现。因此,临床上迫切需要能对CEA术后脑缺血性损伤进行及时和准确诊断的方法,为术后治疗方案制定及护理级别选择提供依据。
MMP- 9是一种锌离子依赖蛋白酶,它在细胞外基质的降解中发挥关键作用[8]。临床和动物实验表明,卒中发生后MMP- 9表达升高[3- 5],而MMP- 9抑制剂则可降低脑缺血性损伤的程度和范围[4],提示MMP- 9可能是脑缺血性损伤的一种生化标志物。然而,在CEA围手术期,并不了解MMP- 9的动态表达情况,以及MMP- 9变化同 CEA相关性脑缺血性损伤的关系。本研究观察CEA围手术期MMP- 9动态变化及其同大脑中动脉血流速度变化、微栓子脱落的关系,探索MMP- 9在预警CEA围手术期脑缺血性损伤中的作用。本研究显示在CEA术中监测到微栓子脱落的情况下,MMP- 9表达在CEA术后12 h明显高于术前,而在无微栓子脱落情况下,术后12 h的MMP- 9表达同术前相比无变化。另外,通过ELISA和明胶酶谱法分别对MMP- 9浓度和活性进行检测,得到了完全一致的结果,保证了结果的可靠性。
本研究MMP- 9浓度在开放前和开放后30 min相较于术前出现了明显降低。如前所述,本研究所有患者均使用了丙泊酚和七氟醚进行麻醉诱导和麻醉维持,临床研究已证实,丙泊酚和七氟醚可抑制MMP- 9表达,且在全身麻醉过程中具有脑保护作用[9- 12]。因此,笔者考虑术中MMP- 9浓度降低同丙泊酚、七氟醚等应用有关。由于麻醉药品种类及剂量、麻醉时间在不同患者存在差异,本研究未能就MMP- 9表达与麻醉药品的相关性进行探讨。
MMP- 9可有效降解细胞外基质如Ⅳ型胶原[8],这决定了其在降低斑块稳定性及血脑屏障破坏方面可发挥关键作用[3,13- 15]。2017年Zhong等[5]研究显示,在3186例急性卒中患者中,MMP- 9升高同急性卒中发生后3个月内的死亡、致残率相关,提示MMP- 9在脑缺血性损伤中发挥重要作用,并且和预后相关。在动物实验中,发现MMP- 9在大鼠大脑中动脉阻塞后4 h即出现升高,并且和血脑屏障破坏紧密相关[3],临床实验方面,Montaner等[16]对110例卒中发生后12 h内入院的患者进行研究,发现卒中患者血浆MMP- 9表达明显高于对照组,并且和卒中后脑梗死体积相关,提示MMP- 9于卒中后早期即可出现。MMP- 9在脑缺血性损伤早期即可出现,且同脑缺血性损伤严重程度以及预后相关,因而可能是脑缺血性损伤一种有效的生化标志物。Turner 和Sharp[17]根据以往多项研究提出假说,MMP- 9在卒中发生后12~48 h由脑缺血灶内中性粒细胞和小胶质细胞分泌,并且是早期血脑屏障破坏的重要原因,但MMP- 9在随后的脑组织修复和重塑中同样发挥重要作用,因而,通过调节MMP- 9及其抑制剂水平有可能是未来治疗卒中的一个重要方向。
此前,Molloy等[18]研究显示MMP- 9 在CEA术后48 h出现升高且同术中微栓子脱落有关,提出术后48 h MMP- 9表达升高同微栓子脱落造成的脑损伤有关。不足的是,其研究未能对CEA围手术期MMP- 9的活性变化和升高时间进行说明,而本研究证实MMP- 9表达可于CEA术后12 h内升高,且同术中微栓子脱落有关,证实MMP- 9有早期发现CEA术后微栓子相关性脑缺血性损伤的作用。
综上,本研究显示CEA术中微栓子脱落可导致术后12 h MMP- 9升高,因而MMP- 9可能对于隐匿性卒中具有一定的提示作用,对于出现术后MMP- 9升高的患者,可对其进行更为严密的术后观察和更为完善的术后检查。

