云芝多糖组分对酒精性肝损伤小鼠的保肝活性测试
王康乐 陆震鸣 陈 露 耿 燕 许泓瑜 徐国华 史劲松 许正宏,3
云芝多糖组分对酒精性肝损伤小鼠的保肝活性测试
王康乐1陆震鸣2*陈 露1耿 燕1许泓瑜2徐国华4史劲松1许正宏2,3
(1. 江南大学药学院,江苏 无锡 214122;2. 江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;3. 江南大学工业生物技术教育部重点实验室,江苏 无锡 214122;4. 江苏神华药业有限公司,江苏 淮安 211600)
通过对云芝多糖(Polysaccharides,PSK)分级醇沉制备了3个分子量分布不同的组分PSK-1、PSK-2和PSK-3,并采用NIAAA酒精性肝损伤小鼠模型对这3个组分的保肝活性进行了评价。结果显示:PSK-1(400 mg/kg)的保肝活性优于PSK-2和PSK-3,能够显著降低血清中丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、甘油三酯(TG)、总胆固醇(TC)、低密度脂蛋白固醇(LDL-C)及组织中微量丙二醛(MDA)和游离脂肪酸(NEFA)的水平,同时提升高密度脂蛋白固醇(HDL-C)的水平。
云芝多糖;分级醇沉;肝功能;血脂;活性评价
酒精性肝损伤(Alcoholic liver disease,ALD)是长期过量饮用酒精饮品引起的中毒性肝损伤。酒精性肝病已经成为全球范围内急性和慢性肝病的主要类型,也是全球发病率和死亡率的重要病因之一[1]。大量酒精摄入能够引起血清丙氨酸氨基转移酶(Alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、甘油三酯(Triglyceride,TG)、总胆固醇(Total cholesterol,TC)、高密度脂蛋白固醇(High-density lipoprotein cholesterol,HDL-C)、低密度脂蛋白固醇(Low-density lipoprotein cholesterol,LDL-C)、游离脂肪酸(Nonesterified fatty acid,NEFA)、微量丙二醛(Malondialdehyde,MDA)等指标的显著变化[2,3]。
云芝多糖是云芝中的一类主要生物活性物质,具有保肝、抗氧化、免疫调节、抗肿瘤等多种生物活性[3~5]。但是目前对于云芝多糖中不同组分的结构和活性尚缺深入研究。本研究采用乙醇分级沉淀的方法将云芝多糖纯化为3个不同分子量的组分,并采用酒精性肝损伤小鼠模型比较3个多糖组分的保肝效果。
1 材料与方法
1.1 主要材料
云芝多糖(PSK)由江苏神华药业有限公司提供。实验动物:C57BL/6小鼠,雄性,6周龄,重18~22 g,购自上海斯莱克实验动物责任有限公司。
1.2 主要试剂和仪器
联苯双酯购自中国药品生物制品检定所;Lieber-DeCarli高脂酒精模型组饲料和Lieber-DeCarli正常组饲料购自南通特洛菲饲料有限公司;丙氨酸氨基转移酶(ALT)检测试剂盒、天门冬氨酸氨基转移酶(AST)检测试剂盒、甘油三酯(TG)检测试剂盒、总胆固醇(TC)检测试剂盒、高密度脂蛋白固醇(HDL-C)检测试剂盒、低密度脂蛋白固醇(LDL-C)检测试剂盒、游离脂肪酸(NEFA)检测试剂盒、微量丙二醛(MDA)检测试剂盒购自南京建成生物工程研究所。酶标仪,为美国Thermo公司产品。
1.3 云芝多糖组分的分离
采用分步醇沉的方法将云芝多糖分为3个组分,0~43%乙醇沉淀组分,命名为PSK-1;43%~50%乙醇沉淀组分,命名为PSK-2;50%~80%乙醇沉淀组分,命名为PSK-3。
云芝多糖组分得率=分离组分质量/云芝多糖干重×100%。
1.4 分子量分布检测
采用高效凝胶渗透色谱法(HPGPC)[6]测定云芝胞内糖肽分步醇沉各组分的分子量。利用重均分子量(Mw)为2 000 kDa、133.8 kDa、41.1 kDa、21.4 kDa、4.6 kDa和0.18 kDa的葡聚糖和GPC软件做出葡聚糖分子量标准曲线,根据标准曲线的线性回归方程算出样品的分子量。
1.5 小鼠模型
小鼠模型采用NIAAA模型,具体操作流程参见美国国立卫生院酒精滥用与酒精中毒研究所(National Institute on Alcohol Abuse and Alcoholism, NIAAA)肝病研究室新建立的ALD模型[7]。小鼠适应环境至少1周后随机分组,正常组(CON)、模型组(EtOH)、阳性对照组(BP,150 mg/kg·d)、PSK-1低高剂量组(200和400 mg/kg·d)、PSK-2低高剂量组(200和400 mg/kg·d)和PSK-3低高剂量组(200和400 mg/kg·d),共9组,每组6只。
1.6 统计分析方法
结果表示为平均值±标准差。统计分析采用单因素方差分析,然后进行Newman-Keuls检验。所有分析均使用GraphPad Prism 5进行,如果p值低于0.05,则认为结果是有统计学差异的。
2 结果与分析
2.1 云芝多糖组分分离得率
由表1可知,云芝多糖经过分级醇沉得到3个多糖组分,分别为PSK-1,PSK-2和PSK-3。共使用577 g云芝多糖,经分离后的各组分得率分别为:29.10 %,8.81 %和28.38 %。
2.2 分子量分布
由图1可以看出,经过分级醇沉后的各组分分子量分布存在明显差异。其中PSK-1有两个峰,其重均分子量为40 248 Da和1 396 Da;PSK-2也具有两个峰,其重均分子量为14 695 Da和905 Da;PSK-3为单峰,重均分子量为3 395 Da。以上结果表明随着乙醇浓度的增加,分离出的多糖的分子量减小。
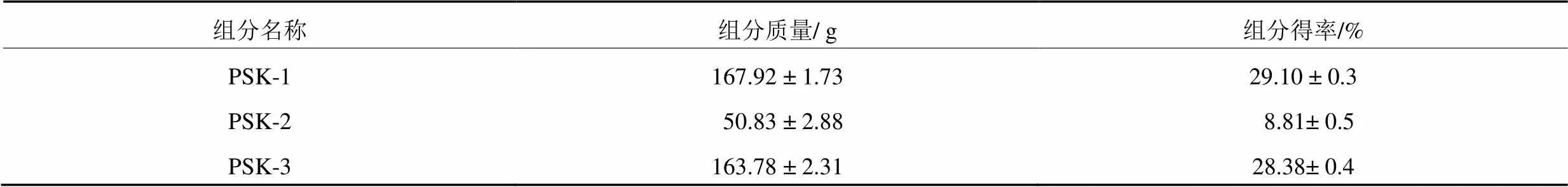
表1 云芝多糖分离组分产量及得率
注:数据以3次平均值±标准差表示。
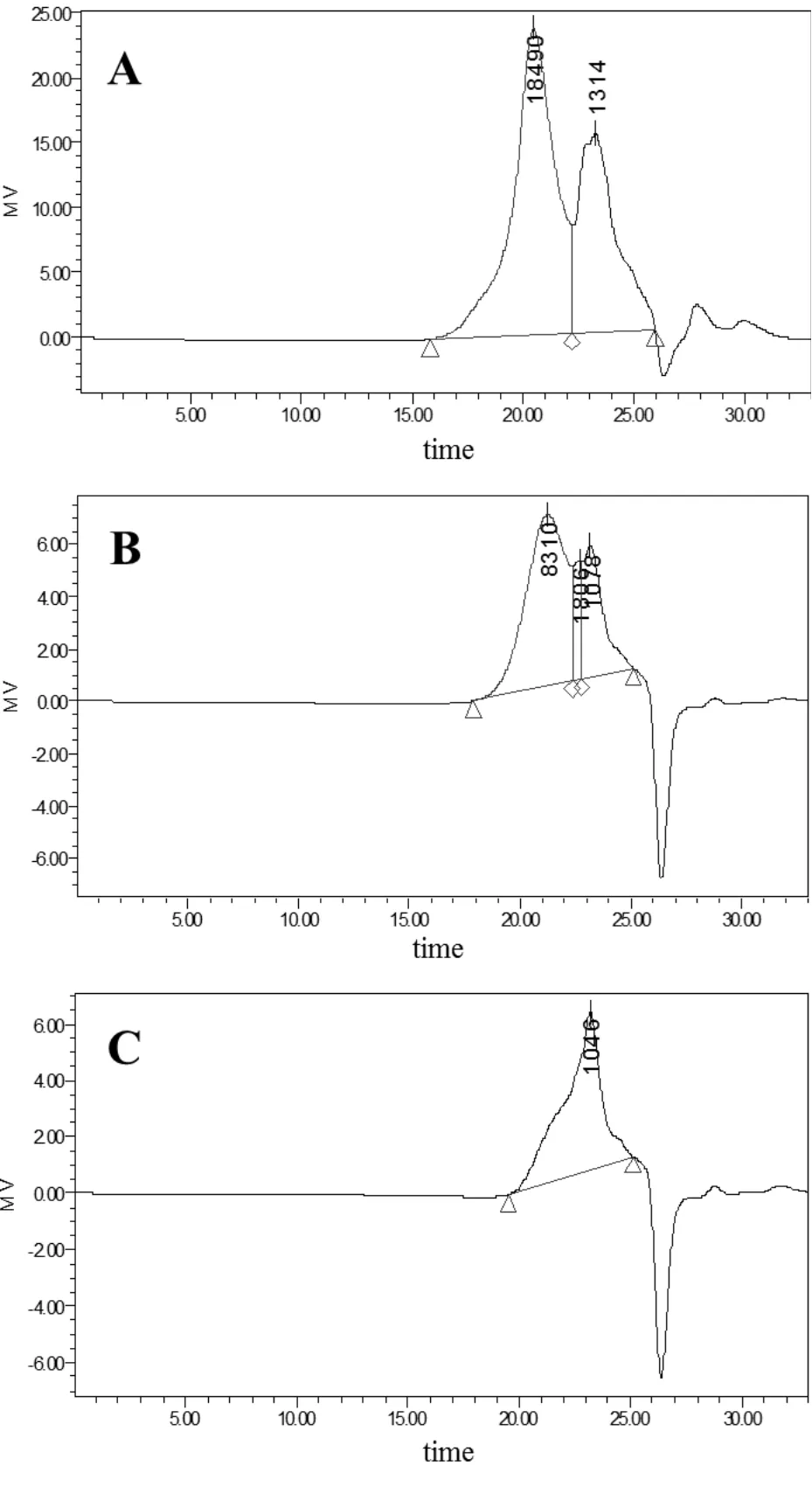
图1 云芝多糖分离组分PSK-1(A)、PSK-2(B)和PSK-3(C)的重均分子量分布
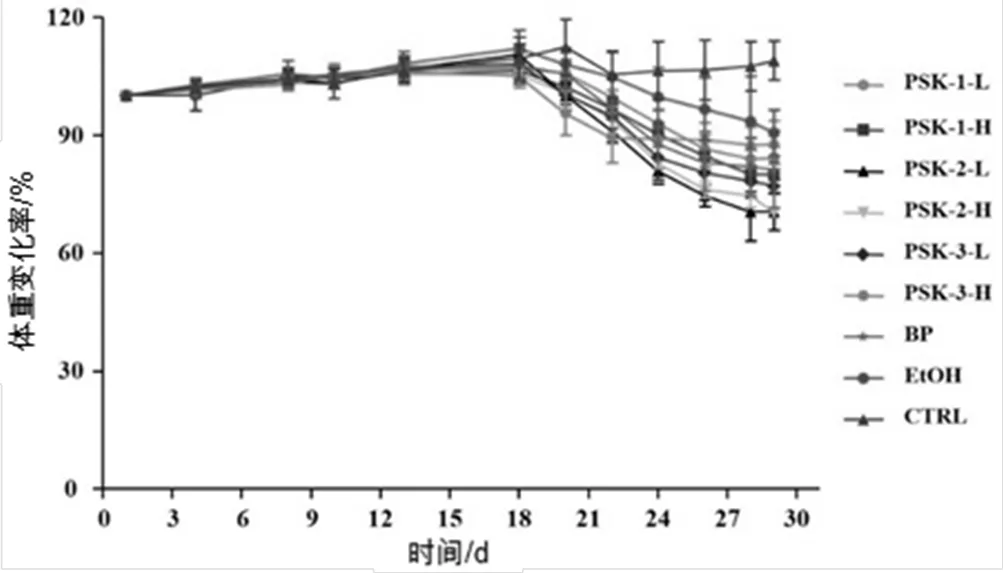
图2 云芝多糖分离组分对小鼠体重变化率的影响
2.3 小鼠体重变化率
实验结果显示,在将饲料更换为Lieber-DeCarli正常液体饲料时小鼠的体重出现小波动(图2)。小鼠喂食含5%(/)酒精的Lieber-DeCarli酒精液体饲料后,小鼠体重均有不同程度的下降。正常组小鼠继续喂食等热量的Lieber-DeCarli正常液体饲料后,小鼠体重稳定增长。表明酒精的摄入会造成小鼠体重的持续下降。但分级醇沉后的云芝多糖组分并未改善这种现象。
2.4 小鼠肝功能血清指标
血清中ALT和AST水平常被用作衡量酒精引起的肝脏损伤的生化指标[8]。实验结果显示,模型组小鼠的血清中ALT和AST水平明显上升(<0.05)(图3);云芝多糖经过分级醇沉后得到的3个组分中PSK-1高低剂量组和PSK-2高剂量组能够显著降低小鼠血清中ALT和AST水平(<0.05);PSK-3并没有表现出对小鼠血清中ALT和AST水平的调节作用。
2.5 小鼠血脂指标
血脂异常是以TC、TG、LDL-C水平升高以及HDL-C水平降低为特征的异常脂质代谢,是代谢综合征的一个组成部分[9],也是心血管疾病的强预测因子[10;11]。结果显示,小鼠长时间饮食酒精会引起血清中TC、TG、LDL-C的显著上升,HDL-C的显著下降,造成血脂异常(图4)。云芝多糖分离的3个组分中PSK-1高低剂量组均表现出良好的调节作用,能够显著的降低小鼠血清中TC、TG、LDL-C的水平,提高HDL-C的水平。
2.6 小鼠肝组织中MDA和NEFA
MDA是脂质过氧化产物,其水平的高低间接反应了机体细胞受到自由基攻击的严重程度[12]。结果显示,小鼠长期饮食酒精会造成肝组织中MDA显著升高(<0.05),PSK-1和PSK-2的高低剂量组均能够显著的降低肝组织中MDA的水平(<0.05)。表明PSK-1和PSK-2能够减少小鼠肝组织中的脂质过氧化程度。NEFA是中性脂肪的分解产物,其水平的上升与脂类的代谢关系密切[13]。实验结果显示,长期饮食酒精会造成小鼠NEFA水平的显著上升(<0.05),而PSK-1能够有效地抑制NEFA的上升(<0.05)。表明PSK-1能够调节小鼠肝组织中的脂类代谢。
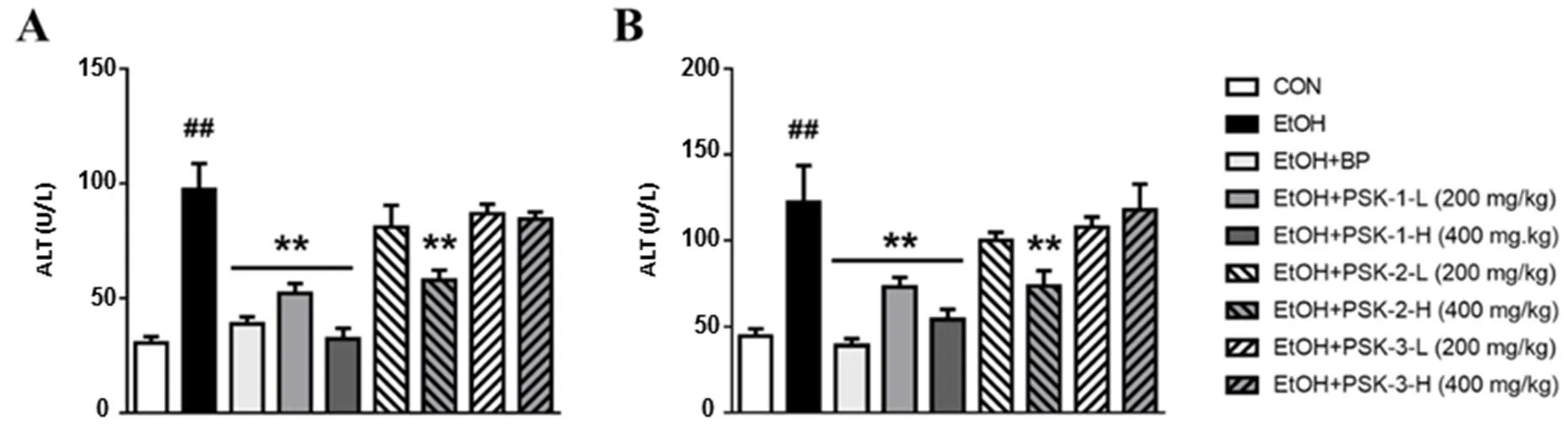
数据为平均值±SD(n=6);与正常组相比##P<0.01;与模型组相比**P<0.01。
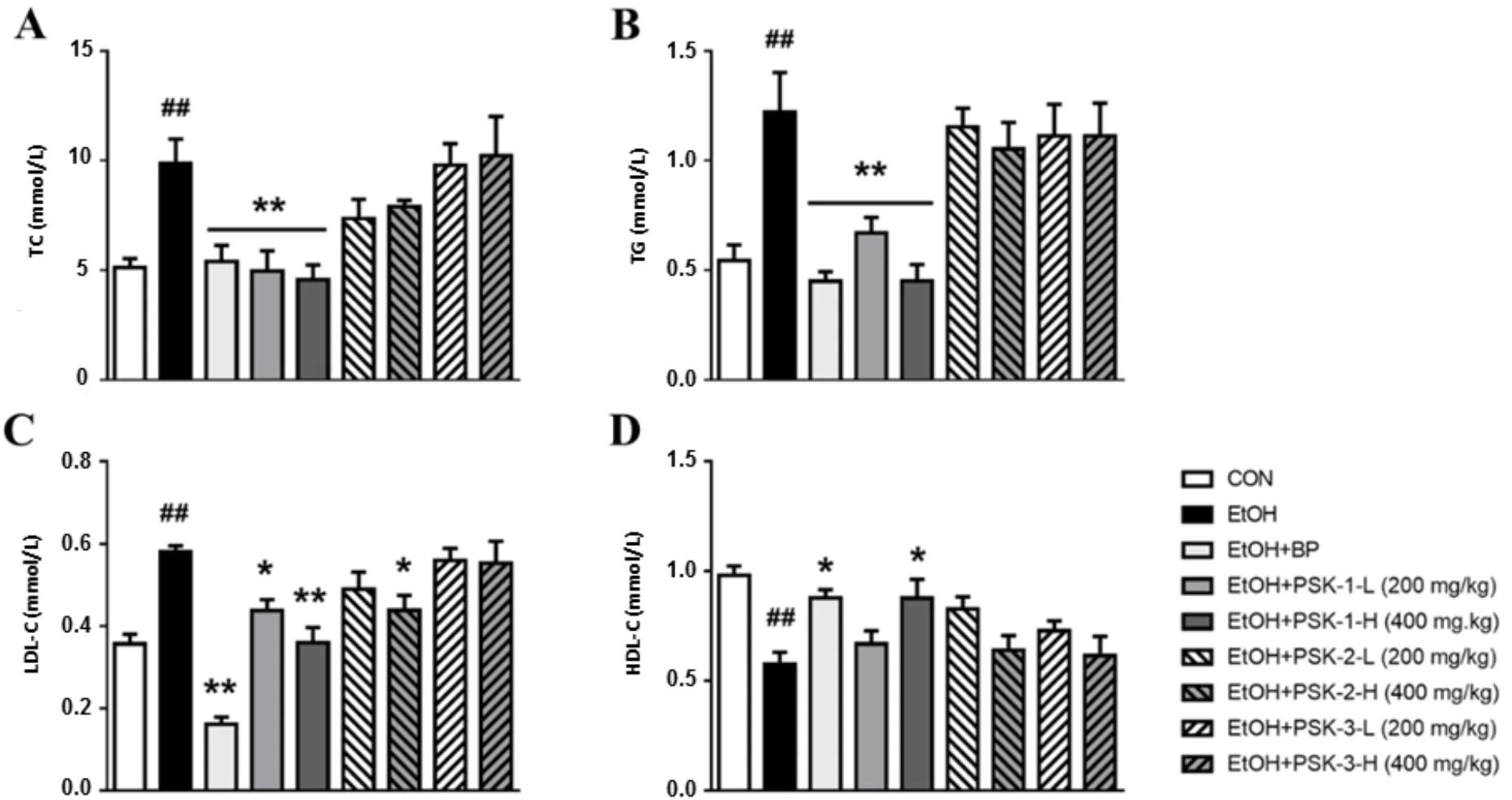
A:TC,B:TG,C:LDL-C,D:HDL-C;数据为平均值±SD(n=6);与正常组相比##P<0.01;与模型组相比*P<0.05,**P<0.01。
3 小 结
利用0~43%、43%~50%、50%~80%体积分数的乙醇沉淀云芝多糖,得到PSK-1、PSK-2和PSK-3三个组分。在NIAAA模型上,三个组分中PSK-1(400 mg/kg)具有较好的抗酒精诱导小鼠肝损伤、血脂异常和脂类代谢异常的活性,能够显著降低ALT、AST、TC、TG、LDL-C、MDA和NEFA的水平;同时提升LDL-C的水平,说明PSK-1是云芝多糖中抗ALD的主要活性成分。GPC检测结果显示,PSK-1并不是均一组分,因此有必要对其进一步开展分离纯化及保肝活性机制的研究。
[1] BRANDONWARNER E, SCHRUM L W, SCHMIDT C M, et al. Rodent Models of Alcoholic Liver Disease: Of Mice and Men[J]. Alcohol, 2012, 46(8): 715-725.
[2] SONG X, SHEN Q, LIU M, et al. Antioxidant and Hepatoprotective Effects of Intracellular Mycelium Polysaccharides from Pleurotus Geesteranus against Alcoholic Liver Diseases[J]. Int J Biol Macromol, 2018.
[3] REN Y, GENG Y, CHEN H, et al. Polysaccharide Peptides from: A Multi-Targeted Approach for the Protection or Prevention of Alcoholic Liver Disease[J]. J Funct Foods, 2018, 40: 769-777.
[4] 王菲菲, 郝利民, 贾士儒, 等. 云芝多糖研究进展[J]. 食品与发酵工业, 2012, 38(6): 148-152.
[5] 周昌艳, 贾薇, 杨焱, 等. 几种真菌多糖预防酒精性肝损伤的实验研究[J]. 食用菌, 2002, 24(5): 36-37.
[6] 魏远安, 方积年. 高效凝胶渗透色谱法测定多糖纯度及分子量[J]. 药学学报, 1989, (7): 532-536.
[7] BERTOLA A, MATHEWS S, KI S H, et al. Mouse Model of Chronic and Binge Ethanol Feeding (the NIAAA Model)[J]. Nat Protoc, 2013, 8(3): 627-37.
[8] CHEN Y L, PENG H C, HSIEH Y C, et al. Epidermal Growth Factor Improved Alcohol-Induced Inflammation in Rats[J]. Alcohol, 2014, 48(7): 701-6.
[9] GRUNDY S M, CLEEMAN J I, DANIELS S R, et al. Diagnosis and Management of the Metabolic Syndrome: An American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement[J]. Circulation, 2005, 112(17): 2735-52.
[10] KOSTIS J B. The Importance of Managing Hypertension and Dyslipidemia to Decrease Cardiovascular Disease[J]. Cardiovasc Drugs Ther, 2007, 21(4): 297-309.
[11] RIDEKER P M, RIFAI N, ROSE L, et al. Comparison of C-Reactive Protein and Low-Density Lipoprotein Cholesterol Levels in the Prediction of First Cardiovascular Events[J]. NEW ENGL J MED, 2002, 347(2002): 1557-1565.
[12] TSIKAS D. Assessment of Lipid Peroxidation by Measuri-ng Malondialdehyde (MDA) and Relatives in Biological Samples: Analytical and Biological Challenges[J]. Anal Biochem, 2017, 524: 13-30.
[13] GUZZARDI M A, HODSON L, GUIDUCCI L, et al. The Role of Glucose, Insulin and NEFA in Regulating Tissue Triglyceride Accumulation: Substrate Cooperation in Adipose Tissue Versus Substrate Competition in Skeletal Muscle[J]. Nutrition Metabolism & Cardiovascular Diseases Nmcd, 2017, 27(11).
Hepatoprotective test of polysaccharide fromon alcoholic liver injury mice
Wang Kangle1Lu Zhenming2*Chen Lu1Geng Yan1Xu Hongyu2Xu Guohua4Shi Jinsong1Xu Zhenghong2, 3
(1. School of Pharmaceutical Science, Jiangnan University, Wuxi 214122, China; 2.National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, China; 3. Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China; 4. Jiangsu Shenhua Pharmaceutical Co. Ltd, Huai’an 211600, China.)
The PSK-1, PSK-2 and PSK-3 were separated by step-alcohol precipitation fromPolysaccharides (PSK). And then evaluated the anti-alcohol liver injury activites through the NIAAA mouse model.The results showed that PSK-1 (400 mg/kg) significantly reduced alanine aminotransferase (ALT), aspartate aminotransferase (AST), triglyceride (TG), total cholesterol (TC), low-density lipoprotein sterols (LDL-C) in serum, malondialdehyde (MDA) and nonesterified fatty acid (NEFA) in tissues, while raised the level of high-density lipoprotein sterols (HDL-C).The active of other two components are lower. It was shown that PSK-1 has the best hepatoprotective activity in the three components.
polysaccharide; step-alcohol precipitation; liver function; blood lipid; activity evaluation
S567.3+1
A
2095-0934(2018)04-235-05
国家自然科学基金(31401931)
王康乐(1991—),男,在读硕士,研究方向为药食用真菌多糖。
陆震鸣(1981—),副教授。E-mail:zmlu@jiangnan.edu.cn。

