烟草黄瓜花叶病毒抗性位点发掘
程立锐,陈小翠,2,代帅帅,马 冰,任 民,蒋彩虹,刘 旦,文柳璎,杨爱国*
烟草黄瓜花叶病毒抗性位点发掘
程立锐1,陈小翠1,2,代帅帅1,马 冰1,任 民1,蒋彩虹1,刘 旦1,文柳璎1,杨爱国1*
(1.中国农业科学院烟草研究所,青岛 266101;2.遵义市农业科学院,贵州 遵义 563006)
烟草黄瓜花叶病毒(CMV)是烟草生产中主要病害之一,发掘其抗性位点,培育抗病品种是最有效的策略之一。本研究利用高抗CMV烤烟品种台烟8号为轮回亲本,优质感病烤烟品种NC82为供体亲本,配置BC1F1群体。在此基础上,利用组织快繁技术对200份BC1F1群体进行快繁,苗期人工接种CMV,获得稳定、可靠的表型数据。利用SSR标记构建遗传图谱,进而利用单向方差分析和完备复合区间作图法发掘CMV抗性位点。结果表明,单向方差分析法分别检测到5个与发病率性状和病情指数性状相关的标记;完备复合区间法共定位到5个QTL,其中2个与发病率性状相关,3个与病情指数性状相关。相关定位结果对开展分子育种辅助改良烟草CMV抗性具有一定意义。
烟草;黄瓜花叶病毒;数量性状位点
黄瓜花叶病毒病(Cucumber mosaic virus, CMV)是烟草最主要的病害之一,在世界各大烟区均有发生,严重影响烟叶的产量和品质,导致了巨大的经济损失[1-2]。烟草CMV的发生在一定程度上限制了一些优质品种的推广和利用。目前,烟草病毒病没有特效的防治措施,对优良主栽品种进行抗性改良,是保障烟叶生产安全最为快速有效的策略。
CMV除去侵染烟草外,还可以侵染辣椒、西红柿等其他作物[3-4],因此在其他作物上CMV抗性遗传及定位研究有所报道。在模式植物拟南芥上,一个基因()被认为与CMV互作产生过敏性坏死,进而产生完全抗性[5]。在其他重要作物中,CMV抗病被认为受单基因和多基因共同控制,多个与CMV抗性相关的遗传位点被定位[6-7]。
但是,与其他作物相比,烟草CMV抗性遗传研究基础相对落后,主要集中在传统遗传学范畴。TERNOVSKIJ等[8]研究发现烟草CMV抗性由隐性单基因控制,但是也有研究表明烟草CMV病毒病抗性性状遗传规律较复杂,既受主效基因控制又表现为多基因影响的复杂数量性状遗传规律[9-11]。到目前为止没有找到免疫CMV烟草种质材料,大多数抗性种质表现为水平抗性,具有明显的数量遗传特征。经典的CMV抗性遗传研究表明,CMV抗性受、、、和等5个基因控制,其中基因来源于野生烟粘烟草(),和来自于烟草种质Ambalema,和来源于烟草种质T.I.245[12]。随着分子标记技术的发展,尤其是SSR标记在烟草中的开发[13-14],使得开展烟草CMV抗性位点定位成为可能。文轲等[15]利用BC1群体定位到与CMV抗性连锁的1个SSR标记,位于10号连锁群上。
目前,对于烟草CMV抗性遗传机制还缺乏必要的认识,如何有效地将CMV抗性位点导入主栽品种实现抗性改良,对育种家来说是一个极大的挑战。本研究利用CMV抗源台烟8号与感病品种NC82组合配置的回交群体为材料,发掘烟草CMV抗性位点,鉴定与之紧密连锁的分子标记。相关研究对阐明烟草CMV抗性机理以及培育抗CMV新品种具有一定意义。
1 材料与方法
1.1 试验材料
由我国培育的烤烟品种台烟8号高抗黄瓜花叶病毒,是烟草CMV抗性育种中重要的抗源。而由美国引进的烤烟品种NC82品质好但是高感CMV。本研究利用抗源台烟8号为母本,高感品种NC82为父本,配置杂交F1,进而利用台烟8号为轮回亲本,与F1回交,构建BC1F1群体,群体大小200株。
1.2 表型鉴定
为了获得稳定、可靠的数据,将每个BC1F1单株利用组织快繁50株。具体操作步骤参考任建青等[16]的报道。
2013年5月,双亲及200份BC1F1种植在中国农业科学院烟草研究所即墨(北纬35.4°,东经119.3°)温室中。采用盆栽,盆高10 cm,直径12 cm,每个盆中栽种1棵,每个株系种10株,两次重复。13 h/9 h昼夜循环,温室温度24~29 ℃,相对湿度60%~75%。在植株长到六叶期,利用摩擦接种法进行CMV(Fny株系)接种,接种方法参考代帅帅等[2]的报道。在接种后15 d调查发病情况,调查标准参照烟草病虫害分级及调查方法GB/T 23222—2008国家标准。利用发病率(Incidence of Disease, ID)和病情指数(Disease Index, DI)来衡量发病情况,其中发病率和病情指数计算公式如下:
发病率=(各级病株数/总鉴定株数)×100%
病情指数=∑(各级病株×该病级数)×100/(调查总株×最高级数)
1.3 遗传图谱构建及QTL定位
株系内混取不同单株的嫩叶,放置于液氮中,利用CTAB方法[13]提取DNA。根据BINDLER等[14]公布的信息合成SSR引物,利用PCR扩增和聚丙烯酰胺凝胶电泳鉴定不同株系的基因型,具体DNA提取、SSR引物合成信息及检测操作步骤参考文献[13-14]。利用Joinmap4.0软件[17]构建遗传图谱,以LOD值大于3.0进行分组,利用Kosambi函数计算遗传距离,具体软件相关操作步骤参考文献[15,18]。采用Mapchart 2.2软件[19]绘制遗传图谱。
分别利用单向方差分析和完备复合区间作图法(Inclusive Composite Interval Mapping, ICIM)进行性状QTL定位。单向方差分析采用SAS 8.0软件开展,<0.01为检测显著性标记的阈值。完备复合区间作图法利用IciMapping 4.1软件计算[20],LOD值大于2.0作为QTL的阈值。
2 结 果
2.1 亲本及BC1F1群体表型变异
在本研究中,两个亲本在CMV抗性上存在着显著性差异(图1)。
由图2可见,亲本台烟8号的CMV发病率为60.24%,病情指数为14.67%;亲本NC82的CMV发病率为100%,病情指数为35.55%。对于BC1F1群体而言,不同株系间的CMV抗病性差异显著,表现出连续变异。BC1F1群体内株系间发病率变幅从0到100%,平均值为82.29%;病情指数变幅从0到67.04%,平均值为23.74%。这些结果表明烟草CMV抗性受多基因控制,呈现数量性状遗传特征。
2.2 基因型分析及遗传图谱构建
根据BINDLER等公布的信息,共合成2358对SSR标记,在亲本间筛选有多态性的标记,共获得76对清晰、易扩增、有多态性的SSR标记,多态率3.22%。利用有多态性的标记对200份BC1F1群体进行基因型分析,进而利用Joinmap 4.0软件进行遗传图谱构建。本研究中构建的遗传图谱包含15个连锁群,53个SSR标记,总的遗传距离为489.08 cM。
2.3 CMV抗性位点发掘
本研究利用单标记方差分析和完备复合区间作图法两种方法进行了CMV抗性显著位点发掘。如表1所示,利用单标记方差分析共检测到5个与发病率显著相关的标记,其中位于17号染色体32.25 cM的标记PT60665与发病率性状极显著相关(=8.21,=0.004 6);同样的,利用单标记方差分析检测到5个与病情指数显著相关的标记,其中标记PT60665和PT50891在发病率和病情指数两种性状中都可以检测到显著性。

注:左、中和右照片分别为台烟8号、NC82和F1。

图2 台烟8号与NC82组合的BC1F1群体CMV抗性表型分布图
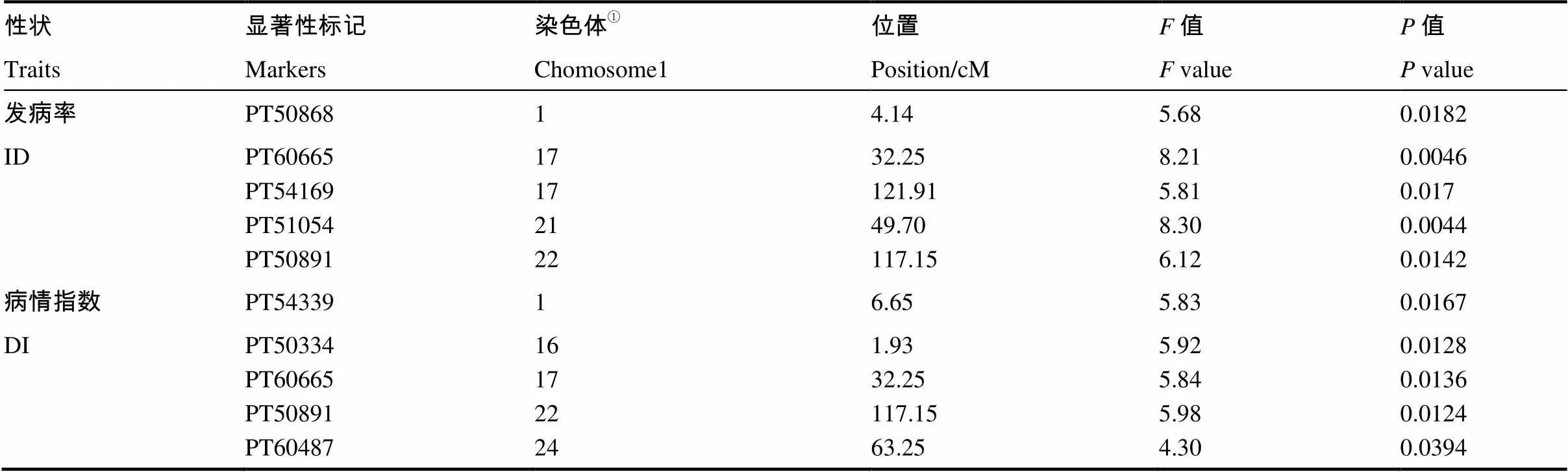
表1 烟草CMV抗性显著关联位点单向方差分析
注:①遗传位置来源于BINDLER 等公布的SSR遗传图谱。
Note:①Genetic position is based on the SSR genetic maps reported by BINDLE et al (2011).
利用完备区间作图法,总共鉴定到5个QTL(表2)。其中定位到2个与发病率性状相关的QTL,分别命名和。两个QTL分别解释了7.22%和5.71%的表型变异,来自于台烟8号的等位基因型降低了发病率。定位到3个与病情指数相关的QTL,分别命名为、和。这3个QTL分别解释了5.63%、5.36%和6.37%的表型变异,在这3个位点上来源于NC82的等位基因型增加了病情指数。
对比两种性状定位的QTL结果,在2号连锁群33 cM附近和14号连锁群端部存在着共同控制发病率和病情指数性状的抗性位点(图3)。
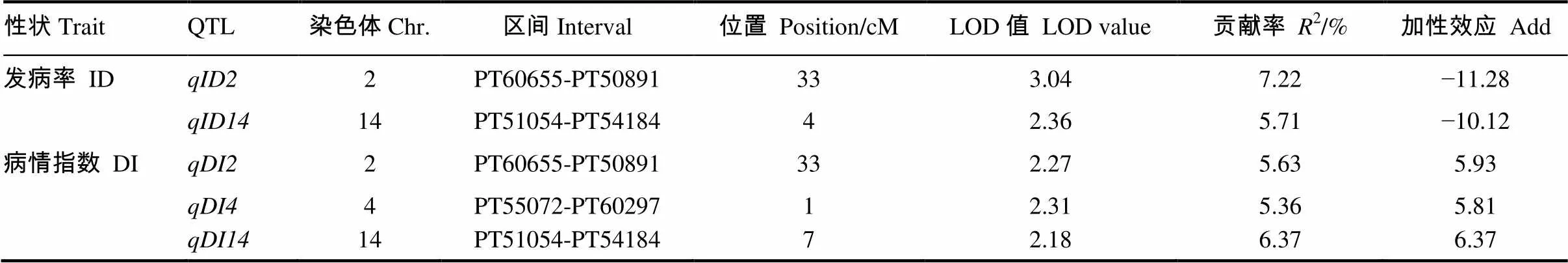
表2 烟草CMV抗性位点QTL定位结果

图3 烟草CMV抗性QTL所在连锁群位置
3 讨 论
CMV可以侵染包括烟草在内的1200多种植物,是影响烟叶生产的最主要病毒之一。其抗性遗传复杂,受多基因控制,易受环境影响,利用传统的常规育种手段较难实现抗性改良。因此,利用分子标记技术发掘CMV抗性位点,鉴定与之紧密连锁的分子标记,对于烟草抗CMV改良具有重要意义。在本研究中,利用单向方差分析方法分别定位到5个与发病率相关的标记和5个与病情指数相关的标记;利用完备区间作图法定位到了2个与发病率相关的QTL(和)以及3个与病情指数相关的QTL(、和)。比较不同定位方法发现,标记PT60665与CMV发病率和病情指数显著相关,用两种定位方法都可以检测到,因此该标记与CMV抗性显著关联,在今后的CMV抗性分子标记辅助改良中具有一定利用价值。
另外,植物体在抵抗病原菌侵染时,其抗性分为抗侵入、抗扩展和耐病等不同机制。发病率性状反映了植物对病原菌的抗侵入能力,而病情指数性状则是植物体对病原菌抗侵入、抗扩展和耐病等抗性机制的综合体现。对比两种性状的定位结果,不同抗性位点表现出不同的抗性机制:在2号连锁群(和)和14号连锁群(和)上的抗性位点可能与烟草抗CMV侵入有关,而4号连锁群体上的位点则表现出抗扩展或者耐病等抗性机制。因此,在今后的CMV抗性育种中,利用分子标记技术,尽可能的将控制相同抗性类型的不同等位基因以及控制不同抗性类型的不同等位基因聚合到主栽烟草品种中去是一个有效的育种策略。
本研究中利用的亲本台烟8号由T.I.245与品种Hicks杂交回交后,结合抗病性筛选出的高抗CMV品种,是重要的烤烟CMV抗源,其CMV抗性应该是来源于种质T.I.245。如前所述,经典遗传学研究表明烟草CMV抗性受5个基因控制,其中和两个隐性基因来源于烟草种质T.I.245。本研究利用台烟8号为轮回亲本配置BC1F1群体,就是为了更有效的检测来源于T.I.245的两个隐性抗病位点。本研究定位结果也表明,在2号连锁群(和)和14号连锁群(和)分别定位到两个与CMV抗性显著关联的位点,因此,在本研究中定位到的两个QTL可能就是来源于烟草种质T.I.245的两个经典隐性基因和。因此,接下来的工作将会围绕着这两个隐性抗性位点开展进一步精细定位和克隆。
普通烟草是典型的异源四倍体,基因组大小4.5 Gb左右,比其他大多数作物庞大而复杂[21]。同时,普通烟草尤其是烤烟育种历史较短,育种目标单一,这导致了在不同烟草品种间的遗传多样性低,这些因素在很大程度上限制了烟草遗传图谱构建和重要性状遗传位点定位的研究。本研究合成了2358对SSR标记,但是在台烟8号和NC82两个烤烟品种间可用的多态性标记只有76个,多态性只有3.22%。因此,目前SSR等二代分子标记很难满足烟草重要性状遗传和全基因组QTL定位研究。随着测序成本的降低以及检测平台的不断优化,三代标记SNP标记已经越来越多的在动植物遗传图谱构建、重要性状定位和克隆以及遗传多样性分析等领域利用[22-24]。利用由中国烟草总公司郑州烟草研究院牵头搭建的烟草430 K SNP芯片平台或简化重测序技术,构建高密度遗传图谱,在不同环境条件下全基因组扫描与CMV抗性相关的位点,是今后需要优先开展的研究方向。
4 结 论
利用SSR标记和回交群体对烟草CMV的抗性进行了QTL分析,发掘了5个与烟草CMV抗性相关的QTL。相关定位结果为明确烟草CMV抗性遗传基础和开展烟草分子标记辅助改良奠定了一定基础。
[1] 朱贤朝. 中国烟草病害[M]. 北京:中国农业出版社,2002:76-79.
ZHU X C. Tobacco diseases in China[M]. Beijing: Chinese Agricultural Press, 2002: 76-79.
[2] 代帅帅,任民,蒋彩虹,等. 烟草骨干亲本主要病毒病抗性鉴定及遗传多样性分析[J]. 中国农业科学,2015,48(6):1228-1239.
DAI S S, REN M, JIANG C H, et al. Identification of resistance to main virus diseases and genetic diversity study of tobacco foundation parents[J]. Scientia Acricultura Sinica, 2015, 48(6): 1228-1239.
[3] MOCHIZUKI T, OHKI S T. Cucumber mosaic virus: viral genes as virulence determinants[J]. Molecular Plant Pathology, 2012, 13(3): 217-225.
[4] SCHOLTHOF K B, ADKINS S, Czosnek H, et al. Top 10 plant viruses in molecular plant pathology[J]. Molecular Plant Pathology, 2011, 12: 938-954.
[5] TAKAHASHI H, SHOJI H, ANDO S, et al. RCY1-mediated resistance to Cucumber mosaic virus is regulated by LRR domain-mediated interaction with CMV(Y) following degradation of RCY1[J]. Molecular Plant-Microbe Interactions, 2012, 25(9): 1171.
[6] CARANTA C, PALLOIX A, LEFEBVRE V, et al. QTLs for a component of partial resistance to cucumber mosaic virus in pepper: restriction of virus installation in host cells[J]. Theoretical and Applied Genetics, 1997, 94: 431-438.
[7] CARANTA C, PFLIEGER S, LEFEBVRE V, et al. QTLs involved in the restriction of cucumber mosaic virus (CMV) long-distance movement in pepper[J]. Theoretical and Applied Genetics, 2002, 104: 586-591.
[8] TERNOVSKIJ T F, PODKIN O V, Ternovskij T. Inheritance of resistance to cucumber mosaic virus in tobacco plants[J]. Tabak, 1970, 3: 9-10.
[9] 刘艳华,王志德,钱玉梅,等. 烟草抗病毒病种质资源的鉴定与评价[J]. 中国烟草科学,2007,28(5):1-4.
LIU Y H, WANG Z D, QIAN Y M, et al. Resistance identification and evaluation of tobacco germplasms to tobacco virus diseases[J]. Chinese Tobacco Science, 2007, 28(5): 1-4.
[10] 陈小翠,代帅帅,张兴伟,等. 烤烟CMV抗性的主基因+多基因混合遗传模型分析[J]. 植物遗传资源学报,2014, 15(6):1278-1286.
CHEN X C, DAI S S, ZHANG X W, et al. Mixed major-gene plus polygenes inheritance analysis for CMV disease resistance in flue-cured tobacco[J]. Journal of Plant Genetic Resources, 2014, 15(6): 1278-1286.
[11] 程亚增,马冰,蒋彩虹,等. 烤烟不同黄瓜花叶病毒病(CMV)抗源的抗性遗传分析[J]. 烟草科技,2016,49(6):8-14.
CHENG Y Z, MA B, JIANG C H, et al. Genetic analysis of CMV resistance in different flue-cured tobacco germplasms[J]. Tobacco Science & Technology, 2016, 49(6): 8-14.
[12] WAN H, CHEN C H, WU J K. Breeding tobacco resistant to cucumber mosaic virus in Taiwan[J]. Euphytica, 1984, 33(1): 17-25.
[13] BINDLER G, VAN DER HOEVEN R, GUNDUZ I, et al. A microsatellite marker based linkage map of tobacco[J]. Theoretical and Applied Genetics, 2007, 114: 341-349.
[14] BINDLER G, PLIESKE J, BAKAHER N, et al. A high density genetic map of tobaccoL.) obtained from large scale microsatellite marker development[J]. Theoretical and Applied Genetics, 2011, 123: 219-230.
[15] 文轲,张志明,任民,等. 烤烟CMV抗性基因QTL定位[J]. 中国烟草科学,2013,34(3):55-59.
WEN K, ZHANG Z M, REN M, et al. QTL analysis of the resistance gene to CMV in flue-cured tobacco[J]. Chinese Tobacco Science, 2013, 34(3): 55-59.
[16] 任建青,李枝林,李鹏,等. 烟草品种“红花大金元”变异株的快速繁殖技术[J]. 云南农业大学学报,2009,24(6):913-916.
REN J Q, LI Z L, LI P, et al. Rapid propagation technology study on variable plant of tobacco variety “Hongda”[J]. Journal of Yunnan Agricultural University, 2009, 24(6): 913-916.
[17] VAN OOIJEN J W. Joinmap® 4.0: Software for the calculation of genetic linkage maps in experimental populations[M]. Wageningen, Netherlands: Kyazma B V, 2006.
[18] CHENG L R, YANG A G, JIANG C H, et al. Quantitative trait loci mapping for plant height in tobacco using linkage and association mapping methods[J]. Crop Science, 2015, 55: 641-647.
[19] VOORRIPS R E. Map Chart: software for the graphical presentation of linkage maps and QTLs[J]. Journal of Heredity, 2002, 93: 77-78.
[20] LI H H, YE G Y, WANG J K. A modified algorithm for the improvement of composite interval mapping[J]. Genetics, 2007, 175: 361-374.
[21] SIERRO N, BATTEY JND, OUADI S, et al. Reference genomes and transcriptomes ofand Nicotiana tomentosiformis[J]. Genome Biology, 2013, 14: R60.
[22] ZHOU X J, XIA Y L, REN X P, et al. Construction of a SNP-based genetic linkage map in cultivated peanut based on large scale marker development using next-generation double-digest restriction-site-associated DNA sequencing (ddRADseq)[J]. BMC Genomics, 2014, 15: 351.
[23] WANG H, JIN X, ZHANG B, et al. Enrichment of an intraspecific genetic map of upland cotton by developing markers using parental RAD sequencing[J]. DNA Research, 2015, 22(2): 147-160.
[24] GONG D, HUANG L, XU X, et al. Construction of a high-density SNP genetic map in flue-cured tobacco based on SLAF-seq[J]. Molecular Breeding, 2016, 36(7): 100.
Identification of QTL Associated with Resistance to Cucumber Mosaic Virus in Tobacco
CHENG Lirui1, CHEN Xiaocui1,2, DAI Shuaishuai1, MA Bing1, REN Min1, JIANG Caihong1, LIU Dan1, WEN Liuying1, YANG Aiguo1*
(1. Tobacco Research Institute, Chinese Academy of Agricultural Sciences, Qingdao 266101, China; 2. Zunyi Academy of Agricultural Sciences, Zunyi, Guizhou 563006, China)
Cucumber mosaic virus (CMV) is one of the most serious diseases affecting tobacco (L.). It is an effective way to prevent CMV by mining, identification and utilization of resistant genes. In this study, a BC1F1 population was constructed from a cross between recurrent parent Taiyan8 and donor parent NC82. Based on this population, 50 plants generated from each BC1F1 individual using tissue culture method were evaluated for resistance to CMV. Furthermore, QTLs associated with resistance to CMV were identified by one-way ANOVA and Inclusive Composite Interval Mapping (ICIM) methods. The results showed that 5 significant markers for incidence of disease (ID) and disease Index (DI) were found using one-way ANOVA analysis. Meanwhile, 5 QTLs were detected by ICIM method. Among them, 2 QTLs were related with ID and 3 were related with DI. These results add to our understanding of the inheritance of resistance to CMV and provide information for marker assisted breeding for improvement of resistance to CMV in tobacco.
tobacco; cucumber mosaic virus; quantitative trait loci
S572.03
1007-5119(2018)04-0001-06
10.13496/j.issn.1007-5119.2018.04.001
中国烟草总公司烟草基因组计划重大专项“烟草抗CMV 和赤星病连锁分子标记开发及NC82、K326 品种抗性改良”(110201301009(JY-09);中国农业科学院科技创新工程“烟草遗传育种”(ASTIP-TRIC01);中国烟草总公司烟草科技重点项目“烟草多亲本高世代互交系构建及抗真菌性病害烤烟新品种培育”(110201502012)
程立锐(1979-),男,博士,副研究员,研究方向:烟草分子育种。E-mail:chenglirui@caas.cn。
,E-mail:yangaiguo@caas.cn
2018-01-14
2018-05-08

