瘤周隔离带对射频消融术所致乳腺癌裸鼠皮肤烧伤的保护作用
刘高秀,韩智培,陈 涛,方 斌,陈海军,李文涛
(郑州大学人民医院乳腺外科,河南 郑州 450003)
近年来,射频消融治疗早期乳腺癌的可行性和安全性逐渐被认可,GROTENHUIS等[1]研究显示,射频消融治疗早期乳腺癌的肿瘤完全消融率为80%~100%。然而,术中不能监测消融周围组织温度,易造成皮肤烧伤。皮肤烧伤是射频消融治疗早期乳腺癌最常见的并发症,发生率约为5%[1]。本研究建立了乳腺癌MCF-7细胞荷瘤裸鼠模型,通过瘤体周围注射生理盐水建立瘤周隔离带,将皮肤与肿瘤隔离,由于水的比热容较大,能够吸收射频消融产生的大部热量,从而减少瘤体周围正常组织及皮肤的热量吸收,减轻皮肤烧伤。本研究为临床上减轻射频消融导致的皮肤烧伤提供了新思路及动物实验基础。
1 材料与方法
1.1实验动物5周龄无特定病原体级BALB/c雌性裸鼠30只,体质量(14.0±3.0)g,购自北京维通丽华实验动物技术有限公司。裸鼠于三级层流室饲养,每日按正常昼夜节律给予光照,自由饮食。
1.2主要试剂与仪器人乳腺癌细胞MCF-7(美国ATCC细胞库),RPMI-1640培养基(美国Gibco公司),胎牛血清(杭州四季青生物工程材料有限公司);BT100-2J精密蠕动泵(保定兰格恒流泵有限公司),21-843671射频消融电极、S-1500射频治疗仪(迈德医疗科技上海有限公司),佳能IXUS 860IS型数码相机(日本佳能公司),GLFT-1红外线敏感温度计(美国格朗电子集团)。
1.3MCF-7细胞移植瘤模型建立取MCF-7细胞,使用含有抗生素(庆大霉素、两性霉素、支原体预防试剂PlasmocinTMprophylactic)和体积分数10%胎牛血清的RPMI-1640培养基,在恒温37 ℃、饱和湿度、体积分数95% O2和5%CO2的条件下培养,每2 d换液1次,用含乙二胺四乙酸的2.5 g·L-1胰蛋白酶进行消化传代培养。取对数生长期的MCF-7细胞,磷酸盐缓冲液冲洗2遍,2.5 g·L-1胰蛋白酶消化,以1×1010L-1重悬于RPMI-1640培养基(不含血清),显微镜下观察活细胞比例>95%。在无菌条件下,于每只裸鼠后背部右前肢与背部交界处皮下注射0.2 mL MCF-7细胞悬液,建立MCF-7细胞的荷瘤裸鼠。每隔2~3 d用游标卡尺测量1次肿瘤直径(mm),包括纵径及与之垂直的横径,待纵径和横径达到8~12 mm时为模型建立成功,记录每只裸鼠的体质量和肿瘤直径,计算肿瘤体积。肿瘤体积计算公式[2]:肿瘤体积=纵径×横径2/2。
1.4裸鼠移植瘤的射频消融治疗30只荷瘤裸鼠随机分为实验组和对照组,每组15只,行射频消融治疗。具体步骤:消毒腹部皮肤,麻醉穿刺点选择在腹部下1/3稍外侧,针头进入腹腔后先抽吸,以避免刺入脏器和大血管,注射20 g·L-1水合氯醛(0.01 mL·g-1)。待裸鼠步态不稳后,将其置于俯卧位,四肢伸展,胶带固定于操作台上,使背部平坦。术区消毒,实验组裸鼠于肿块周围注射3~4 mL生理盐水,形成瘤周隔离带(图1),对照组裸鼠未做此处理。在超声探头引导下经皮穿刺,将射频消融针定位到肿块中心(图2);设置S-1500射频治疗仪功率为15 W,在此功率模式下,当肿瘤组织的阻抗达到系统设定阈值时,射频治疗仪将自动停止工作,固定操作时间为1 min。当彩色超声下显示整个肿瘤出现均匀高回声且范围不再增大时,提示消融完全,操作结束,关闭开关,记录射频消融时间。
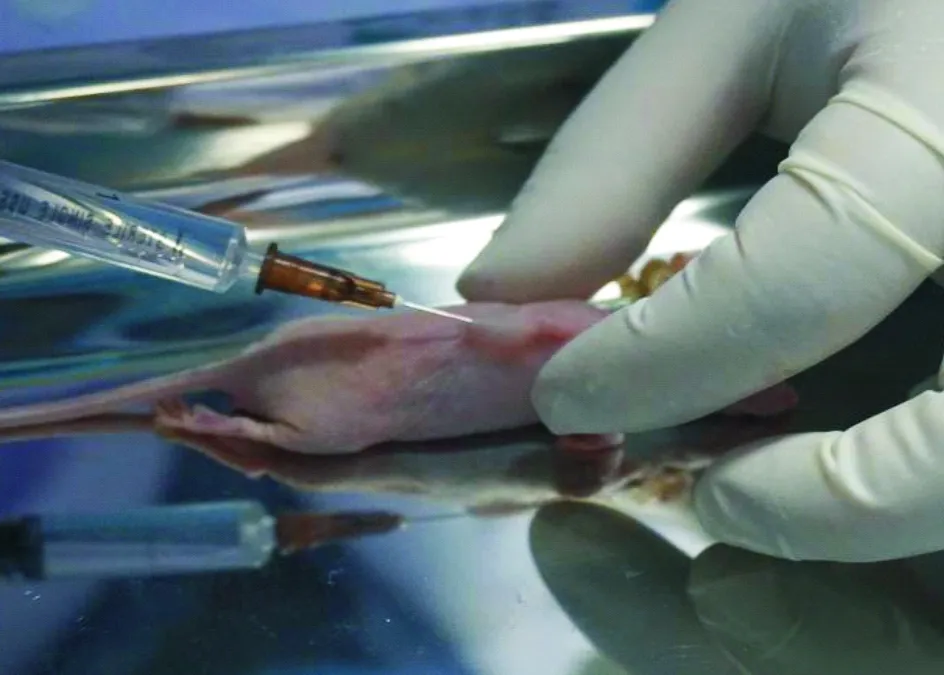
图1 实验组裸鼠射频消融术前注射瘤周隔离带
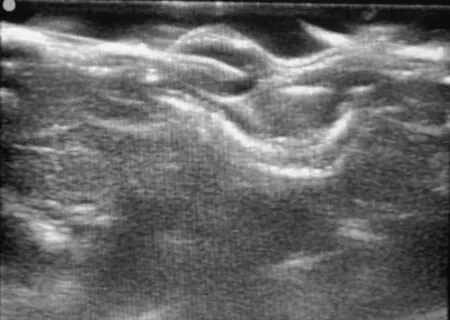
图2 彩色超声引导下将射频针定位到肿块中心
1.5观测指标
1.5.1皮肤创面面积小鼠背部皮肤烧伤后,皮肤即刻呈现不同程度的水肿及色泽发白,边界清楚,面积恒定,易于肉眼观察。在烧伤的皮肤旁放置1枚1元硬币为参照,用数码相机拍下烧伤创面。将图像导入计算机,通过Photoshop CS 8.0软件(美国Adobe公司)选取图像中的创面边缘,利用参照物的像素值间接测算创面面积[2]。
1.5.2皮肤创面温度射频消融操作结束,使用GLFT-1红外线敏感温度计在距离创面约2 cm高度测量创面温度并记录。
1.5.3皮肤创面愈合时间每日观察1次裸鼠烧伤创面的愈合情况,当烧伤创面的焦痂开始与周围正常皮肤分离(自溶脱痂)时,记为创面愈合的记录终点,记下历时时间。
1.5.4裸鼠存活率以射频消融术为时间起点,以创面愈合(自溶脱痂)为时间终点,记录各组裸鼠死亡数量,计算各组裸鼠存活率。
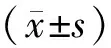
2 结果
2.12组裸鼠体质量、肿瘤体积及射频消融时间比较结果见表1。2组裸鼠体质量、肿瘤体积和射频消融时间比较差异均无统计学意义(P>0.05)。

表1 2组裸鼠体质量、肿瘤体积及射频消融时间比较
2.22组裸鼠存活率比较射频消融术后,实验组未出现死亡裸鼠,对照组5只裸鼠于术后3~5 d死亡。实验组和对照组裸鼠存活率分别为100.0%(15/15)、66.7%(10/15),实验组裸鼠存活率显著高于对照组,差异有统计学意义(Fisher确切概率法,P<0.05)。
2.32组裸鼠皮肤创面面积及创面温度比较结果见表2。实验组裸鼠皮肤创面面积显著小于对照组,皮肤创面温度显著低于对照组,差异均有统计学意义(P<0.05)。

表2 2组裸鼠皮肤创面面积及创面温度比较
2.42组裸鼠皮肤创面愈合时间比较实验组和对照组裸鼠皮肤创面愈合时间分别为(11.40±1.64)、(17.50±1.58)d,实验组裸鼠皮肤创面愈合时间显著短于对照组,差异有统计学意义(t=9.905,P<0.05)。
3 讨论
射频消融术治疗早期乳腺癌具有微创、美观、并发症少等优点,具有较好的应用前景[3]。近年来,在欧美国家,射频消融术治疗早期乳腺癌的安全性和有效性逐渐被认可[4-8],但临床上还存在一些亟待解决的问题,如判断肿瘤细胞活性的组织学染色方法、评估消融是否完全的影像学检查方法等。因为射频消融术尚未纳入乳腺肿瘤治疗规范,缺乏大样本的临床研究,限制了相关领域的经验积累,所以,建立一种用于射频消融研究的乳腺癌动物模型十分必要。
目前,研究乳腺肿瘤射频消融常见的动物模型有Fisher大鼠、FVBN202转基因大鼠、BALB/c小鼠、新西兰白兔等,这些动物免疫系统健全,建立的均是同源性肿瘤模型,例如:给Fisher344大鼠移植大鼠乳腺癌MatBⅢ细胞[9]、BALB/c小鼠移植鼠源性4T1乳腺癌细胞[10]、FVBN202转基因大鼠移植MMC细胞系[10]、新西兰白兔移植兔直肠癌VX2细胞[11]等,建立的均不是人乳腺癌动物模型,不能模拟人乳腺癌细胞的生物学行为。细胞源性异种移植(cell-line-derived xenografts,CDX)是将人某种表型的肿瘤细胞经过体外传代、培养,建立稳定的细胞系,移植到免疫缺陷的动物身上,数周内即可长成符合要求的肿瘤组织。CDX是最简单、最常见的动物模型,对于研究肿瘤的发生、生物学过程和临床治疗效果极有帮助[12]。YUKUMI等[13]通过建立人乳腺癌 BT474细胞荷瘤裸鼠模型,研究烧结MgFe2O4针感应生热微创治疗乳腺癌的可行性。本研究拟建立人乳腺癌MCF-7细胞荷瘤裸鼠模型,以供乳腺癌射频消融的相关研究。但是,在预实验中发现,对荷瘤裸鼠进行射频消融时,皮肤烧伤严重,甚至导致裸鼠死亡,限制了在其身上进行射频消融的相关研究。在早期的人乳腺癌射频消融可行性研究中,有人提出皮下注射无菌生理盐水不仅可以阻止热量向皮肤传导,而且将肿瘤与皮肤隔离,可以有效降低皮肤烧伤的发生概率[1,14]。水的比热容较大,能够吸收射频针产生的大部热量,从而降低瘤周正常组织及皮肤的热量吸收,减轻热损伤。因此,本研究设置实验组和对照组,实验组裸鼠肿瘤组织周围注射生理盐水,形成瘤周隔离带,对照组未做此处理,结果显示,实验组裸鼠存活率显著高于对照组,使得在该模型上进行射频消融相关研究更加可靠。
本研究结果显示,2组裸鼠体质量、肿瘤体积和消融时间比较差异均无统计学意义,排除了这些因素对结果可能存在的影响。小鼠背部皮肤烧伤后,不形成肉眼可见的水泡,只是创面呈现不同程度的水肿及色泽发白,以后创面颜色逐渐加深,48~72 h形成痂皮样物,痂皮色泽逐渐加深,并逐渐变厚、变干,烧伤后1~3周,痂皮逐渐从周边顶起、脱落。由于烧伤后创缘清晰,创面面积恒定,后期形成与之大小相同的痂,且烧伤程度越重,创面面积越大,因此,测量射频消融后即刻创面面积可以作为评定烧伤程度的指标。烧伤严重程度往往与温度成正比,所以,测定烧伤创面的温度可以作为评定烧伤程度的指标[15]。烧伤创面的修复过程于伤后不久即开始,烧伤程度越轻,创面炎症越轻,修复越早、越快[15]。因此,测定创面愈合的时间可以作为评定烧伤程度的指标。本研究结果显示,实验组裸鼠皮肤创面面积显著小于对照组,创面温度显著低于对照组,创面愈合时间显著短于对照组,说明瘤周隔离带能够有效减轻射频消融导致的皮肤烧伤。
综上所述,瘤周隔离带可以显著减轻射频消融所致皮肤烧伤,该注射有瘤周隔离带的乳腺癌 MCF-7细胞荷瘤裸鼠模型可用于乳腺癌射频消融治疗的研究。

