腹膜透析液对大鼠腹膜间皮细胞血管内皮生长因子及其受体表达的影响
王雅宁 蔺 超 刘云启 高金祥 刘益涛 高 洁
(滨州医学院附属医院肾内科,山东 滨州 256603)
在长期腹膜透析过程中,腹膜结构和功能的改变与腹膜血管生成密切相关,越来越多证据表明,腹腔局部血管内皮生长因子(VEGF)的上调是其中心环节〔1,2〕。成人VEGF主要通过与其受体VEGFR1(Flt-1)、VEGFR2(Flk-1/KDR)结合发挥生物学效应。此外,Flt-1基因尚编码一种可溶性的形式sFlt-1,其与VEGF有很强的亲和性,与之结合后即阻断VEGF的一系列分子生物学效应〔3〕。与长期腹膜透析腹膜损害有关的诸多因素,如透析液的生物不相容性、葡萄糖降解产物(GDP)、腹腔慢性炎症等均可影响腹腔局部VEGF表达〔4〕。本文旨在探讨不同腹膜透析液对大鼠腹膜间皮细胞(RPMCs)VEGF及其受体表达及分泌的影响。
1 材料和方法
1.1材料 清洁级SD雄性大鼠,体重150~180 g,由山东大学实验动物中心提供。主要试剂:DMEM/F12培养基、DMEM培养基、胎牛血清(FBS,美国Gibco),Trizol试剂(Ambion公司),腹膜透析液(美国Baxter公司),RT试剂盒(Fermentas公司),鸡抗大鼠VEGFR2抗体(Prosci公司),兔抗大鼠VEGFR1抗体(Labvison公司),小鼠抗大鼠GAPDH抗体、小鼠二抗、兔二抗(美国CST公司),鸡二抗(Upstate公司),鼠VEGF及sFlt-1酶联免疫吸附试验(ELISA)试剂盒(R&D公司)。
1.2RPMCs的分离培养及鉴定 取SD雄性大鼠,腹腔内注射含0.25%胰酶及0.02%乙二胺四乙酸(EDTA)溶液进行消化。120 min后无菌操作下剖开大鼠腹腔,吸取腹腔内液体,置15 ml离心管,1 500 r/min离心10 min,弃上清。DMEM/F12(含0.5%FBS)洗涤1次,离心弃上清。加入含12%FBS的DMEM/F12培养基,将细胞打散为均匀悬浮液,接种于25 cm2培养瓶中,置于37℃ 5% CO2培养箱中培养。待90%~95%细胞融合,消化传代。第2代细胞经形态鉴定及抗细胞角蛋白抗体、抗Ⅷ因子抗体免疫组织化学鉴定,确定为腹膜间皮细胞后,用于下游试验。
1.3不同腹膜透析液对RPMCs VEGF及其受体表达的影响 稳定培养的第1代RPMCs消化传代,同步化培养24 h后,分别以不同腹膜透析液〔1.50%葡萄糖腹膜透析液(dextrose)(低糖组)、2.50% dextrose(中糖组)、4.25% dextrose(高糖组)、7.50% icodextrin(糊精组)〕进行刺激培养,无血清DMEM为阴性对照(对照组),刺激24 h后收集细胞,提取核酸及蛋白以供检测。
1.4RT-PCR检测RPMCs的VEGF、VEGFR1、VEGFR2和sFlt-1 mRNA表达 冲洗RPMCs后,按照Trizol试剂盒说明书提取细胞总RNA,随后取2 μg RNA,按逆转录试剂盒说明书合成cDNA。基因序列通过GenBank获得,引物设计由PRIMER5.0软件按照引物要求完成,由上海英骏公司合成。VEGF:上游 5′-CCACGACAGAAGGGGAGCA-3′,下游5′-ACACCGCATTAGG GGCACA-3′;VEGFR1:上游5′-CAAGGGACTCTACAC TTGTC-3′,下游5′-CCGAATAGCGAGCAGATTTC-3′;VEGFR2:上游5′-GCCAATGAAGGGGAACTGAAGAC-3′,下游5′-TCTGACTGCTGGTGATGCTGTCA-3′;sFlt-1:上游5′-AATCTGCTCGCTATTCGGTG-3;下游5′-GTGGGTAGAGAGGTGGGCTT-3′;GAPDH:上游5′-ACCACAGTCCATGCCATCAC-3′,下游5′-TCCACCACCCTGTTGCTGTA-3′。反应结束后取10 μl PCR产物以1.5%琼脂糖凝胶电泳,溴乙锭(EB)染色,凝胶成像系统成像及进行扫描定量分析,以其所测得积分吸光度与内参照GAPDH积分吸光度的比值代表半定量值。
1.5Western印迹检测RPMCs的VEGFR1、VEGFR2蛋白表达 裂解细胞后,置于冰上,4℃ 10 000 r/min离心10 min,收集上清,测蛋白浓度。取20 μl总蛋白上样于7%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)凝胶电泳分离,湿法转膜,5%脱脂奶粉室温1 h。分别加入兔抗大鼠VEGFR1抗体,鸡抗大鼠VEGFR2抗体,小鼠抗大鼠GAPDH抗体,4℃孵育过夜。以辣根过氧化物酶(HRP)标记的相应二抗孵育1 h,洗膜;电化学发光(ECL)显影,自动成像系统成像并分析。
1.6ELISA检测RPMCs培养上清中VEGF及sFlt-1蛋白表达 收集细胞培养上清,离心去除细胞碎片。15 min内加完所有样本,具体步骤按照说明书进行。
1.7统计学方法 采用SPSS17.0软件进行单因素方差分析。
2 结 果
2.1大鼠腹膜间皮细胞的培养和鉴定 常规培养的大鼠腹膜间皮细胞生长至融合状态后呈现多边形、菱形、椭圆形,大小不等,具有典型的鹅卵石状或铺路石样上皮细胞形态,抗大鼠角蛋白(Keratin)、波形蛋白(Vimentin)阳性,证实为腹膜间皮细胞见图1。
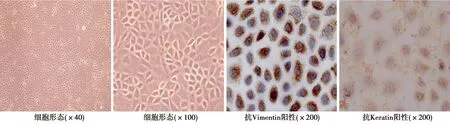
图1 大鼠腹膜间皮细胞的鉴定
2.2各组RPMCs VEGF及其受体mRNA表达 中糖组、高糖组VEGF、VEGFR1、sFlt-1 mRNA表达水平显著高于低糖组、糊精组及对照组(均P<0.01),低糖组与糊精组明显高于对照组(均P<0.05),低糖组与糊精组差异无统计学意义(P>0.05)。中糖组、高糖组VEGFR2 mRNA表达显著低于低糖组、糊精组及对照组(均P<0.01),低糖组与糊精组VEGFR2 mRNA表达低于对照组(P<0.05),低糖组与糊精组差异无统计学意义(P>0.05),见表1,图2。
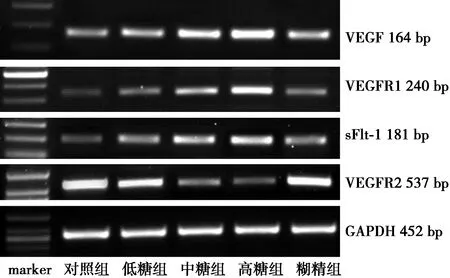
图2 各组RPMCs的VEGF、VEGFR1、sFlt-1和VEGFR2 mRNA表达

组别VEGF mRNAVEGFR1 mRNAsFlt-1 mRNAVEGFR2 mRNA对照组0.236±0.0191)0.118±0.0111)0.131±0.0121)1.234±0.1091)低糖组0.578±0.0231)2)0.203±0.0181)2)0.364±0.0321)2)0.882±0.0651)2)中糖组0.976±0.1100.685±0.0490.782±0.0510.276±0.019高糖组1.146±0.2140.981±0.0780.912±0.1160.193±0.012糊精组0.553±0.0421)2)0.211±0.0211)2)0.385±0.0141)2)0.891±0.0861)2)
与中糖及高糖组比较:1)P<0.01;与对照组比较:2)P<0.05
2.3各组RPMCs VEGF及其受体蛋白表达比较 Western印迹法结果显示,中糖组、高糖组VEGFR1蛋白表达水平显著高于低糖组、糊精组及对照组(均P<0.05),低糖组与糊精组差异无统计学意义(P>0.05);中糖组、高糖组VEGFR2蛋白表达显著低于低糖组、糊精组及对照组(均P<0.01),低糖组明显低于对照组(P<0.01);ELISA结果显示,中糖组、高糖组VEGF、sFlt-1表达水平显著高于对照组(P<0.05),高糖组显著高于低糖组及糊精组(P<0.05),低糖组与糊精组差异无统计学意义(P>0.05),见图3,表2。

图3 各组RPMCs的VEGFR1和VEGFR2蛋白表达

组别VEGF(pg/ml)sFlt-1(pg/ml)VEGFR1VEGFR2对照组236.7±25.4113.1±27.30.142±0.0120.703±0.081低糖组325.3±30.2123.2±21.60.245±0.0270.452±0.0273)中糖组437.2±33.74)152.8±25.44)0.487±0.0321)4)0.211±0.0182)3)高糖组528.1±36.51)4)198.7±36.11)4)0.602±0.0461)4)0.122±0.0102)3)糊精组318.0±28.9121.9±19.90.250±0.0150.649±0.059
与低糖组及糊精组比较:1)P<0.05,2)P<0.01;与对照组比较:3)P<0.01,4)P<0.05
3 讨 论
在腹膜透析过程中,腹腔长时间暴露于传统的含糖腹膜透析液可引起腹膜功能改变、腹膜间皮细胞丢失、血管增生及腹膜纤维化,血管增生可导致腹膜有效表面积增大,溶质转运系数增加,最终导致超滤衰竭〔5〕。研究表明,腹腔局部VEGF的上调是其中心环节〔6,7〕。动物模型表明,高乳酸盐浓度、转化生长因子(TGF)-β1、低pH等均可促使腹膜血管生成、VEGF合成增加。Bajo等〔8〕证实,用传统的腹透液刺激腹膜间皮细胞后,E-钙黏蛋白(cadherin)表达减少,细胞形态发生改变,VEGF表达增加,而接受低GDP腹透液刺激的细胞则无上述变化。VEGF家族成员包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E和胎盘生长因子(PLGF),其中VEGF-A(通称VEGF)是目前发现最为重要的血管生成正性调节因子,主要通过结合VEGFR1(Flt-1)和VEGFR2(Flk-1/KDR)发挥分子生物学效应〔9,10〕,此外,Flt-1基因仅由选择性剪切的6个Ig区域组成,与VEGF有很强的亲和性。VEGF与受体结合后可迅速增加细胞内Ca2+水平,通过磷酸肌醇特异性磷脂酶C途径,使细胞内IP3水平升高,促进新生血管生成、增加血管通透性。Io等〔11〕研究发现,腹膜组织中VEGF及VEGFR-1 mRNA表达增加,在第21和35 d达到高峰,与本文结果趋势一致。Zhang等〔12〕在尿毒症患者腹膜血管壁检测出了VEGFR1和VEGFR2,且VEGFR2与腹膜微血管密度、小分子溶质转运速率及24 h腹膜蛋白排泄密切相关,提示VEGFR2可能是腹膜基线转运特征的重要决定因子。与本研究结果不同,可能与体内检测的是腹膜组织总VEGFR2表达,而本研究仅检测腹膜间皮细胞VEGFR2表达有关。此外,由于sFlt-1缺乏酪氨酸激酶结构域,没有信号转导功能,当sFlt-1出现后与VEGFR1竞争PLGF、VEGF,与VEGFR2竞争VEGF,也是细胞接受刺激后VEGFR2下调的原因〔13〕。最近研究显示,VEGF的高水平可预测患者的全因死亡率,升高的sFlt-1与炎症因子可联合增加患者全因死亡率的风险;此外,sFlt-1同内皮细胞损伤的标志物细胞间黏附分子(ICAM)-1、血管细胞黏附分子(VCAM)-1正相关,VEGF和sFlt-1同C反应蛋白及白细胞计数相关〔14,15〕,提示VEGF及sFlt-1通过促使炎症细胞趋化参与炎症过程〔16〕,其潜在的病理生理学作用可能为在细胞激活过程中,使其更容易受到炎症因子的攻击,甚至同炎症因子有协同作用〔17〕。糊精腹膜透析液含7.5%多聚葡萄糖,由谷物淀粉水解后产生,其85%分子量在16 800~45 000 D,只有6%分子量小于16 800 D。由于其分子量较大,不能通过腹膜上的小孔吸收,只能通过液体的对流缓慢吸收,故能长时间维持有效渗透压浓度,在高转运及高平均转运患者能改善超滤〔4,18〕,且由于其渗透浓度低,较少形成糖基化终产物,故较dextrose生物相容性更好〔19〕,此外,有研究证实,糊精腹膜透析液能更好地保护残余肾功能〔20〕。有文献报道,7.5% icodextrin也会使腹膜间皮细胞增殖和活力下降,细胞内活性氧增加,细胞功能下降,但和1.5% dextrose调节水平一致,且低于4.25% dextrose〔19〕,与本文结果趋势基本一致。笔者推测,7.5% icodextrin对于VEGF系统的调节是其生物相容性较好的机制之一。综上,腹膜透析液能显著上调VEGF及其受体VEGFR1、sFlt-1的表达,下调VEGFR2的表达,以2.5% dextrose及4.25% dextrose 最为显著,7.5% icodextrin对VEGF及其受体的调节水平低于2.5% dextrose及4.25% dextrose,从新的角度证实了icodextrin具有良好的生物相容性,但VEGF的受体在透析液刺激下发生上述变化的意义还待动物模型证实。

