腹腔镜与开腹肝癌切除术治疗原发性肝癌的近期疗效对比研究
沈 忱,王峻峰,赵 华
(1.中国人民解放军第一零零医院,江苏 苏州,215000;2.苏州大学附属第一医院)
专家共识及历年指南提示,原发性肝癌的综合治疗以肝癌切除术为主。自上世纪90年代Reich等[1]成功施行首例腹腔镜肝切除术,腹腔镜微创外科治疗理念引起了各级医院肝胆外科医生的普遍关注[2-5]。近年多宗临床前瞻性及回顾性研究均显示腹腔镜手术治疗良性肝脏肿瘤具有满意的临床疗效[6-9],部分学者已有成功治疗肝脏良性、恶性肿瘤乃至肝移植方面的经验[10-15]。诸多学者围绕肿瘤根治与长期生存开展了一系列的基础与临床研究,部分已得出肯定结论[16-18],但尚无统一标准。现回顾分析苏州大学附属第一医院为178例原发性肝癌患者分别行腹腔镜及开腹肝癌切除术的临床资料,探讨腹腔镜技术的优劣及临床应用意义。
1 资料与方法
1.1 临床资料 选择2010年4月至2016年4月苏州大学附属第一医院收治的178例原发性肝癌患者,术前腹部彩超、上腹部增强CT、MRI、胸片检查明确病变部位,确定未侵犯邻近膈肌,无肝门淋巴结转移及其他部位转移征象,同时行甲胎蛋白(alpha-fetal protein,AFP)动态检查,术前可诊断为原发性肝癌,且符合指南中的可根治病例。178例原发性肝癌中44例伴有慢性乙型病毒性肝炎及不同程度的乙型肝炎后肝硬化。具体术式包括左肝外叶切除术31例,左半肝切除23例,超左半肝切除4例,右半肝切除17例,右肝后叶切除11例,Ⅵ段切除36例,超右半肝切除2例,中肝切除8例,局部不规则切除46例。术前肝功能达Child-Pugh A或B级,身体功能状况Karnofsky评分60分以上。排除标准:(1)心肺肾等重要脏器功能不全、其他手术禁忌;(2)重度门脉高压症(有胃底或食管静脉曲张破裂出血史、严重脾功能亢进或难治性腹水);(3)病理学检查证实为非肝细胞性肝癌、转移性肝癌或良性肿瘤;(4)术中发现肿瘤侵犯肝门甚至腹膜广泛转移,或术中超声提示有肝静脉、门静脉或胆管癌栓;(5)腹腔镜中转开腹。将患者按手术方式进行分组,腹腔镜组96例,开腹组82例。两组患者术前一般资料具有可比性,见表1。
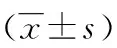
组别年龄(岁)性别(n)男女术式(n)规则性肝切除不规则性肝切除第一肝门阻断(n)肿瘤大小(cm)肿瘤数量 (n) 肿瘤部位(n) Ⅱ、Ⅲ、Ⅳa、Ⅴ、Ⅵ Ⅰ、Ⅳb、Ⅶ、Ⅷ 肝功能Child分级(n)A级B级腹腔镜组50.8±9.144524254524.6±3.4 2.0±1.08797818开腹组53.2±8.746364834384.3±3.83.0±2.056266913t/χ2值1.3720.5651.2130.1310.3470.1020.1670.239P值0.1720.4470.0870.8261.2900.3290.9202.790
1.2 手术方法 两组手术均由相对固定的医生组完成。手术过程均遵循肿瘤根治原则,强调肿瘤及周围组织的整块切除、肿瘤操作的非接触原则、足够的切缘。腹腔镜组:气管插管全身麻醉,患者取仰卧位,双下肢分开,术前准备同常规开腹肝癌切除术。术者立于患者两腿间,助手立于患者两侧。脐下为观察孔,穿刺10 mm Trocar,建立CO2气腹,压力维持在10~14 mmHg。置入腹腔镜探查,并根据肿瘤位置,引导主、辅操作孔围绕病变肝叶呈扇形分布。术前根据肿瘤大小、位置估计术中出血情况,决定是否阻断第一肝门(图1、图2)。如判断需要阻断第一肝门,可分离出第一肝门后放置肝门阻断带,并于另外的5 mm切口引出备用,需要阻断肝门时收紧阻断带以控制入肝血流,阻断时间同常规开腹手术。手术方式的选择遵循彻底性、安全性两大基本原则[19]。多发肿瘤(结节<3枚)局限于肝脏的一段或一叶内,可选择规则性肝切除:(1)游离肝脏:根据肿瘤所在肝段或肝叶,用超声刀充分游离相应的肝周韧带。(2)结合术中实际情况决定是否阻断第一肝门,可按术中所见提前放置第一肝门阻断带。(3)离断肝实质:用超声刀缓慢离断肝脏表面组织;用超声刀及LigaSure离断肝脏深层组织;距主供血管最近的位置切开肝表面组织,找到肝段主供血管夹闭后切断。对于较大血管,用钛夹或生物夹夹闭后离断。(4)标本处理:将切除的肝脏肿瘤置入标本袋内,适当延长手术切口并取出。不规则性肝切除术主要应用于肝脏边缘肿瘤的切除,用超声刀或LigaSure距病灶边缘大于1 cm处离断肝组织,无需解剖肝门的脉管结构。断面小血管及胆管可用超声刀或LigaSure直接离断;直径大于3 mm的管道,可用LigaSure直接离断或钛夹夹闭后切断。反复冲洗肝断面,检查确保无渗血、胆漏,必要时放置可吸收止血海绵、喷洒生物凝胶预防术后迟发性出血。彻底清洗腹腔并放置引流管。开腹组按传统手术方法施术[20]。
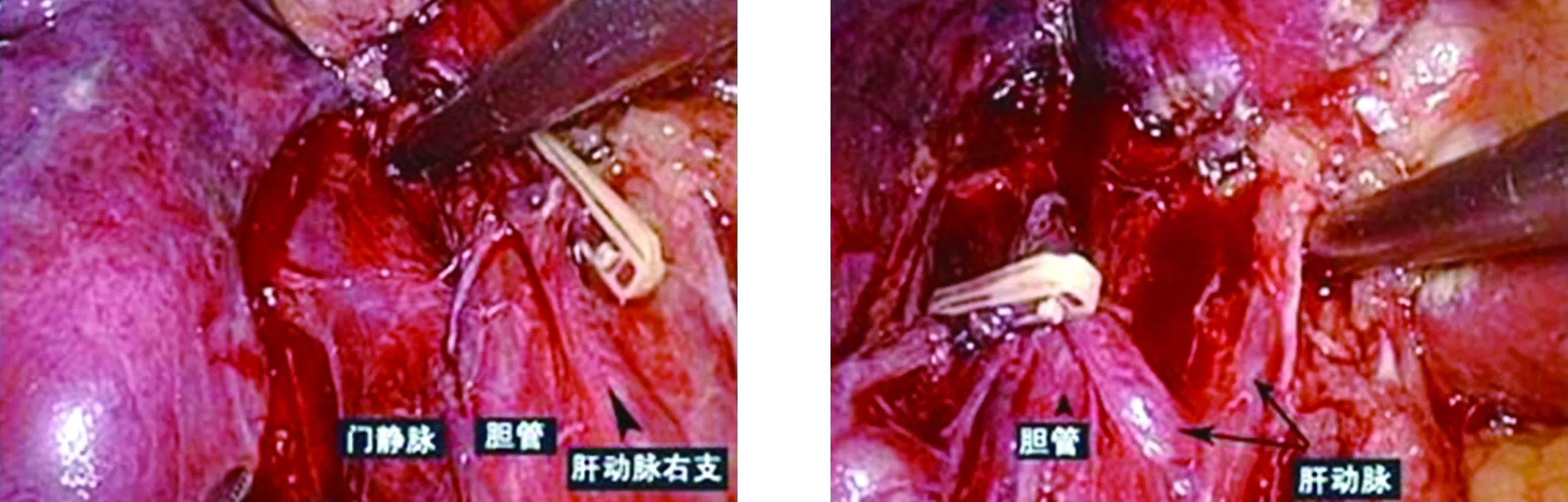
图1 第一肝门 图2 明确肝胆管、肝动脉、门静脉一级分支
1.3 评价指标 (1)手术相关指标:手术时间、切口长度、术中出血量;(2)根治指标:肿瘤距切缘距离;术后2个月AFP;术后2个月腹部超声、CT、MRI检查阴性结果(无复发转移的影像学表现);(3)术后恢复指标:首次下床活动时间、进流质饮食时间、住院时间;肝功能的恢复(TBIL、ALT、AST、ALB、PT);并发症:术后出血、胆漏、切口感染、肺部感染、非手术并发症(心肺方面、下肢深静脉血栓形成)等发生率。
1.4 统计学处理 采用SPSS 16.0软件进行数据分析,计量资料采用独立样本t检验,定性资料的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结 果
2.1 围手术期手术相关指标 两组均完成肝癌切除术,腹腔镜组无一例中转开腹。腹腔镜组手术时间长于开腹组,差异有统计学意义(P<0.05);切口长度、首次下床活动时间、首次进食时间、术后住院时间均优于开腹组,差异有统计学意义(P<0.05);两组术中出血量差异无统计学意义(P>0.05)。见表2。
2.2 根治指标 两组切缘距肿瘤距离、术后2个月AFP检测及超声、CT、MRI等影像学检查阴性结果差异无统计学意义(P>0.05)。术后2个月复查影像学检查提示腹腔镜组3例出现肝内转移、1例出现右下肺独立转移病灶;开腹组3例发生肝内转移。见表3。
2.3 术后肝功能恢复指标 术前及术后第1天,两组TBIL数值差异无统计学意义(P>0.05);第5天差异有统计学意义(P<0.05)。术前,两组患者ALT、AST差异无统计学意义(P>0.05),术后第1天、第5天差异有统计学意义(P<0.05)。术前、术后第1天、术后第5天两组患者PT差异均无统计学意义(P>0.05)。术前两组患者ALB差异无统计学意义(P>0.05),术后第1天、第5天差异有统计学意义(P<0.05)。见表4。
2.4 围手术期并发症 两组无围手术期死亡病例。腹腔镜组15例(15.6%)术后发生并发症,包括肺部感染、反应性胸腔积液5例,2例肝硬化较重者术后出现腹水、胸水,3例出现腹腔感染、膈下脓肿,标本取出切口感染2例,尿路感染2例,胆漏1例;均经抗感染、营养支持、通畅引流等保守治疗后治愈。开腹组12例(14.6%)术后发生并发症,包括切口脂肪液化、切口感染7例,5例出现反应性胸腹腔积液、肺部感染、腹腔感染,均经保守治疗后治愈。两组并发症发生率差异无统计学意义(P>0.05)。见表3。
2.5 随访结果 腹腔镜组96例中72例(75.0%)获得随访2个月~3年。25例出现肝脏复发(非原位)及肝内外转移,12例于术后4~27个月死亡,60例无瘤生存或后续经导管动脉化疗栓塞、射频消融及再次手术等治疗后生存至今;术后1年总体生存率、无瘤生存率分别为91.7%与80.6%,3年总体生存率及无瘤生存率分别为83.3%与48.6%。开腹组82例中69例(84.1%)获得随访2个月~3年。21例出现肝脏复发(非原位)及肝内外转移,14例于术后4~31个月死亡,55例无瘤生存或经后续经导管动脉化疗栓塞、射频消融及再次手术等治疗后生存至今;术后1年总体生存率、无瘤生存率分别为94.2%与78.3%,3年总体生存率、无瘤生存率分别为79.7%与49.3%。见图1。
3 讨 论
随着腹腔镜在各学科的开展,腹腔镜手术切口小、术后疼痛轻、术后下床活动早、住院时间短的优点已得到公认。对于腹腔镜下肝癌的治疗,只有保证可取得与开腹手术相同的根治效果时,这一微创优势才成立。本研究表明,腹腔镜组肿瘤根治指标与开腹组差异无统计学意义,表明腹腔镜手术可达到开腹手术的近期根治效果。腹腔镜组切口长度、术后首次下床活动时间、首次进食时间、术后住院时间、术后肝功能恢复指标均优于开腹组,表明腹腔镜手术治疗原发性肝癌具有微创优势及临床应用价值。这也与近年国内外研究相近[21-25]。

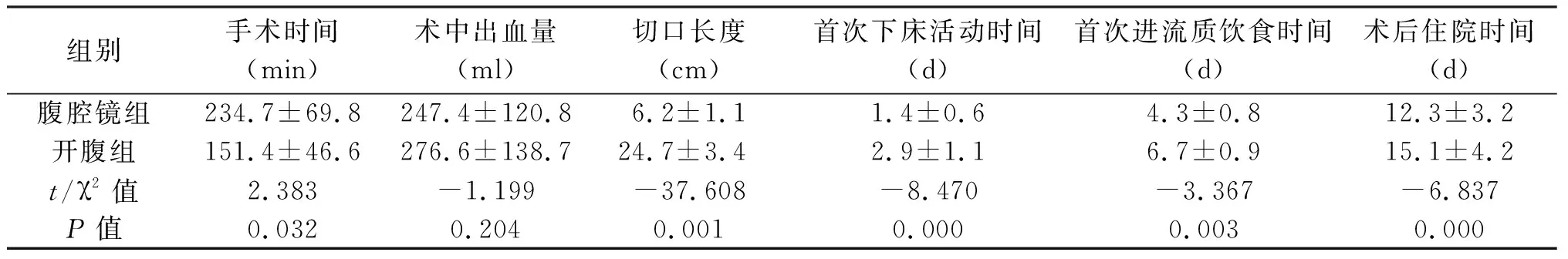
组别手术时间(min)术中出血量(ml)切口长度(cm)首次下床活动时间(d)首次进流质饮食时间(d) 术后住院时间(d)腹腔镜组234.7±69.8247.4±120.86.2±1.11.4±0.64.3±0.812.3±3.2开腹组151.4±46.6276.6±138.724.7±3.42.9±1.16.7±0.915.1±4.2t/χ2值2.383-1.199-37.608-8.470-3.367-6.837P值0.0320.2040.0010.0000.0030.000


组别切缘距肿瘤的距离(cm)术后AFP降低[n(%)]术后2个月复发、转移[n(%)]术后并发症[n(%)]腹腔镜组2.3±0.847(13.3±7.6)4(4.2)15(15.6)开腹组2.0±0.735(15.2±6.3)3(3.7)12(14.6)t/χ2值1.0300.3121.2281.352P值0.3870.1520.2450.621

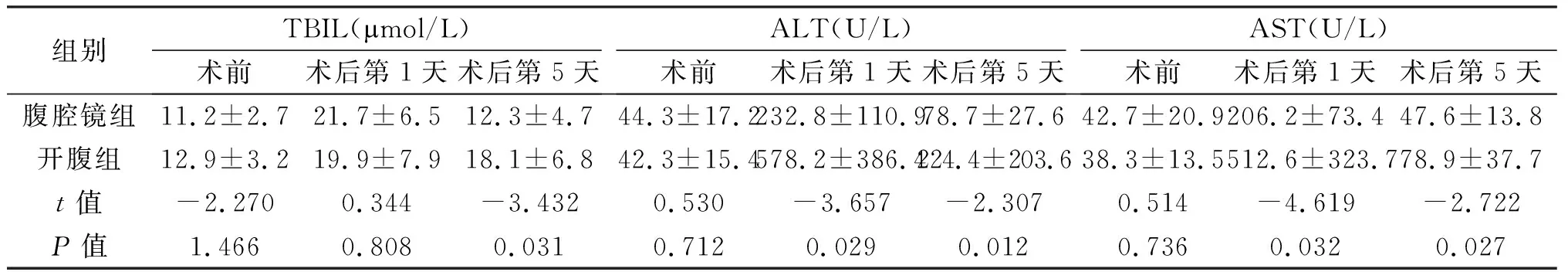
组别TBIL(mol/L)术前术后第1天术后第5天ALT(U/L)术前术后第1天术后第5天AST(U/L)术前术后第1天术后第5天腹腔镜组11.2±2.721.7±6.512.3±4.744.3±17.2232.8±110.978.7±27.6 42.7±20.9206.2±73.447.6±13.8开腹组12.9±3.219.9±7.918.1±6.842.3±15.4578.2±386.4224.4±203.638.3±13.5512.6±323.778.9±37.7t值-2.2700.344-3.4320.530-3.657-2.3070.514-4.619-2.722P值1.4660.8080.0310.7120.0290.0120.7360.0320.027
续表4

组别 PT(s)术前术后第1天术后第5天ALB(g/L)术前术后第1天术后第5天腹腔镜组12.9±1.413.9±1.512.4±1.141.2±10.635.2±4.037.2±2.6开腹组13.1±1.214.2±1.713.2±1.640.8±9.430.2±5.831.8±4.2t值-0.842-1.746-0.9310.1312.7024.202P值0.6741.6020.8730.7620.0210.014

图1 两组患者无瘤生存率的比较
腹腔镜组在手术时间方面居于劣势。这不仅与术中情况有关,还与医疗组相关理论、实践积累的周期密不可分。由于腹腔镜手术是在视频中观察内脏器官,手术操作通过腔镜器械完成,并且腹腔内的操作与移动是相反的,造成初学者手术视野立体感的缺失及触觉丧失,因此开展初期,手术时间、术中并发症及中转开腹率较高。这与Scatizzi等、Allieta等在腹腔镜胃癌切除术中所描述的学习曲线相符合[26-27]。触觉的丧失,使外科医生缺少诊治的重要“武器”,增加了术中与术前诊断不相符的几率[28-30]。然而腹腔镜下手术能多方位、多角度检查确认肝脏及腹腔情况,且不牵动周围器官,甚至可观察到隐蔽性较大的神经、血管。腹腔镜的视野放大作用可清楚辨认2 mm以上的脉管,并予以恰当处理,结合LigaSure能安全、永久地闭合直径达7 mm的血管,提高了手术的准确性、精确性,减少了术后出血、胆漏等并发症的发生。相信在大量积累相关理论及实践后,手术时间会缩短[31-32]。
本研究中,采用TBIL、ALT、AST、PT、ALB作为观察术后肝功能恢复的指标。合并肝硬化或慢性肝炎是我国肝癌患者的特征,肝切除术后患者的近期获益首先要考虑手术对患者肝功能的影响。术后第5天两组患者间血清TBIL、ALT、AST、ALB的变化差异均有统计学意义,表明腹腔镜组在术后肝功能恢复方面优于开腹组,提示腹腔镜肝切除术对肝功能的影响较小,利于减少术后肝衰竭的发生,增加了手术的安全性。
综上所述,本研究肯定了腹腔镜肝癌切除术的根治效果及临床应用价值,不仅能达到与开腹手术相当的根治标准(切缘距离、2个月后AFP恢复水平及影像学复查阴性结果),同时具有切口小、手术安全可靠、术后康复快等优点,近期效果良好。虽然缺少多国多中心的前瞻性对照研究及临床观察证明其远期疗效,但通过消除劣势,扩大优势(遵循学习曲线),腹腔镜肝癌切除术会展现更多的应用价值。

