根瘤共生对紫花苜蓿抗寒性的影响
刘雨诗, , , , *, *
(1.西北农林科技大学动物科技学院 草业科学系, 陕西 杨凌712100; 2. 陕西省草原工作站, 陕西 西安710016;3. 陕西省林业科学研究院, 陕西 西安710082)

1 材料与方法
1.1 试验材料
本研究采用保定紫花苜蓿(MedicagosativaL. ‘Baoding’)种子为供试材料,由中国农业科学院北京畜牧兽医研究所提供。经1% NaClO消毒后置于铺有湿润滤纸的9 cm培养皿中,保持滤纸湿润,发芽5 d后移至西北农林科技大学草业温室中培养(温度:昼/夜 30±5℃ / 20±5℃; 湿度:昼/夜 55±5% / 70±5%)。幼苗处理分为2组:接种苜蓿专用根瘤菌多萌(Rhizobiummelilotistrain Dormal)的紫花苜蓿(AN)和不接种根瘤菌的紫花苜蓿(NN)。AN浇改良霍格兰氏无氮营养液,NN浇全氮营养液[27]以确保其正常生长。本课题组前期研究发现,接种根瘤菌苜蓿AN和无根瘤菌苜蓿NN的氮含量,碳含量,以及磷含量无显著差异[28]。生长60 d的幼苗进行第一次刈割,90 d后进行第2次刈割,到120 d时,进行低温胁迫试验。
1.2 低温处理
当苜蓿幼苗生长到120 d后,随机选择AN和NN苜蓿,放入植物培养箱进行-6℃低温处理12 h。
1.3 样品采集
紫花苜蓿地上部分和地下部分分别采样,共设置7个采样时间点,分别为低温胁迫0 h,2 h,4 h,6 h,8 h,10 h,12 h时进行采样。试验设置3次重复。除电导率与叶绿素指标使用鲜样外,其余指标测定均使用冻样。用锡箔纸包好采集的样品,迅速放入液氮10 min,存放于-80℃冰箱,待后续测量生理指标。
1.4 指标测定方法
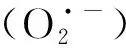
1.5 数据分析
试验数据采用SPSS 19.0 (SPSS Inc., Chicago, IL, USA)统计软件分析,独立样本t检验进行方差分析,设置相应置信区间百分比95%。使用GraphPad Prism 5作图。
2 结果与分析
2.1 紫花苜蓿根际状态
不同处理下紫花苜蓿的根际结瘤状况不同,其中AN根部有粉色根瘤,而NN根部无根瘤(见图1)。

图1 AN和NN根部情况Fig.1 Root situation of AN and NN注:AN表示接种根瘤菌苜蓿(红色箭头指出了粉色根瘤);NN表示不接种根瘤菌苜蓿,下同Note: AN indicates activated-nodules alfalfa (Red arrows show the pink nodules in the roots of AN);NN indicates non-nodules alfalfa. The same as below
2.2 根瘤对紫花苜蓿幼苗细胞膜的影响
细胞的膜系统是植物遭遇低温伤害的首要部位,随胁迫时间加长,AN和NN的叶片相对电导率均呈逐渐上升趋势。尽管NN在6 h至12 h间,叶片电导率出现波动,但总体上均高于AN。在低温胁迫6 h、8 h、10 h时,AN的叶片电导率显著低于NN(P<0.05)(见图2)。
在正常生长条件下,AN和NN的丙二醛含量差异不显著;低温胁迫期间,2组苜蓿的地上部分和地下部分丙二醛含量都随着胁迫时间的延长而升高,说明低温对AN和NN细胞膜的损伤逐渐增大,并且胁迫后期,AN显著低于NN(P<0.05)(见图3)。

图2 低温胁迫下根瘤对紫花苜蓿叶片相对电导率的影响Fig.2 Effect of nodulation on relative conductivity of alfalfa leaf under cold stress注:图中*表示差异显著(P<0.05)。下同Note:* indicates significant difference at the 0.05 level. The same as below

图3 低温胁迫下根瘤对紫花苜蓿地上部分和地下部分丙二醛含量的影响Fig.3 Effect of nodulation on MDA content of alfalfa shoot and root under cold stress注:图a表示地上部分,图b表示地下部分Note: Fig.a indicates shoot part of alfalfa; Fig.b indicates root part of alfalfa
2.3 根瘤对紫花苜蓿细胞渗透势的影响
低温胁迫前,AN和NN的渗透势差异不显著。胁迫开始后,AN和NN渗透势都呈下降趋势。AN渗透势6 h后下降趋势较明显,NN的渗透势下降相对平缓。在胁迫4 h、8 h、10 h、12 h时,AN的渗透势显著低于NN(P<0.05),在12 h低温胁迫下, AN的渗透势比NN低0.74 Mpa(见图4)。

图4 低温胁迫下根瘤对紫花苜蓿渗透势的影响Fig.4 Effect of nodulation on osmotic potential of alfalfa under cold stress
2.4 根瘤对紫花苜蓿胞内活性氧积累及抗氧化剂含量的影响
低温胁迫处理后的紫花苜蓿胞内活性氧含量增加,非酶抗氧化物质还原性谷胱甘肽(GSH)逐渐升高(见图5、图6与图7)。
过氧化氢含量随低温胁迫时间的延长而积累。地上部分过氧化氢含量比根积累更快。胁迫6 h以后,AN地上和地下部分产生的过氧化氢显著低于NN。在0 h时, AN地上部分的过氧化氢含量显著高于NN,然后二者在胁迫2 h后处于同一水平,但在8 h,12 h时,NN过氧化氢含量超过AN中含量,且差异显著(P<0.05)。地下部分低温胁迫中,前6 h二者差异不显著,胁迫后8 h开始,AN的过氧化氢含量显著低于NN(P<0.05),见图5。
超氧阴离子自由基含量随低温胁迫时间的延长呈波动上升趋势。虽然AN和NN超氧阴离子自由基含量在某些时间点无显著差异,但总体NN含量高于AN。地上部分中,NN相比AN在4 h、10 h和12 h时含量较高(P<0.05)。地下部分中,NN相比AN在4 h,6 h和12 h时含量较高(P<0.05),见图6。
GSH作为非酶氧化清除剂,随胁迫时间延长,在植物体内含量逐渐增加。低温胁迫6 h后,AN体内积累更多的GSH。AN地上部分GSH含量在胁迫6 h、8 h、10 h时显著高于NN,分别为NN的1.25,1.12和1.37倍(P<0.05);AN根中GSH含量在处理6 h、8 h、12 h时显著高于NN,分别为NN的1.33,2.33和1.28倍(P<0.05),见图7。
试验中随低温胁迫时间延长,AN和NN的VC含量呈下降趋势,但与NN相比,AN中VC含量更高。根瘤菌处理组AN地上部分的VC含量在4 h、10 h、12 h时显著高于NN(P<0.05),地下部分VC含量在2 h时显著高于NN(P<0.05)(见图8)。
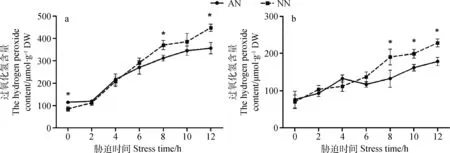
图5 低温胁迫下根瘤对紫花苜蓿过氧化氢含量的影响Fig.5 Effect of nodulation on hydrogen peroxide content of alfalfa shoot and root under cold stress注:a表示地上部分,b表示地下部分Note: a indicates shoot part of alfalfa; b indicates root part of alfalfa

图6 低温胁迫下根瘤对紫花苜蓿超氧阴离子自由基含量的影响Fig.6 Effect of nodulation on superoxide anion radical content of alfalfa shoot and root under cold stress

图7 低温胁迫下根瘤对紫花苜蓿还原性谷胱甘肽含量的影响Fig.7 Effect of nodulation on GSH content of alfalfa shoot and root under cold stress

图8 低温胁迫下根瘤对紫花苜蓿抗坏血酸VC含量的影响Fig.8 Effect of nodulation on VC content of alfalfa shoot and root under cold stress
2.5 根瘤对紫花苜蓿叶绿素含量的影响
低温胁迫后,AN叶绿素含量先增加后减少;NN叶绿素含量先减少,后略微增加,又减少,总体呈下降趋势。AN的叶绿素a含量在4 h、6 h、8 h时显著高于NN(P<0.05);处理组AN的叶绿素b含量在4 h、6 h时显著高于NN(P<0.05);与NN相比,AN的叶绿素总量在胁迫中期维持在较高水平,在4 h和8 h时二者差异显著(P<0.05)(图9)。

图9 低温胁迫下根瘤对紫花苜蓿叶绿素a,b及叶绿素总量的影响Fig.9 Effect of nodulation on chlorophyll a, b and total chlorophyll content of alfalfa shoot under cold stress注:a表示叶绿素a含量;b表示叶绿素b含量;c表示叶绿素总含量Note: a indicates the chlorophyll a content; b indicates the chlorophyll b content; c indicates the total chlorophyll content
3 讨论
低温逆境下植物细胞的膜系统首先受到损伤。膜上不饱和脂肪酸氧化降解,膜孔隙变大,胞内离子外渗,相对电导率升高,故常通过相对电导率的变化判断细胞膜受伤害情况,越高的相对电导率预示着膜系统受损越严重[36]。本研究发现低温胁迫后,电导率含量升高,但AN的电导率较NN的要低,说明NN植物细胞内有更多的离子外渗,与李莎莎等[27]关于根瘤共生苜蓿在低温胁迫下电导率变化研究结果一致。MDA是细胞膜膜脂过氧化的产物之一,能强烈的与胞内各物质反应,它的积累还会进一步加剧对酶和膜的损伤,所以抗逆生理研究中也常用MDA作为氧化损伤指标[37-39]。AN和NN的MDA含量随胁迫时间延长逐渐上升,但NN的MDA积累速率明显快于AN,说明相对于不接种根瘤菌的紫花苜蓿NN,接种根瘤菌紫花苜蓿AN 能降低MDA产生速率以减少因低温造成的细胞膜损伤。
低温胁迫下,植物自身会产生大量渗透调节物质,引起植物叶片渗透势降低;渗透势越低的植物在逆境中的调节能力越强[40]。在持续低温胁迫下,AN比NN保持更低的渗透势,说明紫花苜蓿在根瘤共生的情况下,对外界胁迫产生了更快更强的渗透保护作用,能更好的维持自身细胞膜稳定性。
正常生长条件下,植物体内自由基的产生与清除处于动态平衡的稳态中,当植物遭遇胁迫时,这种稳态会被打破,导致自由基在胞内迅速积累,清除剂含量下降,破坏膜质的双层结构,对细胞膜系统造成损伤,促使植物细胞膜脂质过氧化,抑制植物生长[41]。活性氧分子如超氧阴离子自由基与过氧化氢的累积会导致植物细胞氧化损伤[42]。低温胁迫下,AN比NN具有较低的过氧化氢含量和超氧阴离子自由基含量,表明根瘤菌共生能在一定程度上抑制活性氧的产生。自由基的大量积累,会使不饱和脂肪酸链降解,破坏细胞膜,致使MDA积累,电解质渗出[43-44],这与本试验研究发现的胁迫后NN积累更多活性氧自由基,产生更多MDA含量和相对电导率的结果相一致,说明根瘤与紫花苜蓿互作后,能增加苜蓿细胞内环境的稳定性。
抗逆性强的植株比抗逆性弱的植株拥有更高的抗氧化剂水平[45-46]。当植物遭受胁迫后,GSH含量的提高,可抑制不饱和脂肪酸生物膜分解,清除氧化剂羟基和H2O2,防止膜质过氧化,增强植物抗逆性[47]。已有研究结果表明,耐低温转基因番茄比野生型番茄在低温下产生更高的GSH含量[48]。本试验结果表明,在低温胁迫6 h后,根瘤固氮的AN苜蓿,GSH含量显著升高并维持在高水平,这说明与根瘤互作后,GSH含量能在植物遭受低温胁迫后显著升高,增强苜蓿的耐寒性。
VC是植物体内的一种重要维生素,同时具有抗氧化作用,其含量的多少与植物营养价值、抗逆、抗衰老能力相关,不适宜的温度将导致VC含量下降[49]。本研究中AN和NN在根际中的VC含量于胁迫后期大致相当,但在地上部分中,AN的VC含量在胁迫后期显著比NN中的含量高,表明在较长时间的低温下,根瘤固氮可以在一定程度范围内延缓植物VC含量的损失,缓解植物在逆境下的不利状态。
低温则影响植物的光合作用。叶绿素作为参与光合作用的核心物质,在低温下会被抑制生物合成,含量降低,常用来反应植株叶片受胁迫程度[50-51]。本试验在同等胁迫情况下,与根瘤菌共生的苜蓿植株较不接种根瘤菌的植株,表现出更缓慢的叶绿素分解速度,这说明接种根瘤菌在一定程度上能降低低温胁迫给植物叶片带来的损伤,延缓低温导致的叶片光合损失。
4 结论
与根瘤菌共生结瘤固氮一定程度上能增加紫花苜蓿的渗透调节能力,维持光合作用水平和氧化物清除能力,从而提高紫花苜蓿对低温胁迫环境的抵抗力,有助于提高紫花苜蓿在寒冷地区的生存能力。

