下肢缺血的影像学评估及新进展
申军岳,郑月宏
(1中国医学科学院北京协和医院血管外科,北京 100730;2清华大学医学院,北京 100084)
下肢动脉缺血是临床上最常见的外周动脉疾病(peripheral arterial disease,PAD)。影像学检查对下肢动脉缺血的诊断和评估具有重要的临床意义。传统的方法包括双相超声、计算机断层扫描血管造影(computed tomography angiography,CTA)、磁共振血管造影(magnetic resonance angiography,MRA)或数字减影血管造影(digital subtraction angiography,DSA)等,它们可以对病变血管的解剖结构进行充分和准确的评估,并指导治疗方法的选择。但一些研究表明,通过上述影像学评估方式成功进行血运重建的严重下肢缺血(critical lower extremity ischemia, CLI)的患者, 仍有9%的截肢率[1]和多达18%持续缺血性溃疡[2],表明PAD尤其是CLI的预后与肢体的功能灌注水平密切相关,而不仅仅与病变血管的解剖结构相关[3],因此近年来一些评估血流灌注情况的成像方法逐渐应用于下肢缺血的诊断、治疗以及疗效评估中,并有了很大的发展。本文将对下肢缺血的影像学评估方法及其新进展进行综述。
1 超声
1.1 双相超声
双相超声因为其操作简易、价格便宜、检查时间相对较短,并且无创、无辐射等特点成为评估急性和慢性下肢缺血最常用的影像学检查方法, 且具有很好的敏感性和特异性[4]。但是超声检查一方面受到了检查者经验水平的限制,另一方面,在同一区域出现多根血管狭窄时其精确度会存在差异。
1.2 激光多普勒血流仪
激光多普勒血流仪最初由Gahlen等[5]在1975年提出,它可以描述测量区域的包括毛细血管、小动脉、小静脉和分流血管在内的总微循环血液灌注。Ray等[6]通过激光多普勒血流仪检测发现,相对于健康对照组,间歇性跛行患者闭塞血管2 min再恢复血运后,激光多普勒流量(laser Doppler flux, LDF)出现的时间存在显著性延迟,且超过100 s的LDF达峰时间与失败的血运重建、截肢以及伤口愈合风险增加相关,这证实了激光多普勒血流仪在下肢缺血中的诊断和预后中应用的价值。2007年Ludyga等[7]对症状性PAD患者进行跑步机实验,并分别用传统多普勒和激光多普勒血流仪检测踝肱指数(ankle brachial index, ABI)水平,结果表明ABI-多普勒和ABI-激光多普勒与出现跛行的距离具有相近的相关性,但激光多普勒血流仪具有不受使用者技能限制、更快、更简单的优点。
1.3 超声造影
超声造影(contrast enhanced ultrasound, CEUS)技术可以通过对微泡对比剂在造影区域的定量分析,绘制时间强度曲线(time intensity curve, TIC),实现定量分析下肢骨骼肌的灌注。Duerschmied等[8]注射造影剂后,PAD患者小腿肌肉的造影剂强度达峰时间明显长于健康对照组,而越严重的PAD患者达峰时间也越长,这表明了CEUS在PAD诊断和严重程度判断中可能存在的价值。而Thomas等[9]在2015年的一项研究中亦发现了该种现象。因此,CEUS可能是诊断或监测PAD的一种有效手段。但其使用价值仍需大型临床试验进一步验证。
2 血管造影
2.1 数字减影血管造影
DSA因其具有最高的空间分辨率,可提供最为准确的血管信息,被认为是评估动脉闭塞性疾病的金标准,且是唯一可以在对动脉疾病进行诊断的同时进行治疗的影像学评估方法。但DSA的主要问题是动脉穿刺和对比剂输注后造成的并发症,尤其是因对比剂输注造成的肾功能损伤。目前静脉水化,即在对比剂暴露前4 h使用0.9%生理盐水溶液或静脉注射碳酸氢钠是最有效预防肾功能损伤的措施[10]。对于肾功能严重不全或对传统对比剂严重过敏的患者,CO2和增强剂钆亦可替代传统对比剂。由此,DSA的有创性以及容易出现并发症的缺点限制了其在临床上的使用,并逐渐被CTA和MRA这些相对无创的影像学评估方法取代。
2.2 吲哚菁绿血管造影
近十年一些研究探索了吲哚菁绿血管造影(indocyanine green angiography, ICGA)在PAD患者中诊断和血运重建疗效评估中的价值。 Braun等[11]发现,ICGA可以评估由于血管钙化导致ABI和脚趾压力无法测量的PAD患者的灌注情况。Terasaki等[12]通过绘制TIC曲线,定量地对PAD患者进行术前ICGA评估,以对比剂增强起始至增强强度值达到最大所用时间的1/2(T1/2)为评估标准。结果表明Fontaine Ⅱ级患者中位对比剂T1/2为23 s,Fontaine Ⅲ级患者为41 s。而在Fontaine Ⅳ级患者中,10 s荧光强度值为28(根据受试者工作特征曲线计算,灵敏度和特异性分别为100%和86.6%),可用于判断经皮氧分压(transcutaneous partial pressure of oxygen,TcPO2)<30 mmHg(1 mmHg=0.133 kPa)的组织。此外,Igari等[13]研究结果亦表明ABI与ICGA得到的数据具有良好的相关性。但ICGA的临床使用仍需要对设备和具体操作进行标准化,比如进行信号强度与荧光初始检测之间的比较,从而确定具有可重复性的、可以准确描述下肢灌注情况的参数。
2.3 二维灌注成像
二维灌注成像(2-dimensional perfusion,2DP)是一种数据后处理软件,可以在DSA期间对感兴趣区(regions of interest,ROIs)的对比剂流量进行颜色编码和数据处理。这种技术通过生成像素密度或信号强度(signal intensity, SI)曲线来定量评估血管造影情况,并根据SI来评估血流情况,从而实现对灌注情况进行评估。这种方法解决了DSA对灌注情况评估的局限性,因为DSA的功能性评估主要依据临床医师的视觉判断,具有一定的主观性。Kim等[14]在一项前瞻性研究中证实了2DP可以实时地、定量地观察到血运重建后下肢动脉血流的改变。
3 计算机断层扫描血管造影和磁共振血管造影
CTA和MRA对于下肢缺血的诊断都具有很高的敏感性和特异性,且相对于DSA来说,没有穿刺等造成的并发症。研究表明,对于主髂动脉病变造成的下肢缺血,单独应用CTA或MRA进行评估和用DSA进行评估对旁路移植术的预后没有差异[15]。但对于膝以下的血管病变,血管成像仍然是首选方式[16]。Romano等[17]报道,在主髂动脉段和股腘动脉水平,CTA的灵敏度和特异度均在94%~99%,但CTA对小腿动脉的灵敏度仅为85%。近些年随着CT技术水平的发展,64排CT的使用使得时间和空间分辨率明显提高,可以更加清晰地显示肢体远端血管病变。此外,随着多种重建技术的发展,如遮蔽表面技术、最大密度投影技术、多平面重建技术和虚拟内镜技术等,均可以实现立体重建,从而对血管进行三维显像,并且可以减少钙化对CTA现象的影响。多种重建方法的建立使得CTA在血管疾病领域中的应用越来越广泛。
研究表明,对下肢远端血管进行成像时,MRA可能比DSA更敏感[18,19]。MRA可以在没有增强剂的情况下得到,亦可以通过使用钆对比剂进行增强得到。增强磁共振血管造影(contrast enhanced MRA, CEMRA)可以提供近似DSA的图像质量,但研究表明钆对比剂可以导致某些患者出现肾源性系统性纤维化(nephrogenic systemic fibrosis, NSF)[20]。一般来说,CLI患者中糖尿病和肾功能不全的患病率更高,而慢性肾功能不全的患者中PAD的发生率亦较高[21]。因此,CEMRA可能在这些人群中的使用受到了限制。尽管研究表明钆增强的CEMRA相对时间飞跃 (time of flight, TOF)技术具有更高的诊断准确性[22],但无对比剂MRA(non-enhanced MRA, NEMRA)技术避免了NSF的风险。近年一些新的NEMRA成像方法的提出,以及3T磁场的应用,允许在更大范围上有效描绘动脉并抑制静脉信号,显著提高了图像采集速度,在一定程度上解决了TOF图像采集过慢的问题。这些新方法包括心电门控3D快速自旋回波成像[23]、Native SPACE[24]、时间分辨率对比剂动力成像/时间分辨随机轨迹显像技术(time-resolved imaging of contrast kinetics/time-resolved angiography with interleaved stochastic trajectories,TRICKS/TWIST) MRA[15]技术以及3D平衡稳态自由进动[25]等技术。近年用于临床的非减影2D静脉间隔单次激发(quiescent-interval single-shot,QISS)技术在对下肢缺血的诊断中,相对于Native SPACE具有更高的特异度(95.6%vs87.0%)[26],在对CLI的诊断中,相比于3D快速自旋回波成像具有更高的灵敏度(79.5%vs96.0%)和图像质量[27]。
伪影是CTA和MRA共同存在的问题,尤其是血管钙化对CTA的影响。但血管的钙化不会导致MRA产生伪影,因此MRA对经常出现弥漫性血管钙化的PAD患者可能是更优的选择。此外,MRA亦没有CTA辐射以及因需要后续干预治疗而多次输注对比剂的问题。但CTA相比MRA成像时间更短,亦基本不会因体内植入物或患者幽闭恐惧症而受到限制。
4 高光谱成像
高光谱成像(hyperspectral imaging,HSI)是一种评估PAD和CLI的新方法,在临床使用中仍处于起步阶段。它通过测定皮下毛细血管网氧合血红蛋白及脱氧血红蛋白对特定波长(500~600 nm)可见光的吸收情况,建立组织氧合的空间图,将数字成像技术与传统光谱学相结合,从而实现对目标区域血流关注情况的评估。Chin等[28]采用此技术在一项前瞻性研究发现,PAD患者和非PAD患者脚踝下皮肤中的氧合血红蛋白水平没有显示出明显差异。然而,PAD患者足底血管区域(angiosome)的脱氧血红蛋白含量显著下降。多普勒超声检查亦发现PAD患者脱氧血红蛋白含量呈下降趋势,证实了HSI的发现。但临床研究结果并不一致[29]。Sumpio等[30]在另一前瞻性研究中发现,和健康受试者相比,PAD患者进行袖带血流阻断5 min后,上臂的氧合血红蛋白水平显著降低。而PAD患者的脱氧血红蛋白虽然亦相对更低,但没有显著性差异,因此有待进一步研究。与传统无创性实验室检查方法相比,HSI可以在特定的解剖部位进行更精细的灌注评估。且因为不需要接触患者来进行目标区域的成像,避免了因溃疡等限制使用的问题。HSI作为下肢缺血诊断和评估预后的工具有重要的潜在优势,但仍需长期和基于大量人群的研究来证明其有效性。其标准化的测量方法亦需进一步建立。
5 下肢缺血解剖和功能影像学评估总结
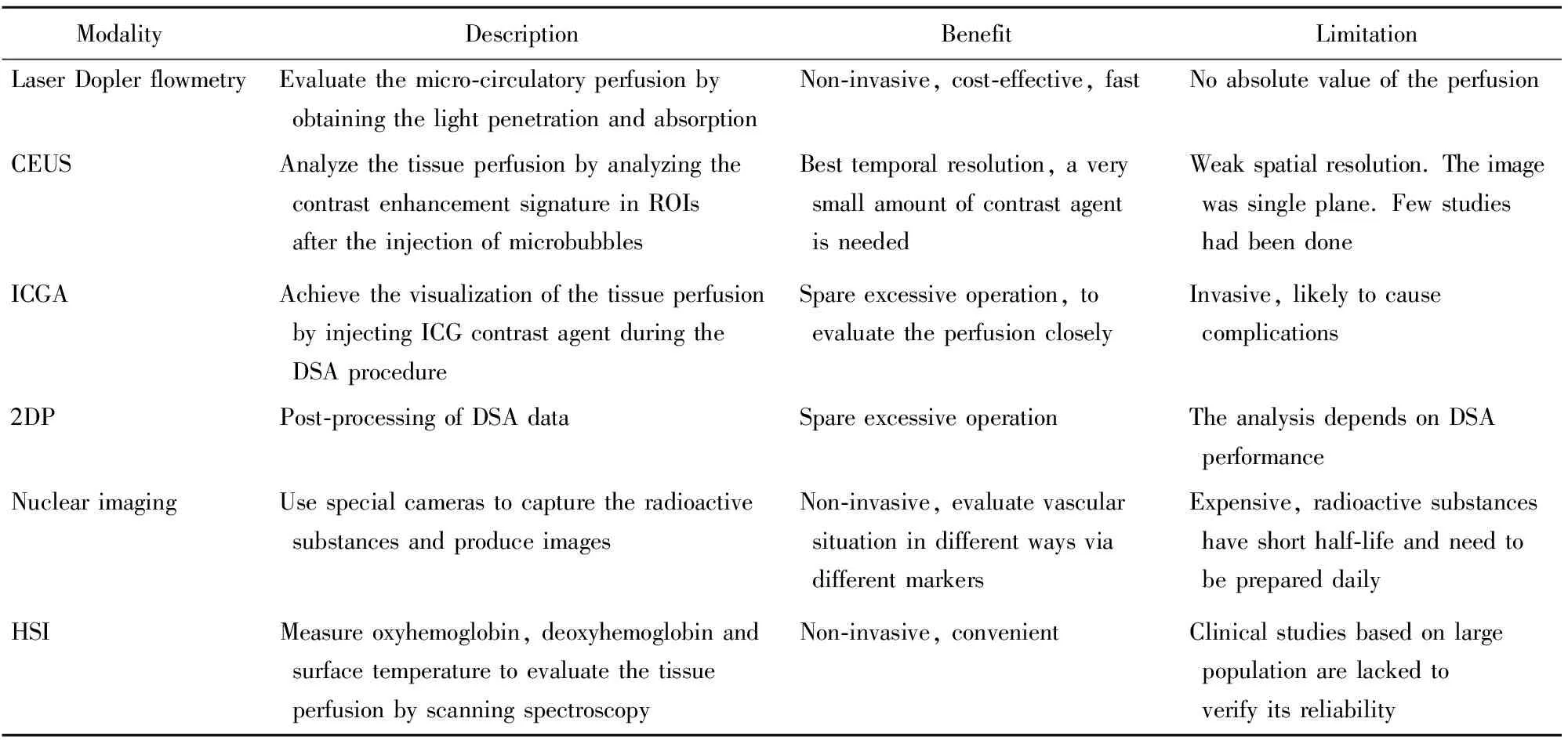
表1 下肢缺血病变不同灌注影像学检查对比
CEUS: contrast enhanced ultrasound; ROIs: regions of interest; ICGA: indocyanine green angiography; ICG: indocyanine green; DSA: digital subtraction angiography; 2DP: 2-dimensional perfusion; HSI: hyperspectral imaging
表1总结了本文所述灌注成像的优势和局限性。双相超声在下肢动脉缺血疾病的筛查和诊断中依然有着重要的地位,但因为超声的空间分辨率较差,使得其对疾病情况了解的全面性较其他影像学方法有所欠缺。随着腔内治疗的发展和普及,DSA相对于CTA和MRA最大的优势在于,其允许在对缺血性病变进行初始诊断的同时用球囊血管成形术或支架置入治疗病灶,从而可以最大限度地减少对比剂的负荷,并且进行最快的血运重建。ICGA以及新的2DP血管成像技术等对DSA在灌注功能方面进行了补充和扩展,而不需要进行多次的穿刺操作。对于适于腔内治疗的患者,初始用CTA或MRA进行评估会造成额外的对比剂负荷。然而,CTA和MRA可以对解剖结构进行全面了解,包括血管外的其他组织,不仅有助于明确非血管病变造成的血管狭窄,亦为介入治疗失败的患者后续旁路移植手术提供更全面的信息。灌注成像近些年亦逐渐应用在下肢缺血的辅助诊断中。其中核素显像具有广泛而多样的未来应用,如使用不同的分子标识以及纳米针进行靶向药物治疗。核素显像与高分辨CT的结合使用,可以同时获得解剖结构和功能的信息,进而更有效地评估病变过程,如使用99mTc-SPECT在干预前后进行下肢扫描,可以帮助评估组织灌注程度并确定干预是否成功[31]。总之,上述成像系统中的很多技术都处于初级阶段,如CEUS、HSI和2DP等,其临床应用将需要基于长期和大量人群的临床研究来验证有效性。随着对下肢缺血认识的不断提高和持续改进,血管手术领域正在朝着实现患者血运重建后降低持续溃疡和并发症发生率的方向发展。新的治疗方法以及影像学评估手段的发展都是其中必不可少的一部分,并且相互依存。

