快速检测金黄色葡萄球菌的一种氮源的酶解优化策略
龙 婧, 李婷婷, 王全林, 田亚平*
(1.江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122;2. 苏州荣氏生物制品有限公司,江苏 苏州 215000)
牛肉浸粉作为氮源存在于多种培养基中培养各种微生物,所以可以根据不同的培养目的,选择不同含有牛肉浸粉加入的培养基,如普通培养基、检测培养基和发酵培养基等[1]。这类氮源有两种形式,其中膏状物溶解性差、称量困难且浪费严重,而牛肉浸粉因溶解性好、方便使用得到较多应用。国内外的牛肉浸粉因原料和生产工艺的不同在质量上差别比较大[2]。牛肉浸粉应用面广泛,对一种国产牛肉浸粉通过酶解法优化改善其多肽和氨基酸的成分及比例,并通过几种典型细菌生长培养的比较,找出其中的一些规律,可为开发快速检测病原菌的培养基配方提供参考。金黄色葡萄球菌(Staphylococcusaureus)是兼性厌氧的革兰阳性菌[3],是医院获得性感染中最常见和食源性疾病的病原体之一。它的毒素和毒力蛋白酶通常在宿主血管中循环而危及生命,病原体通常在开放性伤口和尿道中生长,导致从轻微的皮肤感染到危及生命的疾病如脓肿、肺炎、脑膜炎、心内膜炎和败血病[4-7]。金黄色葡萄球菌可以生活在恶劣的环境中,容易污染冷冻食品、水等物品,由金黄色葡萄球菌引起的食物中毒占的比例较大,成为世界性的公共卫生问题[8]。显然尽可能缩短检测时间,尽早检测和鉴定出金黄色葡萄球菌,理论与实践价值都较高。本研究选择金黄色葡萄球菌为指示菌,利用复合蛋白酶酶解牛肉浸粉,选出最合适的酶组合和酶解条件;通过测定几种细菌的生长曲线,考察酶解产物影响微生物生长的特异性;探讨产物对金黄色葡萄球菌冷冻负伤的复原能力,为牛肉浸粉作为微生物培养基的高价值开发应用提供参考。
1 材料与方法
1.1 材料
1.1.1 原料 牛肉浸粉:荣氏生物制品有限公司提供。
1.1.2 菌株来源 金黄色葡萄球菌(Staphylococ-cusaureus)、大肠埃希菌(Escherichiacoli)、铜绿假单胞菌(Pseudomonasaeruginosa)、枯草芽胞杆菌(Bacillussubtilis),本实验室保藏。
1.1.3 培养基 活化菌株所用固体与液体培养基为相应的LB培养基;普通营养培养基:超纯水 1 000 mL,蛋白胨10 g,牛肉浸粉3 g,NaCl 5 g;实验组培养基:将普通培养基中的牛肉浸粉替换成经酶解处理的;对照组培养基:将普通培养基中的牛肉浸粉替换成原料。
1.1.4 主要试剂 蛋白酶:实验室采用内切蛋白酶与自主专利枯草芽胞杆菌亮氨酸氨肽酶(实验室自制酶)按一定比例复配获得自制复合蛋白酶;蛋白胨(上海生工);NaCl(国药集团化学试剂有限公司);琼脂粉(国药集团化学试剂有限公司);实验用水:超纯水。
1.1.5 主要仪器 立式压力蒸汽灭菌锅,上海花线医用核子仪器有限公司;UV-1600PC紫外-可见分光光度计,上海美普达有限公司;真空冷冻干燥机,宁波新芝生物科技股份有限公司;Delter320 pH计,梅特勒-托利多公司;高速冷冻离心机CF15RN,日本日立公司;数显恒温磁力搅拌器,江苏科析仪器有限公司;恒温摇床,太仓市强乐实验设备有限公司;精确电子天平AL204,梅特勒-托利多仪器(上海)有限公司。
1.2 方法
1.2.1 酶解条件的确定 以配制料液比为8%的溶液,用5.0 mol/L和0.5 mol/L的NaOH调节维持pH的稳定,加入复合蛋白酶(E/S=200 U/g),50 ℃,此方案为基础,其中复合蛋白酶是以金黄色葡萄球菌为指示菌,以试验菌株OD600值的高低[8]选出的最佳配比所复合的酶[9]。分别酶解改变相应的时间、温度、pH、加酶量和料液比。酶解后的产物,离心取上清液,冻干。将LB培养基中培养16~18 h金黄色葡萄球菌,分别稀释到10-4和10-7后,取100 μL加到相应实验组的液体和固体培养基中,37 ℃、220 r/min摇床培养和37 ℃平板培养。以24 h后测摇瓶的菌体浓度OD600值和36 h后统计固体培养基中菌体数量为指标, 此条件下的活菌数与OD600值成正相关[10],说明越有利菌株的生长,平板中微生物数量越多,促进作用越明显[11-12]。考察酶解的不同效果,确定最佳单因素条件,在此基础上进行正交实验获得最优酶解条件[13-14]。
1.2.2 考察最优酶解产物促进生长的特异性 细菌生长曲线的测定[9]:将金黄色葡萄球菌、大肠埃希菌、铜绿假单胞菌和枯草芽胞杆菌4种微生物,在LB培养基上进行活化;在LB培养基中培养16~18 h,按照0.5%的接菌量[14]加入到相应的实验组和对照组的液体培养基中,培养24 h,每隔2 h摇瓶取样一次,测OD600,考察酶解产物促进作用的特异性。
1.2.3 考察最优酶解产物对冷伤菌的复原能力 挑取在0 ℃斜面上保藏的金黄色葡萄球菌到LB液体培养基中培养16~18 h,该时间段的菌处于负伤状态,将原液用无菌水稀释10-4,从中接250 μL到相应的实验组和对照组培养基,测OD600[15]。
2 结果与分析
2.1 酶解条件的确定
2.1.1 酶解时间的单因素实验 按照1.2.1的方法对氮源牛肉浸粉酶解时间进行优化。分别酶解1、2、3、4、5 h,其他条件不变,考察不同时间的产物对金黄色葡萄球菌的影响,结果见图1。

图1 不同酶解时间的产物对金黄色葡萄球菌生长的影响Fig.1 The product of different digestion time effect on the growth of Staphylococcus aureu
由图1可知,金黄色葡萄球菌的OD600值在酶解的前3 h呈现先减后增;酶解3~5 h区间,OD600值先减后增。金黄色葡萄球菌在酶解1 h产物上的菌落总数和酶解3~5 h相应产物上的菌落数接近,变化起伏较小,1 h后的组分对微生物的生长削弱了,产物的促进作用减缓。综合金黄色葡萄球菌的生长状况,以及成本最小化,选择酶解时间为1 h。
2.1.2 酶解温度的单因素实验 按照1.2.1的方法对氮源牛肉浸粉酶解温度进行优化。分别为40、45、50、55 ℃,酶解1 h,其他条件不变。不同温度的产物对金黄色葡萄球菌在相对应培养基上的影响结果如图2所示。
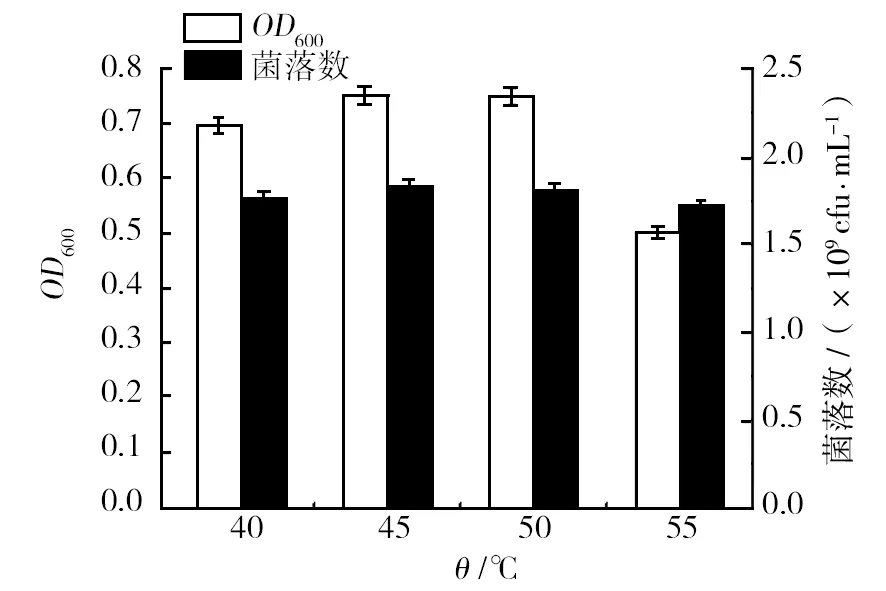
图2 不同酶解温度的产物对金黄色葡萄球菌生长的影响Fig.2 The product of different enzyme solution temperature effect on the growth of Staphylococcus aureus
由图2可知,随着温度的变化,OD600值和菌落总数先增后减,当温度为45 ℃时,两者达到最大值。该温度下的牛肉浸粉利于金黄色葡萄球菌的生长。当温度达到55 ℃时,OD600值和菌落数都最低,随着温度的升高,复合酶中的氨肽酶和中性蛋白酶失活加快,导致酶解受阻,影响菌体生长。综合考虑,选择 45 ℃作为酶解温度。
2.1.3 酶添加量的单因素实验 配制料液比为8%的溶液,pH为8.5,分别加入复合蛋白酶E/S为100、150、200、250、300 U/g,50 ℃酶解1 h,经不同添加量的复合酶水解后的产物对金黄色葡萄球菌在液体及固体培养基中的生长影响,结果如图3所示。
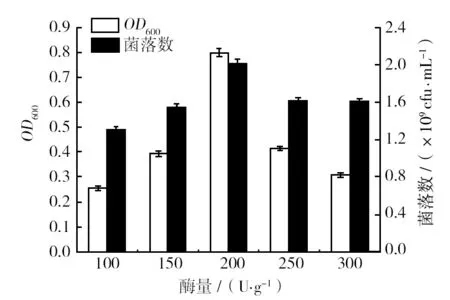
图3 不同酶量酶解的产物对金黄色葡萄球菌生长的影响Fig.3 The product of different amount of enzyme digestion effect on the growth of Staphylococcus aureus
由图3可知,随着酶量的增加,摇瓶中培养的金黄色葡萄球菌OD600值和平板菌落数,先增后减。当加酶量为E/S=200 U/g时,达到最大值。说明此加酶量下酶解所获产物对其生长最有利。酶量过多或过少的产物都不适合金黄色葡萄球菌的生长。综合考虑,选择E/S=200 U/g作为最适加酶量。
2.1.4 pH的单因素实验 配制料液比为8%的溶液,pH分别为7.0、7.5、8.0、8.5、9.0,加入复合蛋白酶E/S=200 U/g。50 ℃酶解1 h,不同pH的酶解产物对金黄色葡萄球菌在相对应液体培养基上的OD600值,以及固体培养基上菌落数量的影响如图4所示。
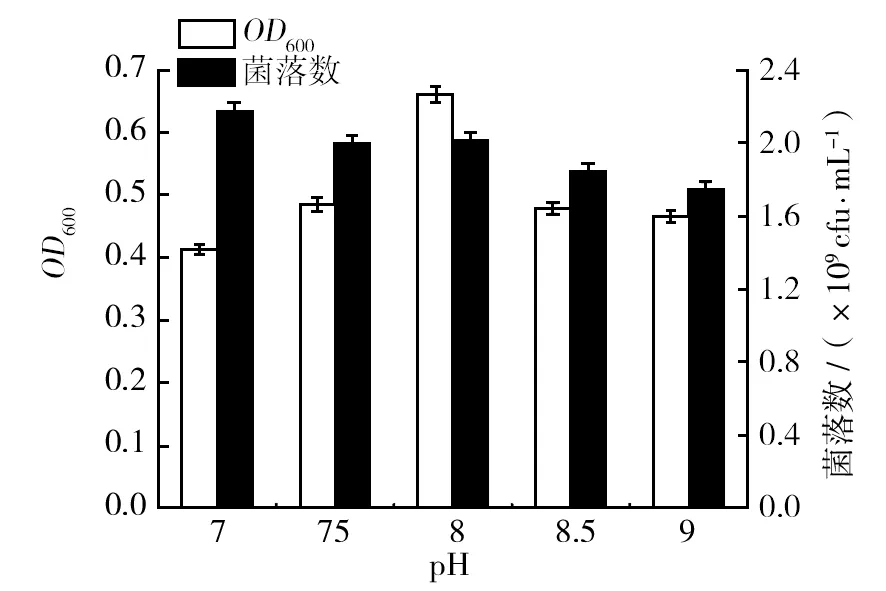
图4 不同pH的酶解产物对金黄色葡萄球菌生长的影响Fig.4 Enzyme solution of different pH′ s influence on the growth of staphylococcus aureus
由图4可知,随着pH值的增加,摇瓶中培养的金黄色葡萄球菌的OD600值先增后减,当pH达到8.0时,OD600值达到最高值。在相对应的平板上,菌落数呈现下降的趋势,当pH为7.0时,菌落数达到最大值。pH的过低或者过高都使得酶呈现不可逆的失活,酶解底物效果差,所得产物对微生物的生长作用相对没有优势。综合两种指标的考察,选择8.0作为酶解的pH。
2.1.5 不同底物浓度的单因素实验 配制料液比为6%、8%、10%、12%、14%的溶液, pH为8.5,加入复合蛋白酶E/S=200 U/g。50 ℃酶解1 h,不同底物的酶解产物对金黄色葡萄球菌在相对应培养基上生长的影响,如图5所示。
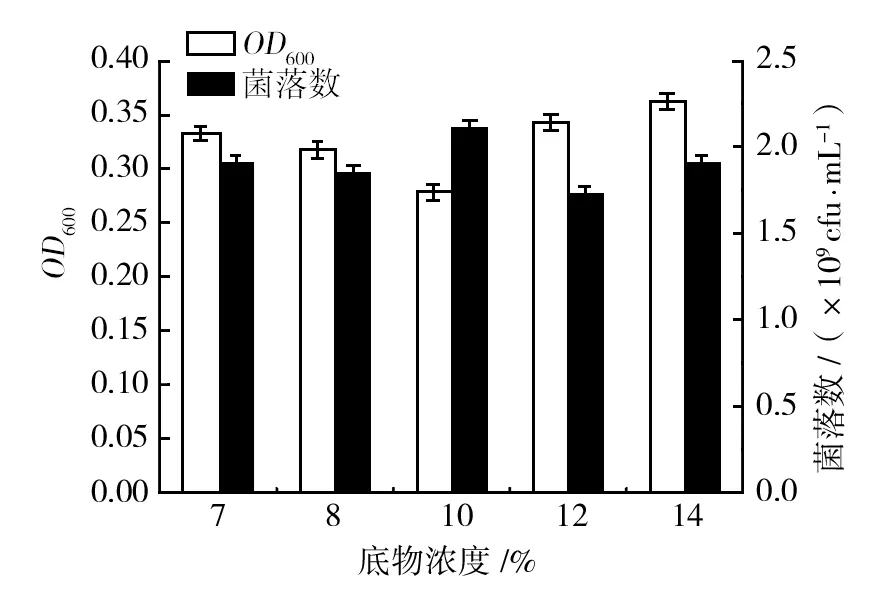
图5 不同底物浓度的酶解产物对金黄色葡萄球菌生长的影响Fig.5 The product of different substrate concentration of enzymolysis effect on the growth of Staphylococcus aureus
由图5可知,随着物料浓度的增加,摇瓶中培养的金黄色葡萄球菌的OD600值呈现先减后增的趋势,当物料比达到14%时,OD600值达到最大。当物料比为10% 时,OD600值最低,但其在相应的平板上菌落数为最大值,说明在此种产物下,摇瓶培养和平板培养两种形式下,摇瓶培养更有利于金黄色葡萄球菌的生长。综合考虑,选择物料浓度为10%作为酶解底物浓度。
2.1.6 可控酶解的正交实验分析 为了进一步优化酶解工艺,通过单因素实验,选择温度(A/℃)、加酶量(B/(U·g-1))、pH(C)、底物浓度(D/%)4个因素,进行4因素3水平正交实验,经过正交实验得出的极差,以及生产上的利益最大化和获得产品的实际情况,确定一个合理、经济的组合[16-17]。因素水平表见表1。
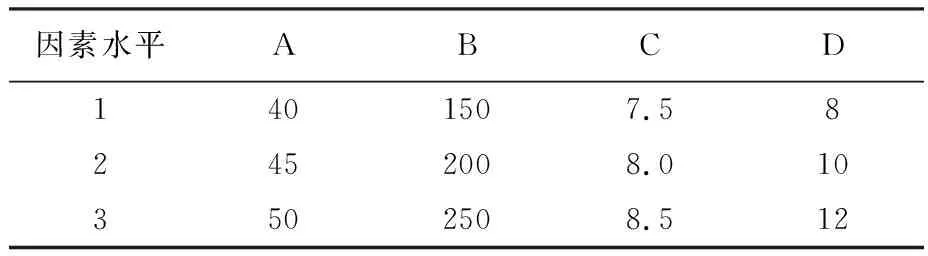
表1 因素水平表
以金黄色葡萄球菌的OD600值和平板数为指标,进行L9(34)正交试验,结果分析见表2。
根据表2可确定各因素对金黄色葡萄球菌生长指标影响的主次顺序和各指标的最优水平组合。OD600值:A>C>D>B,A3B2C1D1;菌落数:A>D>C>B,A1B2C3D3。综合考虑,对于A因素,因为50 ℃有利于酶发挥最佳活性,所以选择50 ℃作为酶解温度;对于C因素,因为盐溶度越低越有利于冻干,综合OD600值和菌落数,选择pH 7.5作为酶解条件;对于D因素,综合两项指标以及经济效益,选择底物浓度12%作为最佳酶解条件。最终确定酶解条件为底物浓度12%、50 ℃、pH 7.5、时间1 h、加酶量200 U/g。在最优条件酶解下的产物对金黄色葡萄球菌的生长有明显促进作用。
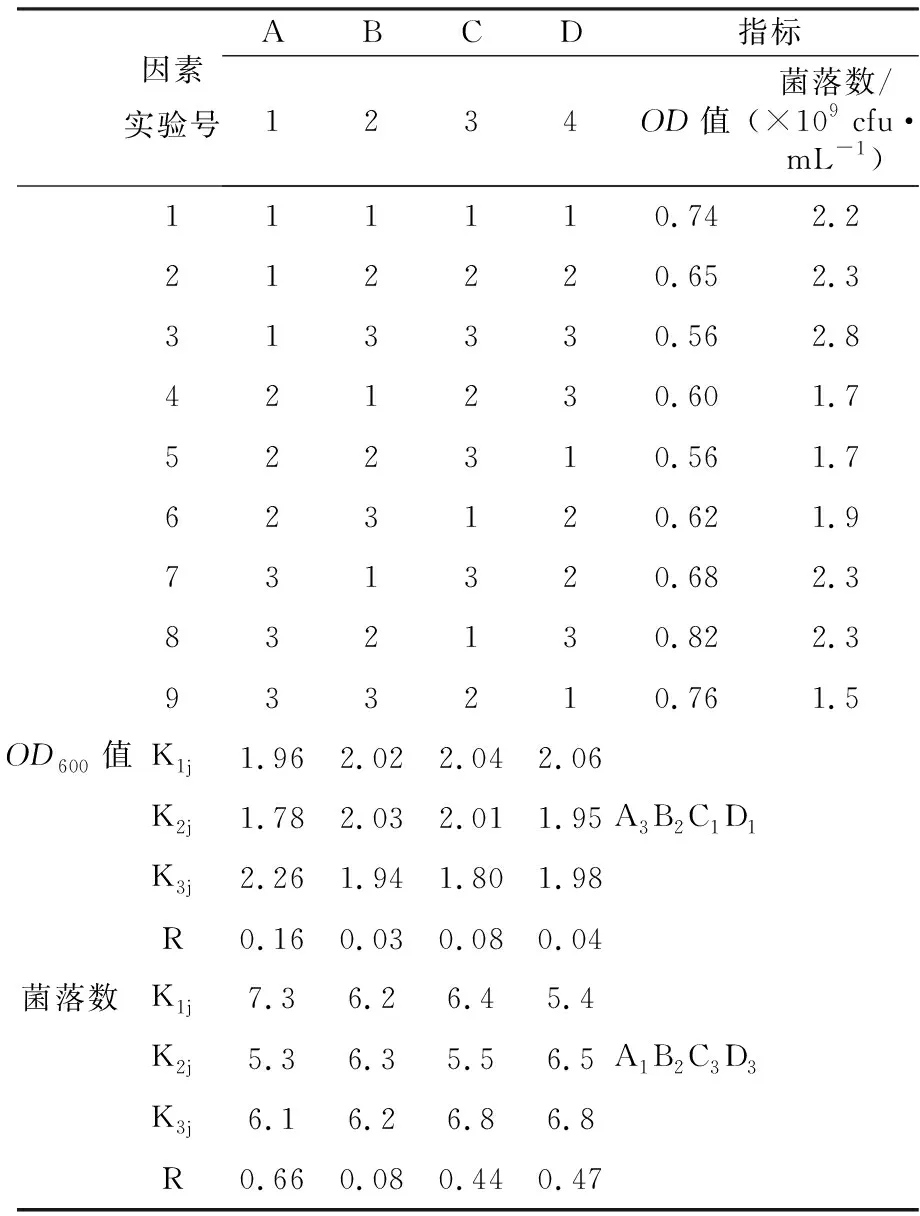
表2 酶解反应正交分析结果
注:K1j、K2j和K3j分别表示“1”、“2”和“3”水平在j列所对应的试验指标数值之和(例如第一列中的K11为所有1所对应的指标数值之和),R为j列中平均得率最大的K值与平均得率最小的K值的差值(R=Kmax/3-Kmin/3)
对最优酶解条件下的牛肉浸粉多肽分布和氨基酸含量的结果如图6和图7所示。
由图6可知,经过酶解后的牛肉浸粉中多肽分子量小于500 Da的占总量的75.48%,比酶解前增加10.7%,其中小于170 Da的不低于31.79%,说明酶解后产物的多肽分子量主要以小分子居多并且有大量的氨基酸。进一步分析氨基酸,发现主要提升的氨基酸种类如图7所示,支链氨基酸缬氨酸(Val)、异亮氨酸(Ile)和亮氨酸(Leu)的含量,分别是酶解前的3.4倍、2.5倍和1.49倍。支链氨基酸是细菌生理活动的重要营养物质,不仅对蛋白合成有关,在大多数革兰阳性细菌中,支链氨基酸是合成支链脂肪酸的前体,还是主要的膜脂肪酸[19]。由此得出,可能小分子肽增多和支链氨基酸的增加有利于金黄色葡萄球菌的生长。

图6 酶解前后的多肽分布Fig.6 Peptide distribution before and after enzymatic hydrolysis
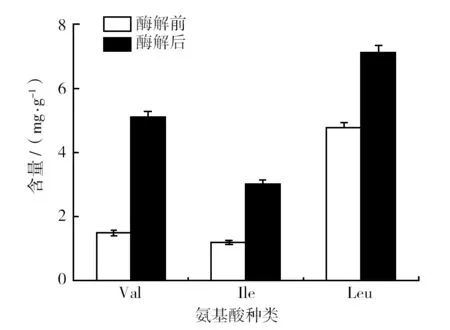
图7 酶解前后氨基酸变化Fig.7 Amino acid changes before and after enzymatic hydrolysis
2.2 酶解牛肉浸粉产物培养细菌特异性分析
分别用酶解的牛肉浸粉和没有处理的牛肉浸粉培养几种不同的细菌,观察酶解产物对各菌株生长曲线的影响,结果如图8所示。
由图8可知,对不同的实验菌株,实验组与对照组的生长周期大致相同。其中只有a图金黄色葡萄球菌的生长曲线,在对数期的OD600值明显区别对照组中的,其他三种微生物的对数期,实验组和对照组基本没有差别,d图可以得到,原料与产物对铜绿假单胞菌作用完全一致。综合上述,说明通过正交确认的最合适酶解条件下的产物,只对金黄色葡萄球菌有促进增菌的作用,是具有特异性的。可以用此产物应用于富集含有金黄色葡萄球菌的混合菌群的成分之一。
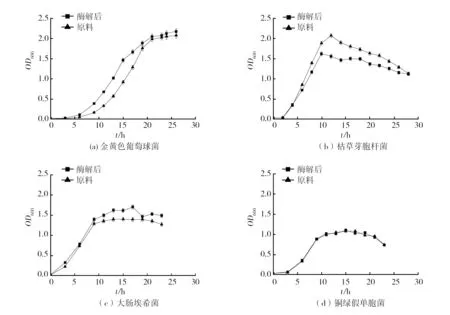
图8 细菌生长曲线Fig.8 Growth curve of bacteria
2.3 牛肉浸粉对冷伤菌的复原能力
经过用酶解后的牛肉浸粉配成培养基培养冷冻负伤的金黄色葡萄球菌,对此菌株的复原能力如表3所示。
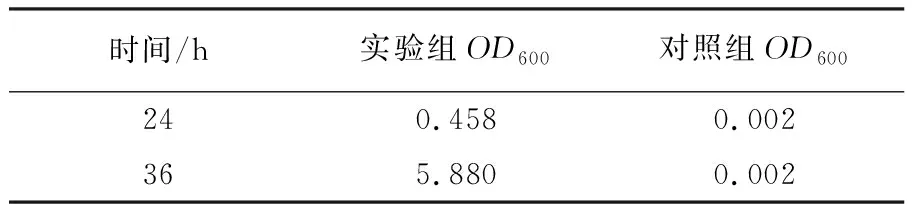
表3 金黄色葡萄球菌的复原能力
由表3可知,在培养24和36 h后,实验组中的OD600值远高于对照组,并且对照组的菌株几乎还在延迟期,说明酶解后的牛肉浸粉有利于此菌缩短延迟期,快速进入对数期,有利于冷冻后的菌株复原,加快增殖。
3 讨 论
目前关于病原微生物检测虽然有快于常规检测的方法,但医院传统常规培养的方法因其真实性高而依然应用广泛。当然传统的检测方法也在不断地改良中,最重要的改良目标就在于缩短所需的检测时间,其中富集培养基和显色培养基是重要环节。牛肉浸粉作为它们的组成之一,在培养基中往往起到举足轻重的作用。研究发现,复合蛋白酶对牛肉浸粉酶解优化后的产物对金黄色葡萄球菌有明显相对特异的促生长,这种规律和特点有利于对不同病原微生物进行快速的检测和区别。培养冷藏的菌株,发现该产物对菌株有冷冻复原的能力,可以尽早使金黄色葡萄球菌恢复它的生命力及各项机能,也利于鉴定其属性。这些作用将不仅利于传统检测还可以提高PCR检测方法的效率[18]。从多肽和氨基酸两方面进行分析,推测多肽小分子偏多,以及经过氨肽酶酶解后,亮氨酸、异亮氨酸和缬氨酸的含量增加,都更有利于金黄色葡萄球菌吸收代谢,进而对金黄色葡萄球菌的生长起到一定促进作用[19-20]。
此蛋白酶酶解调整技术应用于牛肉浸粉的制备中,可以不断改进牛肉浸粉的品质,使其更加有利于微生物的生长。还可以结合对整体培养基其他成分的作用做进一步探讨,了解微观控制微生物培养基成分的方法,便可以更精细地调整病原微生物培养基配方,或发现更特异的培养基配方,使传统的微生物检测方法也能得到不断的改良和提升。