sRNA GLmZ对大肠埃希菌M15代谢乙酸和柠檬酸的影响
王鑫鑫, 张 燕, 朱敬丽, 路赵硕, 姚 健, 王德才, 陈小贝
(哈尔滨医科大学 公共卫生学院 营养与食品卫生教研室,黑龙江 哈尔滨 150081)
乙酸在医药、农业、合成纤维和印染等方面有广泛的应用,国内外市场的需求量不断增长[1]。我国是目前世界上最大的乙酸生产国,主要采用甲醇羰基合成技术,但是在原材料、催化剂性能及成本控制等方面与国外企业相比都存在很大的差距。目前国内外发现了制备乙酸新途径,有二氧化碳转化法和生物法[2]。柠檬酸是世界第二大发酵产品,产量仅次于酒精的产量[3],广泛应用于食品、医药、化学工业等方面。柠檬酸的生产方法有深层液体发酵法和固体发酵法,近年来我国采用黑曲霉柠檬酸高产菌株进行深层液体发酵方法,成为国际领先的生产技术,我国的柠檬酸产量和贸易均居世界第一位[4-5],但在微生物发酵方法中仍有一定的发展潜力。小RNA(Small RNA,sRNA)是一种存在于细菌中的、长度为50~300个核苷酸左右的调节性RNA。在大肠埃希菌中首次发现了sRNA 6SRNA[6],至今为止在大肠埃希菌中已经发现了80~100个sRNA,除广泛分布于大肠埃希菌中外,还分布于金黄色葡萄球菌、肺炎克雷伯菌、铜绿假单胞菌等细菌中[7]。研究发现sRNA参与调控很多生物过程,它们既可以通过与其靶mRNA进行不完全碱基互补配对来发挥调节作用[8-10],也可以与通过模仿其他氨基酸的二级结构来调节相应蛋白活性[11-12]。近年来发现,由sRNA组成的转录后调控网络,在转录后水平发挥调节作用的RNA,对细菌存活、代谢、致病性和耐药性具有调节作用。GLmZ是一种常见的sRNA,研究发现,yhbJ基因可以负反馈调节GLmZ的表达,即yhbJ基因缺陷使GLmZ浓度增加。GLmZ激活glmS mRNA的表达来降低葡萄糖胺-6-磷酸酶(glucosamine-6-phosphate synthase,GLmS)的表达,从而调控葡萄糖胺-6-磷酸(glucosamine-6-phosphate,GlcN-6-P)的浓度[14-15]。GlcN-6-P浓度的变化还可以反馈调节GLmZ的表达[14],从而使细胞体内GlcN-6-P浓度保持在较为稳定的水平。有研究显示,GLmZ还可以调节细胞壁的形成,通过调节glmS mRNA促使细胞合成氨基糖,氨基糖是细胞合成细胞壁的重要启动子[15]。 但是GLmZ作为近年来一种新发现的sRNA,目前对GLmZ作用机制的研究和应用较少,仍有较大的发展潜力。在生物体内,乙酸可以生成乙酰CoA,乙酰CoA和草酰乙酸缩合不可逆地生成柠檬酸,此反应是三羧酸循环的第一个生化反应[16]。由于sRNA可能对细胞代谢产生影响,由此推测GLmZ在大肠埃希菌中的表达可能会对其代谢过程和代谢产物产生一定的影响,因此,本文研究sRNA GLmZ对细菌代谢乙酸和柠檬酸的影响,为工业生产乙酸和柠檬酸提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 大肠埃希菌(E.coli)M15菌株、转染空质粒的E.coliM15菌株、转染sRNA GLmZ质粒的E.coliM15菌株,均由哈尔滨医科大学基础学院微生物教研室提供。
1.1.2 培养基 三种细菌均用LB培养基,其中E.coliM15的培养基内添加50 μg/mL Kan,转染空质粒的E.coliM15和转染GLmZ质粒的E.coliM15的培养基内添加50 μg/mL Kanamycin(卡那霉素)和100 μg/mL Ampicillin(氨苄青霉素)。
1.1.3 试剂及仪器 高效液相色谱Agilent Technologies 1260 Infinity(美国Agilent公司),COSMOSIL C18-AR-Ⅱ色谱柱(4.6 mm×250 mm,美国Agilent公司)。实验用水为经过milli-Q纯水仪的超纯水,乙酸和柠檬酸两种标准品为国家药品标准物质。
1.2 方法
1.2.1 菌株培养条件及其处理 接种30 μL菌液于3 mL LB培养基中,水浴振荡器内37 ℃、200 r/min条件下培养。各细菌分别培养至2、4、6、8、10、12、14、16、18 h取出,设置接种细菌的LB培养基为实验组,LB培养基为空白对照组。
1.2.2 样品前处理 在菌液中加入5 mL 80%的乙醇,匀浆1 min,3 000 r/min、10 min、4 ℃离心收集上清液,转入培养皿,残渣再分别用3、2 mL 80%的乙醇洗涤2次,离心条件同上,合并上清液。70 ℃恒温水浴蒸去乙醇,残留物用超纯水定容至2 mL,充分摇匀,取部分样液经0.45 μm滤膜过滤待用。
1.2.3 标准溶液的配制 将各有机酸标准品稀释,配制有机酸标准品混合溶液:乙酸0.2%和柠檬酸1.32 mg/mL。
1.2.4 流动相及流速的优化 以C18色谱柱为分析柱,采用5种不同的流动相对2种标准有机酸混合溶液进样进行试验验证:A为3%CH3OH-0.05 mol/L Na2HPO4、B为0.01 mol/L H2SO4、C为3%CH3OH-0.05 mol/L KH2PO4、D为0.01 mol/L K2HPO4、E为0.01 mol/L (NH)4HPO4。
1.2.5 柱温及波长 有机酸溶液在流动相的解离过程中随温度的升高而增加,使有机酸的分离效果变差,分别选用柱温20、30和40 ℃进行试验。
1.2.6 数据处理 用上述方法对三种细菌菌液中的有机酸含量进行测定分析,分别进行6次平行试验。应用SPSS17.0统计软件,采用重复测量方差分析方法,对交互效应显著的数据进行简单效应检验[17],再应用OriginProPorable 8.5软件进行绘图。
2 结果与分析
2.1 高效液相色谱条件
结果表明流动相A导致目标有机酸出现杂峰,分离效果较差;流动相B和流动相D未出峰;C为流动相时,标准有机酸出峰时间提前且集中;流动相为E时有机酸,峰形对称,窄且尖锐,无毛刺无拖尾,基线无漂移,故选择用E为流动相。用1 mol/L磷酸分别调节流动相pH为2.5、2.7和3.0,当pH值为2. 7时出峰效果较好。分别设置流速为0.5、0.8、1.0、1.2 mL/min,发现流速为0.5和0.8 mL/min时,峰形较宽;流速为1.2 mL/min时,出现拖尾现象;流速为1.0 mL/min时峰形尖锐,无拖尾现象,且响应值较高,故选用1.0 mL/min的流速。柱温试验发现30 ℃作为分离柱温时,分离效果较好,响应值较高,故选用30 ℃为柱温。经试验,选用紫外检测器波长为215 nm。
2.2 有机酸标准图谱和样品中有机酸色谱图
应用已确定的高效液相色谱条件对乙酸、柠檬酸标准有机酸混合溶液和实验样品中有机酸进样,色谱图见图1。
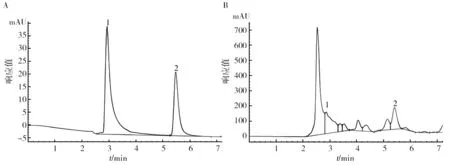
图1 有机酸标准品和样品的色谱图Fig.1 Standard organic acid products and sample chromatogramA:HPLC测定标准品乙酸和柠檬酸色谱图;B:E.coli M15实验组样品色谱图;1:乙酸;2:柠檬酸A:HPLC determination of standard acetic acid and citric acid chromatogram; B:E.coli M15 experimental group chromatogram;1:acetic acid;2:citric acid
2.3 有机酸标准曲线的绘制
将不同浓度的两种有机酸标准溶液由低浓度向高浓度进样,以峰面积作纵坐标,相应有机酸质量浓度(mg/mL)为横坐标制作标准曲线,通过Excel计算回归方程及相关系数(见表1),相关系数分别为0.999 5和0.996 6,说明标准曲线的拟合程度较好。

表1 两种有机酸的线性回归方程、相关系数、检出限和线性范围
2.4 有机酸测量精确度实验
随机选择某一生长时间的细菌作为对象,在相同条件下,一天内重复进样6次并连续进样6 d,结果见表2。各有机酸的日内重复性均小于2.97%,日间重复性均小于3.26%,说明仪器的性能较好,测量数据可靠。

表2 有机酸的日内重复性和日间重复性
2.5 有机酸测量准确度实验
根据有机酸的回收率可以考查有机酸测定方法的准确度,测定结果见表3,乙酸和柠檬酸的平均回收率分别为88.5%、95.9%,说明有机酸测量方法的回收率高、准确度好。
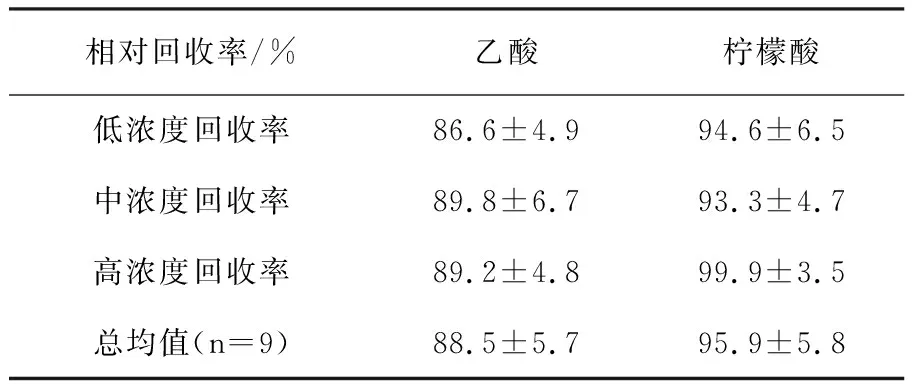
表3 有机酸的回收率
2.6 细菌生长曲线
将3种细菌各生长时间段的菌液摇匀,用麦氏比浊管进行对比测定细菌含量,各时间段细菌进行6次平行试验,计算均值绘制细菌生长曲线,见图2。由图2看出,3种细菌在生长迟缓期的差异较小,E.coliM15和E.coliM15 GLmZ在生长对数期差异较明显,而E.coliM15空质粒的对数期与迟缓期的区分度较小;在生长对数期中,E.coliM15 GLmZ实验组细菌比E.coliM15实验组细菌生长减缓,在培养至12 h和14 h有显著差异(P<0.05)。总体上,E.coliM15最先进入生长对数期和稳定期,生长速度最快,E.coliM15空质粒生长速度次之,E.coliM15 GLmZ生长速度最慢。
2.7 LB培养基空白对照组中有机酸含量
LB培养基空白对照组中乙酸含量(分别设置为LB培养基-1、LB培养基-2、LB培养基-3)随时间的延长变化幅度较小。重复测量方差分析结果表明,LB培养基与培养时间的交互作用(F=0.230,P>0.05)对乙酸含量的影响不显著;时间因素(F=0.789,P>0.05)和不同LB培养基因素(F=0.484,P>0.05)的主效应均不显著,即不同时间段的乙酸含量的变化无统计学差异,故后续试验中将空白对照组中各时间段乙酸含量视为定值,即均值0.886 6 mg/mL。柠檬酸含量经统计分析无交互效应(F=1.839,P>0.05)和主效应(F=1.149,P>0.05),定值为4.808 6 mg/mL,具体统计结果不在此赘述。

图2 三种大肠埃希菌的生长曲线Fig.2 The growth curves of three kinds of Escherichia coli*P<0. 05 E.coli M15与E.coli M15 GLmZ相比*P<0.05 compare E.coli M15 to E.coli M15 GLmZ
2.8 三种细菌各培养时间中有机酸代谢含量的测定与比较
由于LB培养基中含有一定量的上述两种有机酸,考查菌株各生长时期代谢的有机酸量时,需扣除培养基中有机酸底值。当代谢量为负时,表明菌株生长代谢过程中消耗的有机酸量大于其代谢的有机酸量;为正值时,说明菌株在生长代谢过程中代谢产生的有机酸量大于其消耗的有机酸量。
有机酸含量=实验组有机酸-空白对照组有机酸=细菌代谢的有机酸-细菌吸收的有机酸。
2.8.1 三种细菌在不同培养时间中乙酸含量的比较 重复测量方差分析结果见表4,表明时间因素和三种细菌之间的交互作用(F=36.406,P<0.05)对细菌产生乙酸的影响显著。三种细菌效应中,E.coliM15和E.coliM15 空质粒随培养时间的延长,产生乙酸量均有显著性差异(P<0.01)。由其趋势图图3看出,E.coliM15的乙酸代谢量先逐渐增加后降低,最后趋于平衡;E.coli空质粒代谢的乙酸量随培养时间的延长呈现不断增长的趋势;E.coliM15 GLmZ的乙酸代谢量在各培养时间均为负值,说明消耗的富马酸较多。经简单效应检验,E.coliM15和E.coliM15空质粒在各时间段代谢产生的乙酸均有显著差异(P<0.05)。

表4 不同培养时间和不同菌种对细菌代谢乙酸的影响
注:*表示主效应的F统计量和P值;a表示在相同生长时间点上与E.coliM15比较P<0.05;# 表示交互效应的F统计量和P值;“-”表示未检测到该有机酸
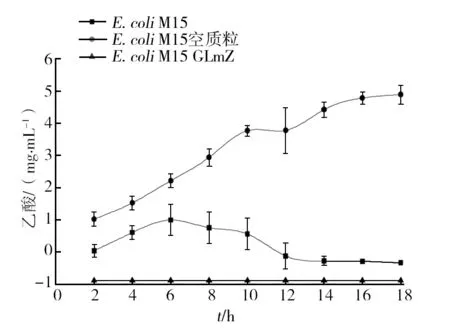
图3 三种大肠埃希菌代谢的乙酸量变化趋势Fig.3 Acetic acid content of 3 kinds of E. coli
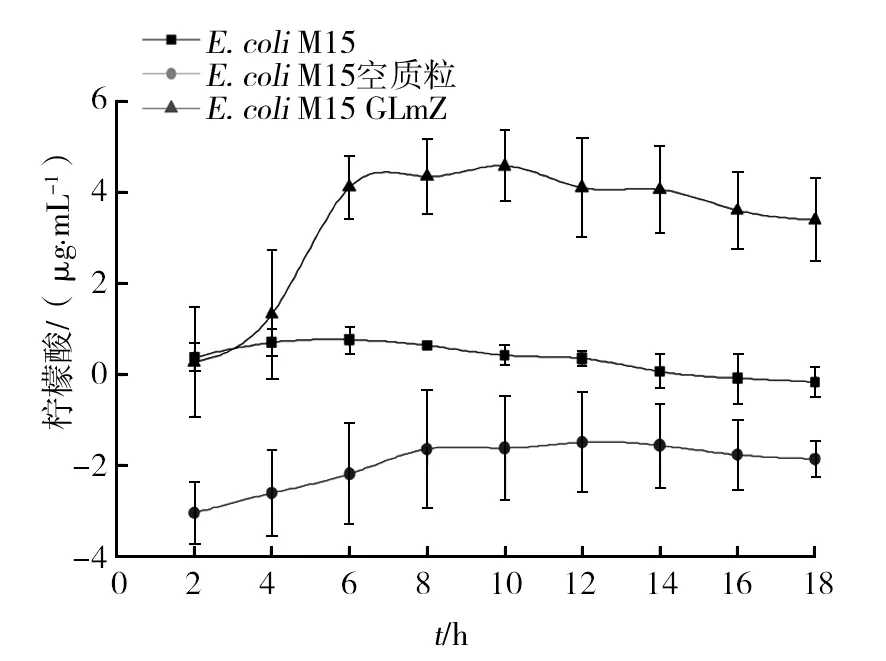
图4 三种大肠埃希菌代谢的柠檬酸量Fig.4 Citric acid content of 3 kinds of E. coli
2.8.2 三种细菌在不同培养时间中产生柠檬酸含量的比较 重复测量方差分析结果见表5,时间因素和不同菌种之间的交互效应(F=9.928,P<0.01)显著;三种细菌的时间效应显著(F=13. 6,P<0.01),其中E.coliM15(F=0.607,P>0.05)代谢的柠檬酸量随培养时间的延长无显著差异。E.coliM15空质粒代谢的柠檬酸量稳定在(-1.969 4 ± 0.201 9) mg/mL范围内。图4结果表明,E.coliM15 GLmZ代谢的柠檬酸含量随细菌培养时间的延长呈先增加后逐渐稳定的趋势,均为正值,说明其代谢产生的柠檬酸较多。经简单效应检验,在各时间点上,E.coliM15和E.coliM15 GLmZ代谢的柠檬酸量均存在显著差异(P<0.05)。
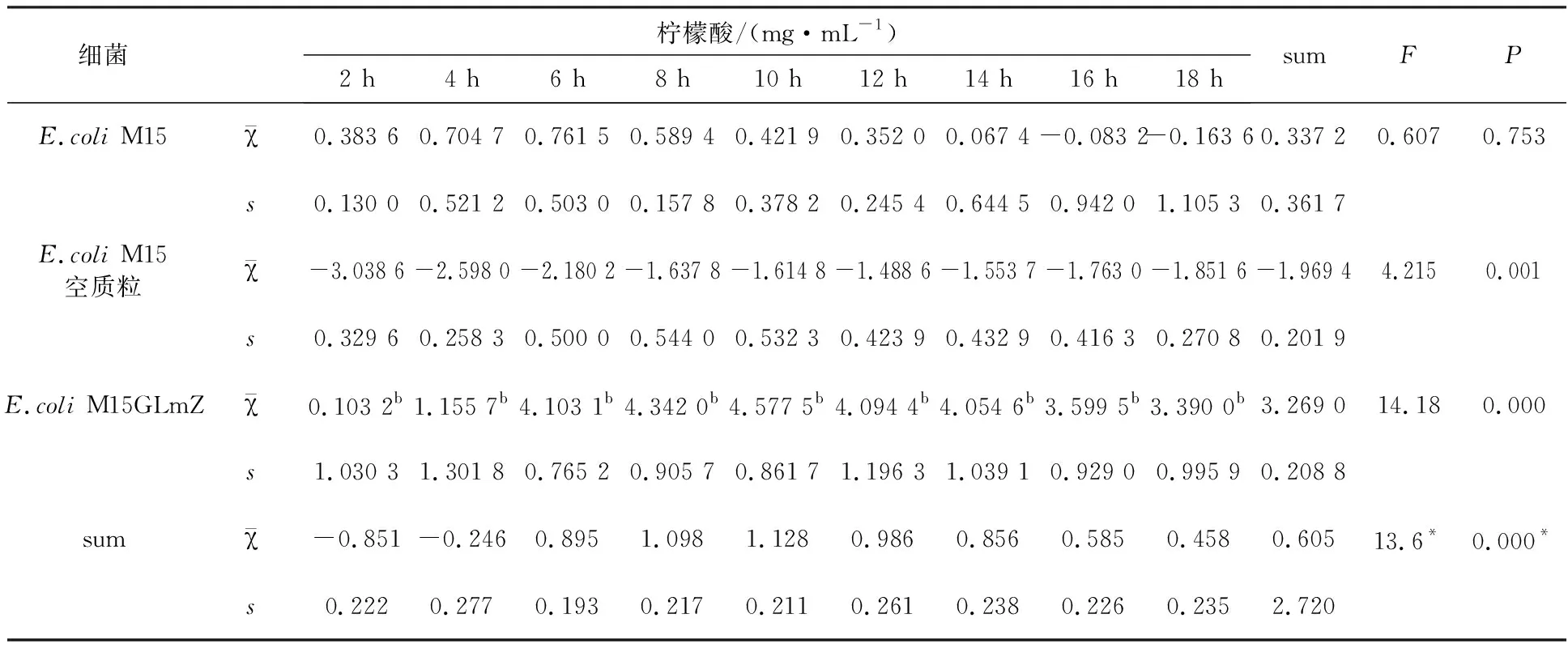
表5 不同培养时间和不同菌种对细菌代谢柠檬酸的影响
注:*表示主效应的F统计量和P值;交互效应的F统计量为8.014和P值为0.000;b:在相同培养时间点上,与E.coliM15空质粒比较,P<0.05
3 讨 论
本研究发现,质粒对大肠埃希菌的生长有较大的影响,质粒越大,细菌的生长速度越慢,因为质粒作为一种环状DNA分子,可以参与细菌的代谢,需要消耗一定量的有机酸,这就与细菌生长所需有机酸形成竞争关系,从而降低细菌的生长速度,这与刘义等[18]的研究结果一致。另外,本研究中转染空质粒的E.coliM15实验组和E.coliM15 GLmZ实验组细菌生长减缓,但是两者间细菌数量没有明显差别,说明这些细菌之间代谢产生乙酸、柠檬酸的含量差异是由于细菌代谢能力变化所致,可以排除不同实验组细菌数量差异的误差干扰,结果可信。
研究发现空质粒可以促进乙酸的合成。转染sRNA GLmZ质粒的E.coliM15代谢产生的乙酸量降低且随培养时间的延长无显著变化,这可能是sRNA GLmZ质粒可以抑制乙酸的合成或者促进乙酸的代谢。我国是目前世界上最大的乙酸生产国,但是在原材料方面与国外还有很大的差距,多采用煤制甲醇工艺,成本较高,不具有竞争优势,因此技术创新显得尤为重要。E.coliM15空质粒具有遗传背景清楚、营养简单和易培养的特点,利用发酵工程技术以E.coliM15空质粒为菌株生产乙酸为工业生产乙酸提供了参考。
转染sRNA GLmZ质粒的E.coliM15在稳定期后期和衰亡期代谢产生的柠檬酸量略有下降,此时对柠檬酸的合成减少,且作为菌株利用效能较高的碳源被重新摄入菌体内利用所致[19]。转染sRNA GLmZ质粒的E.coliM15代谢的柠檬酸量显著高于E.coliM15菌株代谢的柠檬酸量,这为改进工业生产柠檬酸提供了新思路。目前,我国是柠檬酸产量最大的国家,利用黑曲霉作为生产菌株已经达到了较高的水平[20],但是将sRNA GLmZ质粒转染到黑曲霉菌株中为提高柠檬酸的产量提供思路。