高危型HPV检测在宫颈细胞学异常人群中的应用分析
邓潇,谢彤
(江西省妇幼保健院体检中心,南昌 330006)
宫颈癌是我国妇女第5种最常见的恶性肿瘤,其发病率稳居我国女性生殖道恶性肿瘤的第1位[1]。德国科学家Hausen博士因发现人乳头瘤病毒(HPV)感染是导致宫颈癌发生的主要原因而获得了2008年度诺贝尔生物学或医学奖[2]。目前已经明确高危型HPV持续感染是引起宫颈癌的必要因素[3]。子宫颈癌筛查的目的是发现宫颈癌的高危人群和早期子宫颈癌,以达到降低子宫颈癌的发病率和病死率的目的。为探讨高危型HPV-DNA检测在宫颈细胞学异常女性中的应用价值,本文选取103位宫颈细胞检查轻度异常 (细胞学结果提示为ASCUS或LSIL)的女性,采取高危型HPVDNA检测进行分流,并行电子阴道镜检查,以组织病理报告作为金标准,对所有结果进行分析。
1 资料与方法
1.1 一般资料 选取2016年1月至2017年1月在江西省妇幼保健院妇科门诊及体检中心行宫颈液基细胞学检查结果异常(ASCUS或LSIL)的103位女性,年龄16-68岁,采用高危型HPV-DNA检测进一步分流,并行电子阴道镜检查,以组织病理报告作为金标准,以期达到浓缩高危人群的目的。(这些女性均为初次接受宫颈癌筛查,非妊娠期,无宫颈癌前病变病史,无宫颈手术史。)
1.2 方法
1.2.1 HPV-DNA检测 充分暴露宫颈阴道部,用棉球轻轻蘸去过多的黏液;用HPV取样器尖端置入子宫颈口,顺时针方向旋转至少6-8周,以保证收集足够量的宫颈管内脱落细胞;取样后将取样器立即放入HPV保存瓶中。采用第二代杂交捕获实验 (HC2)对宫颈脱落细胞行HPV-DNA半定量检测。该方法可一次性检测出13种已确认的致癌基因型高危HPV-DNA。判读及评估标准:以每份样本的检测值相对发光单位 (relative luminous unit,RLU)与专用试剂盒中HPV DNA阳性对照临界值(cut off,CO)的比值(RLU/CO)表示子宫颈组织细胞HPV DNA的载量,如RLU/CO≥1.0,则表示每毫升标本中HPV DNA的含量≥1.0pg,结果为阳性;反之,结果为阴性。
1.2.2 液基细胞学检查 有月经者,月经干净至少3d,并且3d内无性生活及阴道用药者,行宫颈脱落细胞检查。采用美国CYTYC公司生产的新柏式液基细胞学检测系统,由专科细胞病理医生镜检,报告采用2001年修订的TBS报告系统,本文主要涉及ASCUS(意义不明确的不典型鳞状细胞)和LSIL(鳞状上皮内低度病变)两类。
1.2.3 电子阴道镜检查 电子阴道镜采用深圳金科威公司的SLC-2000阴道镜数字成像系统,对图片与资料实行管理。患者于月经干净后3-7d检查,由经过专门培训的阴道镜医师操作。患者取膀胱截石位,放置窥阴器,拭去官颈表面黏液,调整好焦距,依次暴露检查部位,涂生理盐水,观察鳞-柱交界及血管,再于官颈表面涂3%醋酸溶液,60s后观察。出现白色上皮、镶嵌、点状血管与各种异型血管等为异常区域。再进行碘试验,观察局部上皮着色情况,在可疑病变区多点取材或颈管刮术,进行病理检杳。
1.2.4 组织病理学检查 所有病理标本由两名专门的病理医师进行阅片,作出最后的病理诊断。宫颈组织病理学诊断分为:正常或炎症;宫颈上皮内瘤变(cervical intraepithelial neoplasm,CIN),按轻、中、重分为3级:CINⅠ(称为宫颈低级别鳞状上皮内病变)、因CINⅡ、CINⅢ(含原位癌)的临床处理相似,两者合称宫颈高级别鳞状上皮内病变,简称CINⅡ+。病理报告提示CINⅠ及以上病变为组织学阳性,病理报告提示正常或炎症为组织学阴性。
1.3 统计学处理 采用SPSS 20.0统计软件,两组率的比较采用χ2检验,P<0.05为有统计学意义。
2 结果
2.1 一般情况 103例宫颈细胞学检查为ASCUS或LSIL的女性,年龄16-68岁,其中88例细胞学检查提示ASCUS,15例细胞学检查提示LSIL。我们对所有病例采取高危HPV-DNA检测进行分流,其中发现高危型HPV阳性者54例。组织病理学检查发现CINⅠ17例,CINⅡ+7例。
2.2 高危型HPV感染情况 在103例研究对象中,发现54例高危型HPV感染,高危型HPV感染率为52.43%。值得注意的是,我们发现了34例高危型HPV阳性而无组织学异常者。
2.3 高危HPV-DNA检测减少宫颈细胞学假阴性结果情况 经我们研究发现共有45人经高危型HPV-DNA检测为阴性,并经电子阴道镜检查进一步验证无明显异常。
2.4 宫颈病变的发病情况 高危型HPV阳性组中发现宫颈病变患者20例,其中发现CINⅡ+共7例,CINⅠ共13例;高危型HPV阴性组发现CINⅠ共4例,未发现CINⅡ+病例。高危型HPV阳性组的宫颈病变发病率(37.04%)高于高危型HPV阴性组的宫颈病变发病率为8.16%,经χ2检验,两组差异有统计学意义(P<0.05)。可以认为高危型HPV阳性组的宫颈病变发病率高于高危型HPV阴性组的宫颈病变发病率。见表1。
3 讨论
因德国科学家Hausen博士的发现,我们知道人乳头瘤病毒感染是导致宫颈癌发生的主要原因。目前的研究已经明确,HPV的持续感染是引起宫颈癌的必要因素口。只有持续的HPV感染才发生宫颈上皮内瘤变或宫颈癌,平均感染8-24个月,可发生CINⅠ、CINⅡ、CINⅢ,再过平均8-12年可发生浸润癌[4]。宫颈癌的发生、发展相对漫长,可以通过宫颈癌筛查而浓缩高危人群,重点预防。
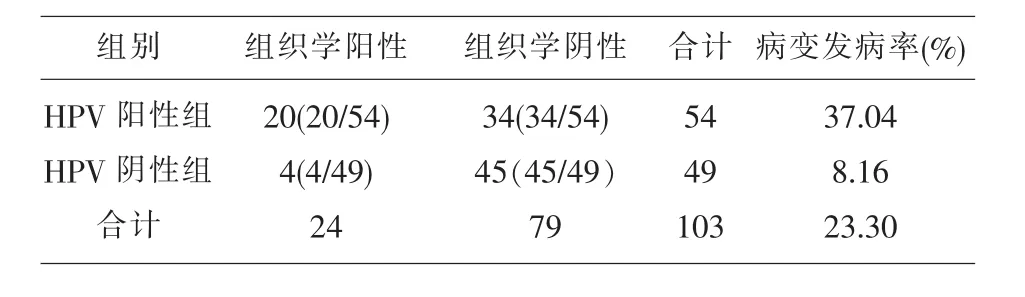
表1 103例宫颈细胞学异常者经高危型HPV-DNA分流后的病理检查结果比较
宫颈细胞学检查作为宫颈癌的重要筛查手段,在降低宫颈癌的发病率和病死率方面起到了重要作用。同时也应看到细胞病理学具有一定局限性,它主要依靠观察细胞形态变化诊断疾病,看不到组织结构,不能观察肿瘤和周围组织的关系,具有一定误诊率。ASC-US或提示鳞状上皮内病变,或提示HPV病毒感染,也有可能提示炎症、萎缩等相关改变。LSIL可提示HPV病毒感染,也可提示鳞状上皮内低度病变。2015年美国癌症协会(American Cancer Society,ACS)发表的美国癌症筛查指南综述中,推荐HPV检测联合细胞学筛查(co-testing)作为宫颈癌筛查首选方法[5]。林志金等[6]研究发现,宫颈液基细胞学检查联和HPV-DNA检测可以提高宫颈癌筛查阳性结果检出率,降低漏诊率。然而,由于我国各个区域的经济发展并不均衡,二联筛查方案在经济欠发达地区推广有一定的困难。单独宫颈细胞学检查仍是一些女性的首选筛查方案。当宫颈细胞学检查发现异常后,再使用高危型HPV-DNA检测进行分流,也是一种可选方案。因此,采用高危型HPV-DNA检测可以作为对细胞学检查的补充,浓缩高危人群。
本研究发现103例研究对象中,共有54例感染高危型HPV感染,高危型HPV感染率为52.43%,Wang等[7]研究结果表明,中国高危型HPV感染率平均为21.07%,结合我们的研究,可以认为宫颈细胞学异常人群的高危型HPV感染率高于一般人群。通过对HPV-DNA检测项目的使用,我们发现了34例高危型HPV阳性而无组织学异常者,达到了浓缩高危人群的目的,这类人群虽无组织学改变,也应加强随访,定期复查,高危型HPV-DNA检测和宫颈细胞学检查可作为高危型HPV阳性而无组织学异常者的随访指标。同时,可通过健康宣教、局部药物治疗等方式,提高其自身免疫,加强对HPV的清除。目前,针对高危型HPV持续感染的转阴治疗主要有手术治疗、物理治疗、药物治疗等[8]。药物治疗目前主要是通过调节局部免疫来对抗病毒感染,传统中药在治疗持续高危HPV感染方面有一定的效果。袁飞燕等[9]研究表明,保妇康栓治疗宫颈高危型人乳头状病毒持续感染的临床效果较佳,不良反应发生率低。
经我们研究发现,共有103例研究对象中,有45例的高危型HPV-DNA及阴道检查均为阴性,这45例的筛查年限可适当延长,3-5年一次即可。本研究发现高危型HPV阳性组的宫颈病变发病率高于高危型HPV阴性组的宫颈病变发病率,且发现的7例CINⅡ+患者均来自高危型HPV阳性组,这说明高危型HPV在宫颈病变的发生过程中起着重要作用,它提示一旦患者宫颈细胞学检查出现异常,进行高危型HPV-DNA检测能快速浓缩高危人群,并为这些高危人群及时行电子阴道镜,能有效检出宫颈鳞状上皮内病变患者尤其是宫颈高级别鳞状上皮内病变患者,能在宫颈细胞学检查异常人群的管理中可以起到很好的分流管理作用。值得注意的是,我们在高危型HPV阴性组中依然发现了4位宫颈鳞状上皮内低度病变患者,我们分析这可能与患者感染了低危型HPV有关,因此对于高危型HPV-DNA检测阴性的人群,仍不能放弃电子阴道镜的检查。
综上所述,高危型HPV-DNA检测在宫颈细胞学异常女性的管理中具有良好的应用价值。当然,本研究还存在着样本数量偏小的问题,我们的下一步工作将在扩大样本量的基础上,进一步比较各组间宫颈高级别鳞状上皮内病变的发病率,并对高危型HPV-DNA检测和电子阴道镜在宫颈高级别鳞状上皮内病变中的诊断价值进行讨论,此外,加强对高危型HPV-DNA阳性而无组织学异常人群的随访、观察也是我们下一步的工作重点。

