非小细胞肺癌组织中Syncytin-1的表达变化及与患者预后的关系
傅杨,夏西燕,李晓慧,庄学伟
(1 山东大学齐鲁医院,济南250012;2 济南市妇幼保健院;3 济南护理职业学院)
肺癌是严重危害人类生命健康的疾病,在全球范围内是发病率和病死率最高的恶性肿瘤,尽管肺癌的诊治水平不断提高,但5年生存率仍然较低[1]。Syncytin-1是人内源性逆转录病毒W基因家族(HERVWE1)的成员,定位于染色体7q21-22[2]。体外实验的相关研究显示,在多种人类恶性肿瘤中观察到Syncytin-1的过度表达,包括乳腺癌[3]、子宫内膜癌[4]、卵巢癌[5]、结直肠癌[6]、白血病和淋巴瘤[7]等。Syncytin-1与非小细胞肺癌(NSCLC)的相关性国内外少见报道,本研究应用免疫组织化学法检测了Syncytin-1在NSCLC癌组织和癌旁组织中的表达水平,并探讨了其与患者预后的关系。
1 资料与方法
1.1 临床资料 选择山东大学齐鲁医院1999年1月~2001年10月收治并经病理证实为NSCLC的患者30例,其中男23例、女7例,年龄37~75(57.87±1.72)岁,鳞状细胞癌16例,腺癌14例;TNM分期中Ⅰ期12例、Ⅱ期6例、Ⅲ期12例;出现淋巴结转移15例、无淋巴结转移15例。术中取患者的癌组织及癌旁组织(癌组织旁1~2 cm),离体后半小时内用10%中性甲醛固定12~24 h,脱水、石蜡包埋、制片。
1.2 NSCLC癌组织及癌旁组织中Syncytin-1表达检测 采用免疫组织化学法。将相应的蜡块切片进行免疫组织化学染色,兔抗人Syncytin-1单克隆抗体购于美国GeneTex公司,抗兔IgG抗体购于北京中杉金桥生物技术有限公司。具体步骤为:①将适量的EDTA修复液加入高压锅内,将电磁炉的功率调整至1 600 W对高压锅进行预热,待修复液沸腾后将切片放入锅内,并将电磁炉功率降至900 W,修复2.5 min,待修复液及切片冷却至室温后取出切片架,PBS冲洗3次,每次3 min;②滴加3% H2O2100 μL,以此阻断内源性过氧化物酶的作用,37 ℃孵育10 min,PBS冲洗3次,每次3 min;③滴加一抗溶液(兔抗人Syncytin-1单克隆抗体1∶100稀释)50 μL,室温孵育2 h左右,PBS冲洗3次、每次3 min;④滴加试剂1(Polymer Helper)50 μL,37 ℃温箱孵育20 min,PBS冲洗3次、每次3 min;⑤滴加二抗溶液(抗兔IgG)50 μL,室温孵育30 min,PBS冲洗3次、每次3 min;⑥DAB溶液显色3~5 min;⑦流水漂洗、复染、分色、返蓝、脱水、透明、封片;⑧显微镜下观察以评估染色质量和结果,拍照。阳性结果判定:Syncytin-1蛋白阳性染色为细胞膜和细胞质着棕黄色,细胞核用苏木精复染为蓝色。染色结果分为四类:“-”组织标本无阳性细胞;“+”组织标本的阳性细胞率<25%,着色较弱;“++”组织标本的阳性细胞率为25%~50%,着色适中;“+++”组织标本的阳性细胞率>50%,着色较深。Syncytin-1阳性细胞率=着棕黄色的细胞数/总细胞数(苏木精染成蓝色)×100%。

2 结果
2.1 NSCLC癌组织及癌旁组织中Syncytin-1阳性细胞率比较 所有细胞的细胞核被苏木精复染为蓝色,而Syncytin-1阳性细胞膜和细胞质被染成棕黄色,阴性的细胞膜和细胞质不着色。NSCLC癌组织及癌旁组织Syncytin-1阳性细胞率分别为35.41%±0.22%、2.17%±0.03%,NSCLC癌组织中Syncytin-1阳性细胞率高于癌旁组织(P<0.01)。见图1。以Syncytin-1阳性细胞率25%为界,阳性细胞率≥25%的患者为Syncytin-1高表达组,阳性细胞率<25%的患者为Syncytin-1低表达组,分别为19、11例。
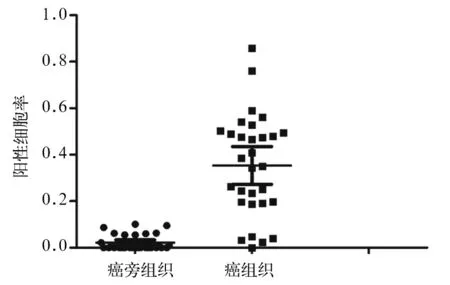
图1 NSCLC癌组织及癌旁组织中Syncytin-1阳性细胞率
2.2 5年存活组和5年死亡组癌组织中Syncytin-1阳性细胞率比较 5年存活组和5年死亡组Syncytin-1阳性细胞率分别为23.30%±0.16%、44.67%±0.21%。5年存活组Syncytin-1阳性细胞率低于5年死亡组(P<0.01)。见图2。
2.3 生存分析 Syncytin-1低表达组5年内死亡3例,占27.3%;Syncytin-1高表达组5年内死亡14例,占73.7%,Syncytin-1高表达组中的死亡比例高于Syncytin-1低表达组(P<0.05)。Kaplan-Meier生存曲线分析发现,Syncytin-1高表达组平均生存期为28个月,而Syncytin-1低表达组为64个月,两组比较,P<0.01。见图3。Cox比例风险回归模型分析结果显示,Syncytin-1阳性细胞率和临床分期是NSCLC死亡的危险因素(P均<0.05)。见表1。
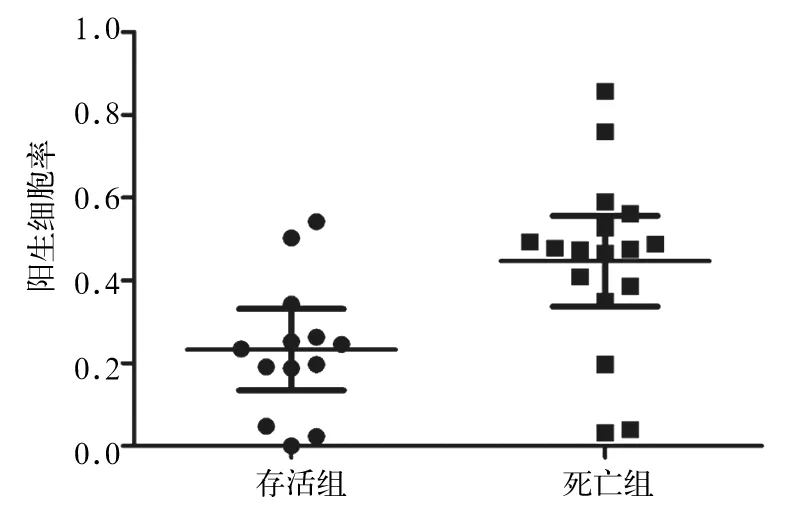
图2 5年存活组和5年死亡组Syncytin-1阳性细胞率
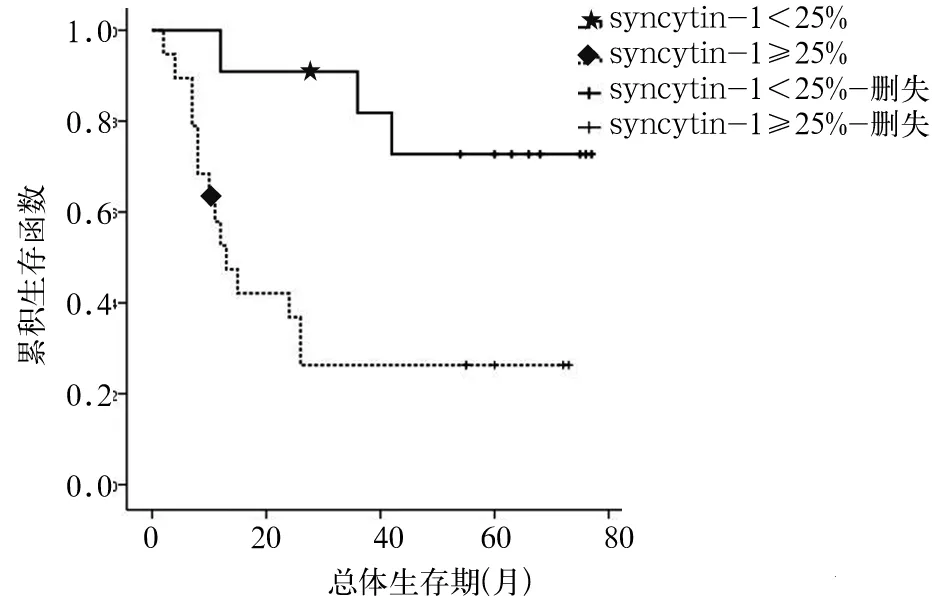
图3 Syncytin-1高表达与低表达患者生存曲线(Kaplan-Meier法)表1 NSCLC患者多变量Cox回归分析结果
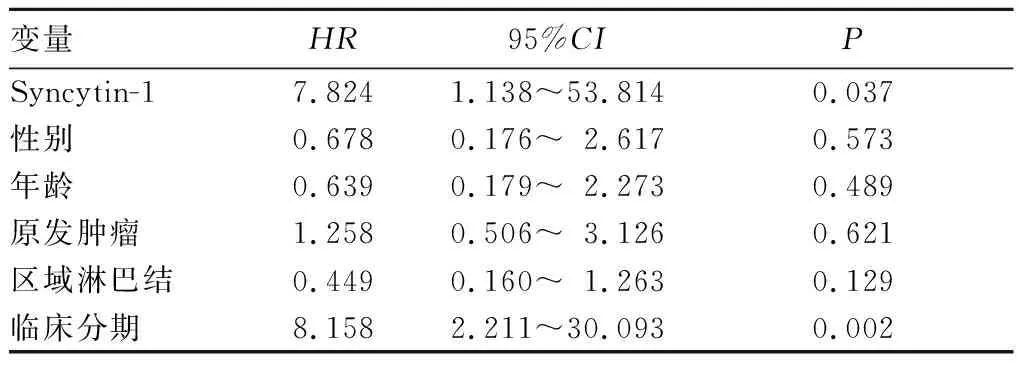
变量 HR 95%CI PSyncytin-1 7.824 1.138~53.814 0.037性别 0.678 0.176~2.617 0.573年龄 0.639 0.179~2.273 0.489原发肿瘤 1.258 0.506~3.126 0.621区域淋巴结 0.449 0.160~1.263 0.129临床分期 8.158 2.211~30.093 0.002
3 讨论
功能性的HERVWE1包括完整的长末端重复序列的非编码区和组特异性抗原、聚合酶、包膜(env)基因,只有全长env基因可以编码出有功能性的糖蛋白即Syncytin-1,由538个氨基酸组成。Syncytin-1已经进化为人类胎盘形态发生所必需的基因,借助于细胞融合功能将细胞滋养层细胞融合成合体滋养层细胞[2]。在我国,肺癌已成为癌症死亡的首要病因,且发病率和病死率还在不断增长。最新资料表明,美国2010年新发肿瘤患者150多万,其中肺癌患者22万余例,约占总数的15%,居各类癌症之首[8]。在美国肺癌已经是癌症患者死亡的主要原因,约75%的患者发现时已经处于中、晚期,所有阶段的5年生存率为15.6%,包括手术、化疗、放疗干预在内的治疗对原发性肺部恶性肿瘤患者的长期存活率大多没有改善作用[9]。NSCLC约占原发性肺癌的85%[10],预后很差。肿瘤的发生是一个多阶段多因素的结果,其中包括癌基因的激活和抑癌基因的失活,有些在胎儿期才表达的蛋白质在患癌后显著升高,如癌胚抗原和甲胎蛋白等。
据国内外相关文献报道,Syncytin-1在多种人类癌症组织中有异常表达。Strissel等[4]发现,与早期和高分化癌症相比,Syncytin-1在晚期和低分化的子宫内膜癌中过度表达。Larsson等[3]分析165例绝经前期淋巴结阴性的乳腺癌患者肿瘤组织中Syncytin的表达情况,其中38%的乳腺癌患者为阳性。Sun等[7]发现,Syncytin-1在急性髓细胞白血病中表达增加,并且Syncytin-1在四种白细胞(即原始细胞、粒细胞、淋巴细胞和单核细胞)中表达均增加。Maliniemi等[11]还发现,在蕈样真菌病活组织检查中存在Syncytin-1蛋白的表达,并且在恶性淋巴细胞中也有表达,特别是表皮性的恶性淋巴细胞中,我们通过免疫组织化学法证明,在NSCLC组织中有中至高等强度的Syncytin-1蛋白表达,而在癌旁组织中多不表达,这与Syncytin-1在其他人类恶性肿瘤组织中的表达报道一致。影响肺癌5年生存率的因素是多方面的,需要根据患者的全身情况、心理状态、肿瘤分期、组织学类型、恶性程度以及有无转移等因素综合考虑。Larsson等[3]报道,Syncytin表达较强的乳腺癌患者有更高的无复发生存率,并且可作为一个独立的预后指标。Larsen等[6]对140例结直肠癌病例进行回顾性分析,发现Syncytin在结直肠癌中均有表达,但在直肠癌中Syncytin表达增加伴随着总体生存率的下降,而在结肠癌中并无此现象。本研究显示,Syncytin-1在5年死亡组的表达高于5年存活组,提示Syncytin-1可以作为NSCLC的预后指标,表达高则预后不良。Syncytin-1高表达组死亡患者比例高于Syncytin-1低表达组,平均生存期低于Syncytin-1低表达组。我们将Syncytin-1阳性细胞率、患者性别、年龄、肿瘤的TNM分期以及临床分期等诸多因素纳入Cox比例风险模型,结果显示Syncytin-1阳性细胞率和临床分期是NSCLC死亡的危险因素。上述这些研究成果提示 Syncytin-1与NSCLC患者预后有关。
最新证据表明,Syncytin-1是一种多功能的蛋白质。癌细胞和内皮细胞均表达Syncytin-1的受体ASCT2,抗Syncytin-1治疗降低了Syncytin-1的表达,并抑制了内皮细胞与乳腺癌细胞之间的融合,这表明Syncytin-1与肿瘤细胞和内皮细胞的融合有关[12]。除细胞融合功能外,Syncytin-1还具有一些重要的非融合功能,Syncytin-1参与免疫抑制,可能有助于母体适应怀孕过程[13]。Syncytin-1在TGF-β1和TGF-β3存在的情况下可促进细胞增殖,这表明Syncytin-1是细胞增殖过程所必需的[14]。胎盘滋养层的生存似乎依赖于足够水平的Syncytin-1,因为敲减Syncytin-1会诱导广泛的细胞凋亡[15]。在病理条件下,Syncytin-1表达的下降可能导致细胞死亡和滋养细胞脱落,这是在先兆子痫胎盘中经常观察到的现象[16]。这些非融合功能(免疫抑制、细胞增殖、抗凋亡)可以被用来解释Syncytin-1在人类恶性肿瘤组织中过度表达的原因。
总之,Syncytin-1在NSCLC组织中过度表达,且与患者的预后有关,此为肺癌的诊断、治疗、预后判断提供了实验依据,为NSCLC发病机制的探索揭开了新的曙光,但Syncytin-1的病理生理功能以及在NSCLC中的表观遗传调控的确切分子机制仍需进一步研究探讨。

