糖尿病性周围神经病理性疼痛诊疗专家共识
中国医师协会神经内科医师分会疼痛和感觉障碍专委会
一、定义
神经病理性疼痛是指由躯体感觉系统的损害或疾病导致的疼痛。根据感觉神经系统受损的部位,神经病理性疼痛可分为周围神经病理性疼痛和中枢神经病理性疼痛。而糖尿病性周围神经病理性疼痛(diabetic peripheral neuropathic pain, DPNP) 是指由糖尿病或糖尿病前期导致的周围神经病理性疼痛。它最常见的表现形式为以肢体远端受累为主的对称性周围神经病理性疼痛,也可表现为单神经痛或臂丛、腰骶丛神经痛[1~3]。
二、流行病学
近30年来,我国糖尿病患病率显著增加。1980年全国14省市30万人的流行病学资料显示,糖尿病的患病率为0.67%, 其中20岁以上人群的糖尿病患病率为1.0%。1994至1995年进行了全国19省市21万人的糖尿病流行病学调查,25~64岁人群的糖尿病患病率为2.5%,糖耐量异常为3.2%。2007至2008年,全国14个省市进行了糖尿病的流行病学调查,我国20岁以上成年人的糖尿病患病率为9.7%,糖尿病前期为15.5%[4]。
约1/3的糖尿病病人和1/4的糖尿病前期者有对称性远端周围神经病[5]。糖尿病诊断后10年内,常有明显的临床神经病变,神经功能检查发现,60%~90%的病人有不同程度的神经病变,其中30%~40%的病人无症状。在糖尿病神经病变中,糖尿病周围神经病变占50%[5]。
多个人群的流行病学研究显示,国外DPNP的患病率为10%~26%[7~9],目前国内尚无针对DPNP的流行病学调查,但值得注意的是相当部分的病人并不知晓或及时就医。
三、发病机制
DPNP形成的机制错综复杂,包括外周敏化、中枢敏化、下行抑制系统的失能、离子通道的改变等,并且多种机制相互影响。
(一)疼痛上行传导功能增强
外周敏化是指外周伤害性感受神经元对传入信号的敏感性增加。外周伤害性感受器感知到刺激,伤害性信号经外周的神经纤维,由脊髓背根神经节(DRG)传入脊髓背角,经过初步整合后,通过脊髓上行通路传递伤害性信息,经丘脑到达皮质引起痛觉。发生外周敏化时,受损的细胞和炎性细胞(如肥大细胞,淋巴细胞)会释放出化学物质,如去甲肾上腺素、缓激肽、组胺、前列腺素、细胞因子以及神经肽等。这些细胞介质可使伤害感受器发生敏化,放大其传入的神经信号。中枢敏化是指脊髓及脊髓以上痛觉相关神经元的兴奋性异常升高或者突触传递增强,包括神经元的自发性放电活动增多、感受域扩大、对外界刺激阈值降低、对阈上刺激的反应增强等病理改变,从而放大疼痛信号的传递。多种离子通道的异常参与了神经病理性疼痛的发生。如在神经损伤后,脊髓后角(主要是突触前膜)钙离子通道上的α2-δ亚基高表达,钙离子通道异常开放,钙离子内流增加,导致兴奋性神经递质释放增加,神经元过度兴奋,从而产生痛觉过敏和痛觉超敏[10]。
DPNP损害的纤维主要为Aδ纤维以及C纤维。外周神经受损对DRG以及轴突细胞膜电压门控各通道的功能与表达容易产生影响,造成自发性异位放电以及痛性神经病变。患糖尿病大鼠C纤维以及Aδ纤维再生以及变性的同时,其交感神经节后纤维出现侧枝,即芽生现象,此时交感神经节后纤维处于兴奋状态,其末梢所释放的去甲肾上腺素就会选择性对肾上腺能α2受体以及P物质受体产生作用,使DRG激活且传入神经元,让其敏感化以及兴奋,继而表现出灼性神经痛以及痛觉过敏[11]。
DPNP期间周围神经向中枢第二、第三级神经元传递冲动增加。这种中枢传递的敏感化增加,改变了神经元对感觉传入的敏感度和感觉阈值范围从而造成疼痛。中枢传递的敏感化由兴奋性氨基酸、P物质的释放、离子通道开放,使细胞内Ca2+积聚等造成[12]。
(二)疼痛下行抑制功能受损
脑干对脊髓背角神经元具有下行抑制作用,下行抑制系统主要由中脑导水管周围灰质、延脑头端腹内侧核群(中缝大核及邻近的网状结构)和脑桥背外侧网状结构(蓝斑核群和KF核)的神经元组成,富含5-羟色胺(5-HT)和去甲肾上腺素(NE),他们的轴突经脊髓背外侧束下行,对脊髓背角痛觉信息传递产生抑制性调制。氧化应激和神经元炎症介导的神经变性造成了该通路中的5-HT和NE系统损害,使得大脑可能接受放大的疼痛信号[13,14]。
病程比较长的糖尿病痛性神经病变病人,丘脑和大脑精细感觉区域皮质之间所具有的联系功能下降,可见慢性疼痛能够使丘脑皮质之间的联系发生改变,使丘脑负反馈调节受到影响和破坏,所以当丘脑皮质之间功能发生紊乱时会表现出慢性疼痛[15]。糖尿病痛性神经病变者可出现运动诱发电位阀值下降,且皮质静息期缩短,运动诱发电位幅度和皮质静息期之间比值下降,可见若糖尿病病人伴有痛性神经病变,其皮质抑制功能可能受损[16,17]。
(三)急性血糖改变发生疼痛的机制
目前尚存争议。高血糖被认为是DPNP的触动因素。神经元暴露在高糖状态2 h即可产生明显的氧化应激反应,并启动细胞的程序化死亡即细胞凋亡。在糖尿病动物模型中,过氧化应激对神经胶质细胞的损伤造成了DPNP脱髓鞘病变,导致神经传导速度减慢及痛觉的出现,神经元中的氧化应激也可能引起轴突病变,轴突再生能力受损[3]。另外,氧化应激反应还可通过细胞内的各种调节通路激活细胞信号转导分子。在胰岛素及胰岛素增敏剂治疗控制血糖后,可使DPNP一些症状逆转。高血糖引起炎症及免疫反应所导致的细胞组织损害决定于该细胞和组织自身的抗氧化能力及其免疫防御能力。因为周围神经抗氧化能力弱,所以周围神经系统比中枢神经系统较易受损。此外,在血糖急剧降低后造成后续的血流动力学改变使得神经内膜缺血缺氧,小纤维明显受损,也可导致DPNP症状的发生。缺氧上调炎症细胞因子亦可造成DPNP。目前高血糖是否为慢性疼痛得以维持的主要因素尚存争议[18]。
四、临床表现
(一)症状体征
症状以双侧对称性肢体远端疼痛为主要特征,下肢重于上肢,远端重于近端,夜间痛甚。病程初期以双足远端受累多见,后逐渐向近端发展至小腿和手部。常见的疼痛包括自发性疼痛和刺激诱发性疼痛。自发性疼痛可表现为持续灼痛,间断刺痛、撕裂痛、电击痛、感觉迟钝等。刺激诱发性疼痛包括痛觉过敏和痛觉超敏:痛觉过敏指正常情况下可引起疼痛的刺激导致,疼痛程度较正常情况下更重;痛觉超敏指正常情况下不会引起疼痛的刺激(如触觉)导致出现疼痛[19]。体检示足趾震动觉和本体觉受损,跟腱反射减弱或消失,手套袜套样温度觉受损;感觉性共济失调,肌萎缩无力、肌肉颤动。C类纤维受累,部分表现为自发性疼痛或痛觉超敏。大纤维受累可见较轻微的脚踩棉花感,走路时感觉地面异常,读书时翻页困难,不能触摸分辨硬币等[20]。
(二)急性DPNP的临床表现
多继发于血糖水平的突变,包括突然改善与恶化。表现为重度疼痛,痛觉超敏明显,影响日常活动。常伴有感觉异常、体重下降、重度抑郁,神经系统体征不明显。电生理检查正常或轻微异常。急性DPNP较为少见,预后较好,有自限性,病程多小于6个月,1年内常可完全缓解[21]。
(三)慢性DPNP的临床表现
多见于糖尿病病程数年后,疼痛持续 > 6个月,夜间痛甚,包括自发性疼痛和刺激诱发性疼痛。慢性DPNP应用镇痛剂效果较差,后期常发生镇痛剂依赖或镇痛剂耐受,影响生活质量[22]。
五、诊断及鉴别诊断
(一)诊断标准
1.有糖尿病或处于糖尿病前期
通过检测空腹血糖、糖耐量试验、糖化血红蛋白明确。
2.存在周围神经病变
临床表现、神经系统查体及神经电生理检查证实存在周围神经病变。糖尿病周围神经病变,可以大致分为大纤维神经病变和小纤维神经病变[23]。大纤维神经病变包括Aα-和Aβ-纤维,受损的主要临床表现包括麻、木、肌肉深部疼痛、无力、伴有平衡障碍的共济失调,小纤维神经包括Aδ纤维和C纤维,受损的临床表现主要表现为烧灼样、刀割样、电击样疼痛、痛觉过敏和超敏。大纤维神经病变查体可发现腱反射减低、音叉振动觉减弱、手足肌肉萎缩,小纤维神经受损的体格检查包括冷热温度觉和痛觉的减退,正常的肌力、反射和神经传导,影响自主神经功能会出现排汗异常、皮肤干燥等。大纤维神经病变的神经电生理检查可发现神经传导异常,而小纤维神经受损的病人即使有临床表现,也可能没有神经传导异常,但可以通过皮肤活检判定神经纤维密度。
3.诊断标准[24]
周围性神经病理性疼痛诊断标准为:①疼痛位于明确的神经解剖范围;②病史提示周围感觉系统存在相关损害或疾病;③至少1项辅助检查证实疼痛符合神经解剖范围;④至少1项辅助检查证实存在相关的损害或疾病。肯定的神经病理性疼痛:符合上述①~④项标准;很可能的神经病理性疼痛:符合上述第①、②、③或④项标准;可能的神经病理性疼痛:符合上述第①和②项标准,但缺乏辅助检查的证据。
4.排除其他导致痛性周围神经病理性疼痛的原因,如代谢性、感染性、中毒性等。
(二)辅助检查
需要完善神经传导及针极肌电图,神经传导测定在DPNP的诊断中具有重要作用。DPNP病人早期感觉神经传导可正常或仅有轻微改变,神经传导速度的改变与DPNP的发生和严重程度无相关性。病程后期大纤维受累时,随病程增加,神经传导速度逐渐下降,波幅减低。如果测定主要表现为感觉神经动作电位波幅降低,以下肢远端更为明显,传导速度相对正常, 也可有轻度减慢,符合长度依赖性轴索性周围神经病的特点;针极肌电图检查可见异常自发电位,运动单位电位时限增宽、波幅增高。小纤维病变往往伴有自主神经功能的损害,皮肤交感反应测定有助于发现交感神经通路的异常,表现为潜伏期延长,波幅降低或引不出波形。定量感觉测定可以定量评估深感觉和痛温觉的异常,对于痛觉纤维的评估有助于小纤维神经病变的判断,在肌电图正常、临床表现主要为小纤维神经病的病人,可以进行皮肤活体组织检查,通过显微镜下神经末梢密度检测有助于诊断。痛觉诱发电位也可以评估痛觉通路的异常,目前主要用于临床研究。
辅助量表推荐使用数字评分量表评估疼痛的严重程度,如简单的视觉模拟评分(0 =不痛,10 =最严重的疼痛)。其他经过验证的量表和问卷包括神经病理性疼痛症状量表DPNPI、改良后的简明疼痛量表(BPI-SF)、神经病理性疼痛问卷、LANSS疼痛量表、McGill疼痛问卷等[25~29]。除此之外,还可以使用生活质量量表和医院焦虑抑郁量表(HADS)来评估疼痛对病人生活质量和情绪的影响。
(三)鉴别诊断
由于DPNP是一种排他性的诊断,仔细的临床病史和下肢外周神经和血管检查是必不可少的,对于主要累及大纤维神经的病人,需要除外慢性炎性脱髓鞘性多发性神经根神经病、单克隆丙种球蛋白病、急性炎症性脱髓鞘性多发性神经根神经病、神经肌肉病、维生素B12和叶酸缺乏、甲状腺功能减退、副肿瘤综合征以及放疗药物副作用所致[1]。对于主要累及小纤维神经和无髓纤维神经的病人,需要排除代谢等原因引起的疾病,如尿毒症、甲状腺功能减退、维生素B12或叶酸缺乏、急性间歇性卟啉病、酒精中毒、重金属、工业碳氢化合物中毒、炎症或感染、结缔组织病、血管炎、乳糜泻、结节病、莱姆病、人类免疫缺陷病毒、乙型或丙型肝炎病毒、遗传性疾病、副肿瘤综合征和淀粉样变性等[23]。
六、治疗
(一)概述
疼痛是DPNP常见的临床症状,约见于50%左右的糖尿病和13%左右的糖耐量受损的病人,严重影响病人的正常生理和精神状态,出现睡眠障碍、营养失调、运动受限、情感障碍,从而降低生活质量和工作能力[30~32]。疼痛的发生与疼痛上行和下行调控的神经机制密切相关,因此,临床中就可以选用不同镇痛机制的药物。缓解糖尿病性周围神经病理性疼痛,药物治疗是最基本的。主要药物包括三环类抗抑郁药物、5-HT和NE双通道再摄取抑制药物、抗惊厥药物、局部用药、盐酸曲马多和吗啡类镇痛药物等[33]。
在选择药物治疗时应遵循几项原则:个体化用药、联合治疗、充足的疗程、有效的血糖管理等。个体化用药是指针对病人的疼痛进行鉴别诊断,有时相关神经嵌压和受损也会出现类似糖尿病性周围神经痛的症状,因此,个体化治疗首先依赖于鉴别诊断,其次是糖尿病周围神经痛的分层诊断(疾病的程度和共病),再其次是病人对不同药物种类的耐受性。联合用药指许多糖尿病周围神经痛病人对单一药物疗效不满意时,两种和两种以上不同作用机制的药物联合使用常常可以提高治疗效果,例如度洛西汀联合普瑞巴林镇痛效果和改善生活质量要优于单一药物的治疗。充足的疗程是指这类镇痛药物常常需要几周的时间才能达到较好的镇痛效果,有时早期还需要药物剂量的滴定,故4~8周的药物治疗是基本疗程,有时需要更长期的服药来控制疼痛。有效的血糖管理是糖尿病周围神经病理性疼痛的基础治疗,由于疼痛系糖代谢障碍所导致的慢性周围神经损伤过程,只要这种障碍存在,欲使疼痛完全缓解或“无痛”状态是非常困难的,临床上常用糖化血红蛋白作为监测指标,血糖代谢的改善有助于减少相关疼痛的发生,缓解疼痛症状,也可以保证各种镇痛药物充分发挥治疗效果[34,35]。
(二)药物治疗
1.药物分类
(1)SNRIs类药物:此类药物主要的作用机制为抑制5-HT和NE的再摄取。大量随机对照试验肯定了SNRI类尤其是度洛西汀的治疗效果[36~40]。研究显示度洛西汀与阿米替林有相似的疗效,但是具有更小的副作用[41]。度洛西汀在改善病人睡眠和生活质量方面有显著帮助[38,39]。2004年,美国FDA批准了度洛西汀用于治疗DPNP[42]。在一项中国的临床试验中显示,60 mg度洛西汀对治疗DPNP的安全性和有效性的结果和国外相似。此类药物中,与安慰剂相比,文拉法辛也对治疗DPNP有显著疗效[43,44]。
常见不良反应及注意事项:此类药物禁止与单胺氧化酶抑制剂或者和5-羟色胺强化剂联用,因为会出现危及生命的中枢五羟色胺综合征。其他常见不良反应有胃肠道不适,多汗和增加出血风险[45]。
(2)三环类抗抑郁药:本类药物属于非选择性单胺摄取抑制剂[36]。大量随机对照试验和Meta分析肯定了三环类抗抑郁药特别是阿米替林在治疗DPNP的效果[46~49]。然而,特别在老年病人中,因为药物胆碱能的副作用常常会限制其使用[50]。所以在老年病人中,应从小剂量开始,视病情酌情用量。
常见不良反应及注意事项:最值得注意的副作用为心律失常,所以在初次使用此类药物前应充分评估病人心血管情况[51]。对于有心脏疾病或者高度怀疑心脏疾病的病人应谨慎使用[52]。
(3)抗惊厥药:加巴喷丁和普瑞巴林可以结合钙离子通道的α-2-δ亚单位,减少钙离子内流。大量高质量的随机对照试验肯定了加巴喷丁和普瑞巴林的治疗效果[53~57]。普瑞巴林在药物代谢动力学方面相比加巴喷丁有明显优势。
托吡酯:一项大型的安慰剂对照研究评估了托吡酯作为药物治疗DPNP的疗效[58]。结果显示相比较安慰剂,托吡酯显示有缓解DPNP的效果。
常见不良反应及注意事项:普瑞巴林最常见的不良反应有头晕、嗜睡、外周水肿和体重增加,通常有剂量依赖性。普瑞巴林与噻唑烷二酮类抗糖尿病药物合用时应关注病情变化。
(4)阿片类药物:证据表明,阿片类药物对治疗糖尿病周围神经病变性疼痛有显著疗效[59~63]。
常见不良反应及注意事项:阿片类物质应用最主要的担忧在于药物滥用及呼吸抑制作用[45]。
(5)局部用药:局部用药的优越性在于可以避免全身用药带来的副作用,是很好的辅助治疗药物。
辣椒碱:此类药物的作用机理为促进神经递质P物质释放,使P物质耗竭,从而降低神经元传导疼痛信号的能力[64,65]。在治疗DPNP方面,目前有两项试验证实有明显疗效[45,66,67]。
利多卡因贴剂:可以显著减少疼痛,从而提高病人生活质量[68,69]。
2.药物推荐级别及推荐剂量(见表1)[45,50]
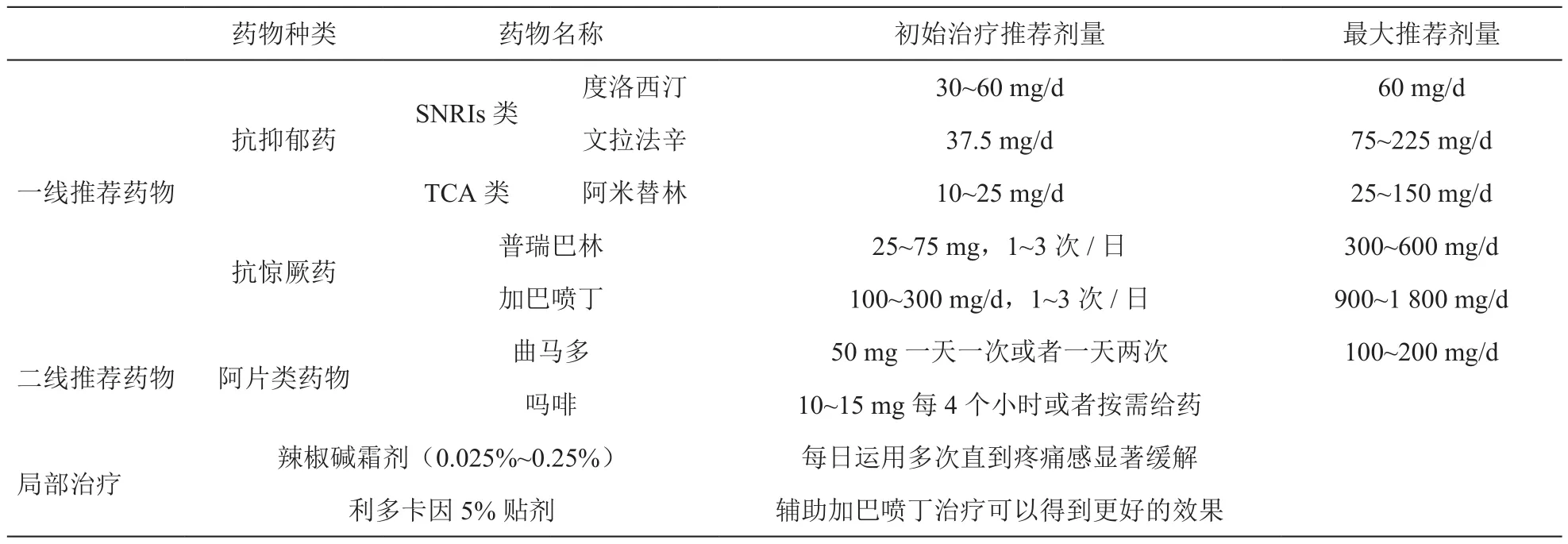
表1 药物推荐级别及推荐剂量
(三)非药物治疗
对于DPNP病人,非药物治疗常与药物治疗相结合, 或作为药物治疗的补充。由于DPNP治疗的个体差异较大,一些病人尽管接受大剂量药物治疗,但疼痛控制仍然不佳,或因为药物带来的不良反应,让病人服药的依从性下降[70,71];而此时非药物治疗便成为不错的选择。
1.电刺激治疗:包括经皮神经电刺激治疗(TENS)、脊髓电刺激治疗(SCS)、调频电磁神经刺激(FMENS)等。一些随机试验表明,TENS对于DPNP的病人有效,可以推荐使用[72,73]。不少案例报道提示,脊髓电刺激对周围神经病变有较好的疗效[74]。一项交叉试验表明,对那些常规治疗效果不佳的DPNP病人,脊髓电刺激能有效缓解疼痛[75]。Thakral等分析了8项运用电刺激治疗DPNP的研究,其中6项研究的结果显示电刺激能有效缓解病人的疼痛[76]。
2.针灸治疗:结合祖国医学的理论,针灸镇痛在临床上已被广泛的接受。Garrow等在一项单盲随机对照试验中显示,针灸治疗能缓解DPNP病人的疼痛[77]。 一些非对照试验也证实针灸对于DPNP有一定的治疗效果[78]。
3.近红外线治疗:红外线又分为近红外线、短波红外线、中波长红外线;一项双盲随机对照试验表明,近红外线治疗能恢复DPNP病人的感觉,缓解疼痛[79]。
4.低强度激光治疗:使用低强度激光照射相关区域,可缓解DPNP病人的疼痛[80]。

