鲤浮肿病毒混合感染的监测与分析
王姝 徐立蒲 王小亮 张文 王静波 曹欢 张利峰
1.北京市水产技术推广站北京100021;2.北京海关(原北京出入境检验检疫局)
近几年,在全国多个省市养殖的鲤和锦鲤中流行一种“急性烂鳃病”,发病急,死亡率高。发病初期病鱼常漂浮在水面,失去意识,一经触动随即游动。为控制病情,养殖户施用药物,不但无效反而造成更高死亡率。目前已经证实“鲤急性烂鳃病”是鲤浮肿病毒(CEV)感染所致,仅有少数病例是锦鲤疱疹病毒(KHV)或其他病原感染引起[1-3]。值得注意的是2014年E.lewisch等[4]在奥地利的1个渔场检测了9尾锦鲤和13尾普通鲤鱼,发现1尾鲤鱼混合感染鲤春病毒血症病毒(SVCV)和CEV,5尾鱼单独感染CEV。2013—2015年M Matras等[5]调查波兰的36个渔场,发现17个CEV阳性渔场,其中2个渔场被检出CEV和KHV均为阳性。为了分析CEV混合感染对检测的影响,以及可能引发的病原易感性变化,本研究对鲤、锦鲤养殖场样品同时检测CEV、SVCV和KHV,以研究我国CEV和SVCV、KHV混合感染情况,为今后开展疫病的监测检测、确诊、研制疫苗、有效防控措施制定等工作提供依据。
1 材料与方法
1.1 样品
2017年3-8月在全国水生动物流行病学监测中抽取鲤或者锦鲤样品93份(每份150尾),依据检测方法取靶器官组织,每10~15尾鱼的组织混为一个小样,进行CEV,KHV和SVCV的检测。对其中1个监测样品(安徽阜阳某观赏鱼养殖场样品)进行了逐条鱼检测其混合感染情况,该养殖场的锦鲤发病死亡,有体表出血、烂鳃等临床症状。采集发病锦鲤20尾,剖取每尾鱼的肝、脑、脾、肾和鳃组织混合研磨组成1个小样,随机编号1~20,同时检测SVCV、KHV和CEV。
1.2 主要试剂
M199细胞培养液购自GIBCO公司;DNA(DNeasy Blood&Tissue Kit)试剂盒和RNA(RNeasy plus Mini Kit)试剂盒购自德国Qiagen公司;AMV反转录酶、DNA聚合酶、dNTP等试剂购自上海生工生物工程(上海)股份有限公司。
1.3 CEV的PCR检测
采用Oyamatsu等[6]建立的nest-PCR方法,其引物依据痘病毒编码外膜蛋白的4a保守基因设计。第一次PCR扩增548 bp片段,再从中扩增180 bp片段。第一次PCR扩增的正向引物F1:5’-GCTGT TGCAACCATTTGAGA-3’,反向引物R1:5’-TGCA GGTTGCTCCTAATCCT-3’,扩增的基因片段为548 bp;第二次扩增的正向引物F2:5’-GCTGCTGCACT TTTAGGAGG-3’,反向引物R2:5’-TGCAAGTTATT TCGATGCCA-3’。
1.4 KHV的PCR检测
按照SC/T 7212.1-2011检测方法[7],取组织液抽提核酸后直接用PCR检测KHV的TK和Sph基因片段。
1.5 SVCV检测
按照GB/T 15805.5-2008检测方法[8],将组织悬液接种到鲤鱼上皮瘤细胞(EPC)中培养。15 d后收集细胞悬液,用试剂盒抽提核酸,扩增SVCV的G基因片段。
2 结果
2.1 全国流行病学监测样品中SVCV、KHV和CEV的检测结果
随机监测样品93份(抽样水温15~27℃),检测CEV、SVCV和KHV。发现CEV阳性50份,占比54%(表1)。其中5份样品存在混合感染。4份是CEV和SVCV的混合感染,分别来自北京通州、新疆、安徽和黑龙江的4个渔场。1份是CEV和KHV的混合感染,来自北京房山某渔场。
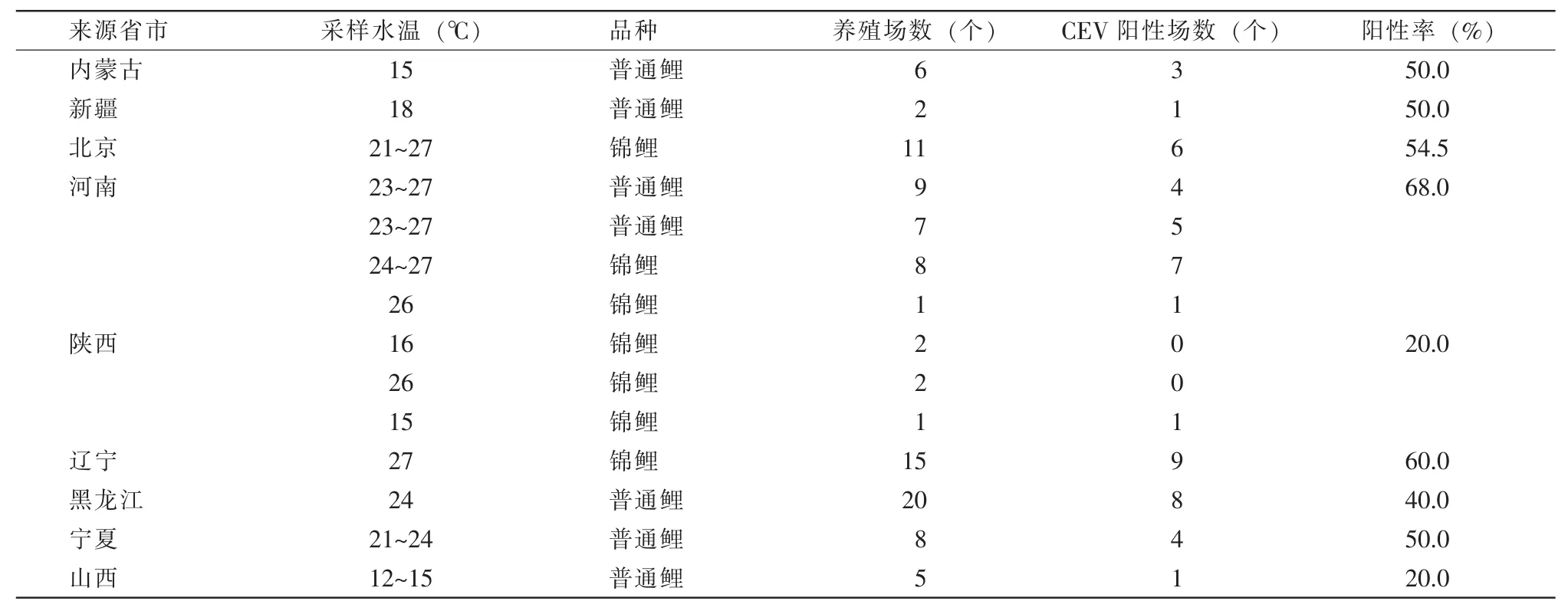
表1 随机监测的普通鲤和锦鲤养殖场的基本情况及检测结果
2.2 安徽混合感染锦鲤样品中CEV、SVCV和KHV的检测结果
在安徽观赏鱼场抽样检测20尾发病锦鲤。部分样品鱼有皮肤出血、烂鳃、体表粘液增多等临床症状(图1);个别鱼眼球突出、肛门红肿;解剖后发现腹水、肝出血或水肿、脾肿大、肾肿大。20尾鱼的检测结果见表2。其中有7尾为CEV阳性,7尾中有5尾同时还感染了SVCV,未发现有KHV感染。

图1 安徽样品鱼的临床症状,示体表出血
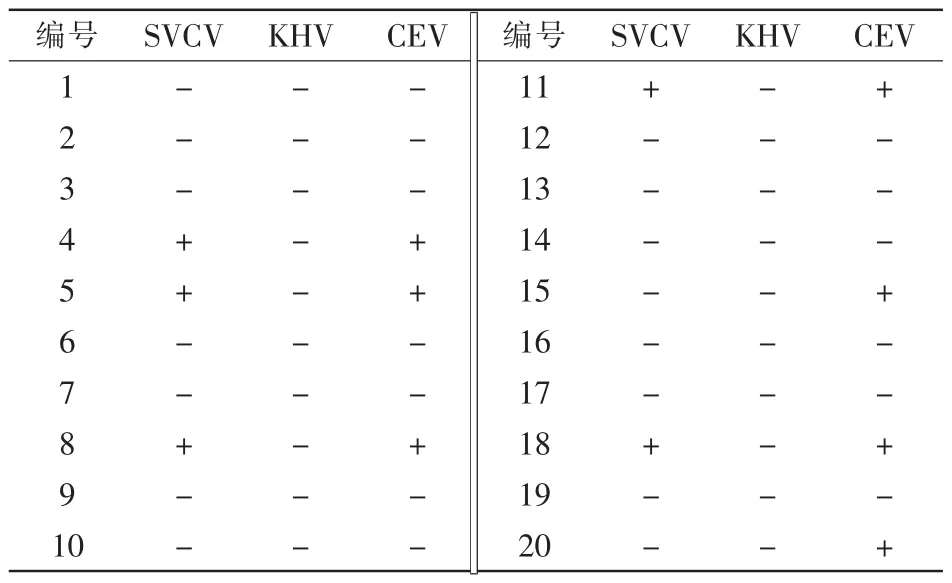
表2 安徽锦鲤养殖场样品的SVCV、KHV和CEV检测结果
3 讨论
本研究对93份流行病学监测样品进行了SVCV、KHV和CEV的检测,发现CEV阳性50份,占比54%,其中5份样品存在混合感染,4份是CEV和SVCV的混合感染,1份是CEV和KHV的混合感染。
CEV感染率54%,与2015年波兰调查的鲤养殖场CEV阳性率47%相当[5],但显著高于全国的SVCV阳性检出率(3.33%)和KHV阳性检出率(1.3%)[9],提示在我国CEV有较高的流行率。混合感染在CEV感染阳性样品中占10%,提示“鲤急性烂鳃病”的病因复杂。
在CEV调查中,被CEV感染的病鱼呈现行动迟缓、昏睡、鳃丝肿胀、烂鳃、体表出血等临床症状,并且临床症状与病程相关联。前期多表现出行动迟缓、鳃丝肿胀,后期则出现昏睡、烂鳃、出血等症状。在分析CEV与SVCV、KHV的混合感染时,我们发现临床症状与水温具有一些相关性,不同温度下症状有所不同。12~16℃水温时,发病的样品鱼呈现烂鳃、出血、肛门红肿等类似SVCV的临床症状(图1),比如北京通州、安徽和新疆渔场的样品。22~25℃水温时,发病样品鱼呈现类似KHV的烂鳃症状(图2)。人们容易把CEV、SVCV和KHV感染混淆,因此,不能根据临床症状对CEV做出初步诊断。还需要注意的是,有些样品虽然是CEV阳性,但是既没有临床症状也没有发病死亡。Adamek等[10]也曾报道有些无临床症状的样品中检出的CEV拷贝量非常高。这提示着即使被CEV感染,鱼类也不一定出现临床症状和发病死亡,发病可能还需其他条件刺激,比如环境因子突变、被其他病毒感染等。

图2 北京房山样品鱼的临床症状,示鳃丝肿胀
为进一步分析混合感染的致病原,我们在安徽混合感染发病渔场取鱼20尾,逐条检测,发现5尾CEV和SVCV混合感染,2尾单独感染CEV,但没有发现单独感染SVCV的鱼。感染CEV的病鱼数量多于混合感染,结合全国93个样品的检测结果,提示在“鲤急性烂鳃病”中CEV可能是原发感染,而SVCV是继发感染。
当同时或继发感染一种以上的病原,病原间的作用可以是协同,或者拮抗,增加或降低疾病的严重程度,这种相互作用对疾病的发生产生重要影响[11]。比如病毒性出血性败血症病毒(VHSV)和传染性造血器官坏死病病毒(IHNV)混合感染时,VHSV会阻碍IHNV对虹鳟的感染并导致IHNV在鱼的各内脏组织中分布受限,这种干扰和拮抗作用可能是由于两种病毒竞争同一细胞表面受体[12,13]。水生双RNA病毒(ABV)感染牙鲆后,再用VHSV感染,结果发现ABV的初级感染给鱼提供了非特异性保护以对付VHSV的次级感染,这种非特异性保护是因为ABV能诱导细胞产生具有抗病毒活性的干扰素[14]。本研究发现在5个混合感染渔场中,4个渔场的鱼具有出血、烂鳃等临床症状并发生大量死亡,其中3个SVCV和CEV混合感染死亡率在80%以上,1个KHV和CEV混合感染死亡率在90%以上。徐立蒲等根据监测调查数据推测CEV发病后的死亡率在30%~40%[1-3,15],说明混合感染引发的死亡率显著高于CEV单独感染,提示着养殖鱼类因CEV的侵袭而抗病力降低,一旦再次被其他病毒感染,双重感染就会引发鱼类暴病死亡,因此SVCV和KHV在鲤浮肿病的致病过程中起协同作用。关于鱼类混合感染的文献很少。在混合感染时病原的感染力和毒力会发生变化。研究鱼类混合感染时发生的协同或拮抗作用,对了解免疫反应、研制疫苗具有重要意义。

