丹参注射液体外对神经干细胞分化细胞突起形成的影响
神经退行性疾病 (Neurodegenerative disease) 是指脑和脊髓神经组织中神经元丧失的一种病理状态。神经元是执行大脑和脊髓功能主体,神经元的主要功能包括传导和感觉等,如控制机体运动,及时做出反应来应对周围环境变化,并作出决策。神经元属于永久性细胞,所以过度的损害可能是毁灭性的,不可逆转的。神经退行性疾病是由神经元或其髓鞘的丧失所致,随着时间的推移而恶化,导致功能障碍。临床主要包括影响运动,如小脑性共济失调和影响记忆以及相关的痴呆症,如阿尔茨海默病表现为日常生活能力进行性减退、认知和记忆能力降低,以及各种行为障碍和神经精神症状为特征的严重疾病,针对阿尔茨海默病的新疗法神经干细胞移植、免疫疗法、基因治疗发挥了一定积极作用[1,2]。神经系统缺血损伤修复中骨髓间充质细胞移植一定程度上有助于新的血管形成和大脑认知功能的恢复。神经干细胞移植有助于神经元的结构重建和功能恢复,神经干细胞分化神经元参与再生和修复过程中,在微环境作用下,形成功能性连接,建立突触联系是关键的一环。丹参注射液中的主要成分为丹参素、丹参酮等,其通过降低血脂、抗凝血、抗氧化、抑制黏附分子的表达等途径,具有很强的抗动脉粥样硬化的作用,复方丹参注射液可显著改善缺血性脑卒中患者临床症状,且药物不良反应发生率低,安全性高[3,4]。本研究采用SD大鼠来源的神经干细胞,在丹参注射液干预下,探索丹参对神经突起发生的诱导及其作用机制,旨在为进一步探讨突触形成建立功能性神经通路奠定基础。
1 材料与方法
1.1 实验动物、试剂和主要仪器 清洁级新生1日龄大鼠,由济宁医学院日照校区实验动物中心提供。丹参购自北京同仁堂药店,产自山东莒县。胎牛血清 (FBS)、DMEM/F12培养基、胰酶、大鼠nestin抗体、NSE抗体、马血清 (HS) 购于美国Sigma公司,DAB显色试剂盒北京中山生物技术有限公司;nestin抗体购自美国Chemicon公司。抗β肌动蛋白 (β-Actin) 抗体、抗β微管蛋白III抗体、anti-phospho-ERK1/ERK2抗体购自Santa Cruz Biotechnology公司,ECL 检测试剂Amersham公司。显微图像 Olympus CellSens Dimension软件包、相差显微镜来自Olympus公司。电泳仪,制胶板,电泳槽,湿转的转膜槽、半干转仪,脱色摇床,暗室,X光片,红外灯,成像仪等来自济宁医学院药学院药学实验中心提供。
1.2 实验方法
1.2.1 丹参注射液制备 取丹参1500 g,加水煎煮3次,每次时间为2 h、1.5 h、1.5 h,将煎液合并后滤过,滤液减压浓缩至750 ml。经75%乙醇沉淀后,再次经85%乙醇沉淀,每次均冷藏放置后滤过,滤液回收乙醇,并浓缩至约200 ml,加注射用水至400 ml,混匀,冷藏放置,滤过,用10%氢氧化钠溶液调节pH值至6.8,煮沸30 min,滤过,加注射用水至1000 ml,灌封灭菌。
1.2.2 新生大鼠神经干细胞原代培养、传代培养和神经干细胞增殖分化能力鉴定 新生大鼠无菌操作取脑腹侧10 mm×10 mm×10 mm大小组织,剪碎,加入胰酶吹打离心,稀释后接种到神经干细胞无血清培养基(37 ℃、5﹪CO2及95﹪空气)。常规换液体与传代,取第4代培养细胞进行nestin神经干细胞标志蛋白监测和分化细胞监测(NSE表达)。加入胰酶吹打离心稀释到5×104个/孔,用48孔培养板培养,DMEM/F12培养基加入5﹪胎牛血清100 U/ml、青霉素G和100 μg/ml链霉素CO2培养箱进行培养。每24 h更换培养液。
1.2.3 丹参注射液干预后测定 在加入不同浓度的丹参注射液继续培养 48 h,同时设立神经生长因子NGF对照组,1%戊二醛固定和姬姆萨染色,倒置相差显微镜下随机高倍视野观察和计数细胞。神经干细胞一般为球形,分化细胞神经突起出现即为计数细胞,突起的数目和长度随着培养时间延长增加,统计突起发生率。显微图像 Olympus CellSens Dimension软件进行突起长度分析采集数值。免疫组织学分析和蛋白质印迹Western blot分析。常规免疫组织化学方法用抗β微管蛋白III抗体检测突起和细胞内的表达情况。进一步将诱导分化细胞裂解后提取总蛋白,行免疫印迹检测,10%的SDS-PAGE凝胶进行电泳,电泳分离后电转至硝酸纤维素膜。大鼠抗β微管蛋白III抗体(1∶10000),大鼠抗磷酸化ERK1/ERK2抗体。
1.3 统计学分析 应用SPSS 22.0对相关实验数据进行统计学分析。Student’st检验和Tukey’s法进行方差分析,P<0.05表示差异有统计学意义。
2 结 果
2.1 神经干细胞的培养和鉴定 对所培养细胞克隆取第4代进行免疫荧光染色,球形细胞少突起,细胞质和细胞膜呈现红色荧光染色,Nestin(+),在 胞胞浆呈现鲜红色(见图1),随机取其他传代重复实验发现nestin随着传代的进行恒定表达。加入血清后诱导分化细胞,免疫学显色NSE(+)符合神经元特征(见图2)。以上证实细胞克隆具有分化能力和增殖能力符合神经干细胞特征。

图1 培养细胞nestin蛋白表达(SABC-Cy3×400)

图2 分化细胞NSE表达(SP×400)
2.2 丹参注射液对神经干细胞分化细胞突起形成的影响 图3示NGF神经生长因子对照组突起数量少,较短。图4示SMN 明显诱导神经干细胞神经突起的发生,长度明显增加,免疫学显示βIII-tubulin蛋白阳性(见图5)数量增多与浓度呈正相关。图6示作用 48 h后SMN诱导后细显微图像Olympus Cell Sens Dimension软件实时采集分析突起长度(*P<0.05,**P<0.01,***P<0.001)。

图3 NGF对照组诱导突起形成(×200)
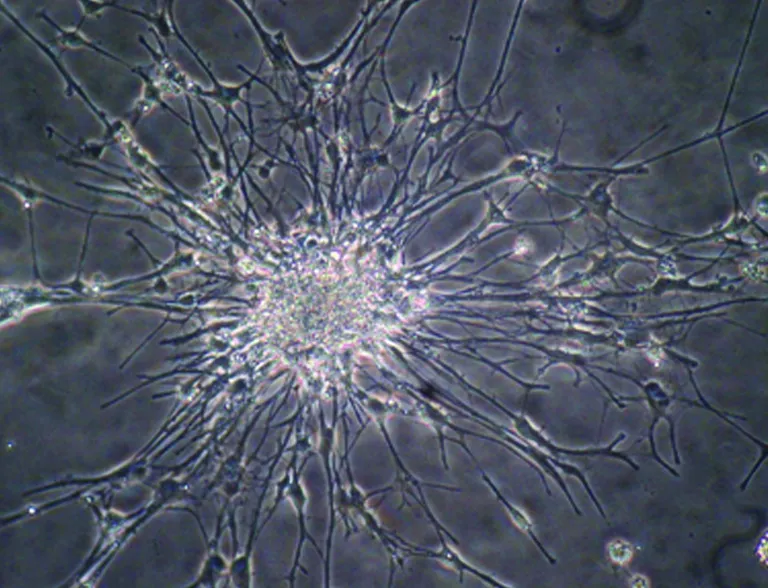
图4 50 μg/ml SMN诱导突起形成(×200)

图5 细胞突起βⅢ-tubulin表达(SP×400)

注:SMN 20 μg/ml与SMN 10 μg/ml相比(***P<0.001)SMN 50 μg/ml与SMN 10 μg/ml相比(***P<0.001);SMN 50 μg/ml与SMN 20 μg/ml相比(*P<0.05)
图6 丹参注射液诱细胞导突触形成
2.3 丹参注射液对β微管蛋白Ⅲ表达的诱导 β微管蛋白Ⅲ(βⅢ-tubulin) 为神经元骨架(微管)蛋白重要的组成成分,在突起和细胞体均有表达。图7示SMN (30 μg/ml) 作用72 h后,βⅢ-tubulin的表达明显上升,神经生长因子NGF对照组*P<0.05。SMN与NGF相比没有明显差异(P>0.05)。
2.4 丹参注射液对ERK 磷酸化的影响 图8示30 μg/ml SMN作用下,ERK 磷酸化水平显著升高(*P<0.01)。
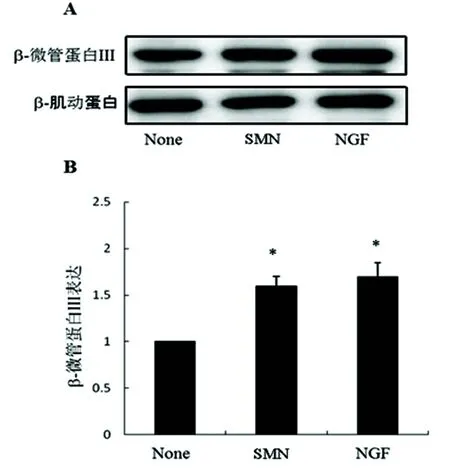
注:SMN 30 μg/ml与空白对照组相比(P<0.05);神经生长因子NGF与空白对照组相比(P<0.05)
图7 β微管蛋白Ⅲ表达

注:SMN组与空白对照组相比分别为5 min(**P<0.01),15 min(*P<0.05),30 min(*P<0.05)
图8 SMN对ERK 磷酸化的作用
3 讨 论
神经退行性疾病治疗思路中,诱导神经干细胞再生增殖,通过突起生成,重新建立突触连接,发挥神经传导功能是非常关键的过程。神经元的退行性疾病的解决方法包括植入其他部位的干细胞,如骨髓间充质干细胞,然后进行诱导分化形成功能性连接,也可以通过激活神经干细胞或者神经元前体细胞(常用来源稳定的P12细胞),这个过程中细胞因子通过信号转导过程,促进干细胞突起发出并且形成功能性突触是最为关键的过程[5~8]。所以不同的诱导物质作用与不同的信号通路,启动了突起形成的基因表达过程。目前研究表明神经营养因子NGF、二十二碳戊烯酸(DPA)、DHA等具有促进神经前体细胞的成熟和发育,营养脑神经等作用,在促进突触形成中发挥一定作用[9~12]。我们试图通过实验来寻找另一种类似以上细胞因子或者诱导物质并且继续深入探索其涉及到的信号转导途径。相关研究证实丹参注射液具有抗大脑萎缩、改善老年人的记忆力及脊髓损伤的修复等方面提供较大的帮助[13~16]。因此我们选择丹参注射液来研究对神经干细胞分化过程中对突起形成的的作用,继而探索相关的信号转导通路,进一步阐明其作用机制。
神经元骨架蛋白βⅢ-tubulin是构成细胞骨架结构微管的主要组成成分,参与了突起形成过程以及突起的延伸,对突触形成也具有重要意义,是衡量突起形成的重要标志[17]。在神经前体细胞分化的过程中,神经突起的形成对于神经再生和功能重建具有决定性的作用,这些过程需要一系列信号蛋白的转导途径来引导[18~20]。ERK作用底物蛋白分子内丝氨酸/苏氨酸残基发生磷酸化的蛋白酶,在调节神经细胞增殖、分化、凋亡等过程重发挥关键作用。丝裂原活化蛋白激酶(MAPK)家族包含众多的信号蛋白,近年来研究较多的是ERK,它作为信号转导蛋白之一,通过信号途径向上调节转录因子的表达,产生细胞内效应。ERK1和ERK2这两条途径可以被病毒、生长因子、细胞因子以及G蛋白偶联受体的配体等刺激因子激活后启动细胞增殖、生长和分化过程[21]。通过原代培养的神经干细胞增殖能力检测、细胞分化能力检测和神经干细胞标志蛋白巢蛋白nestin的检测后,不同浓度的丹参注射液进行诱导神经干细胞,神经干细胞分化细胞神经突起/突触形成率随着浓度增加而增加;免疫印迹显示分化细胞中神经元骨架蛋白βⅢ-tubulin的表达明显升高,进一步证实丹参注射液可促进分化细胞的ERK磷酸化水平。研究结果证明了丹参注射液对神经突起已经突触形成的诱导作用,其作用机制可能与上调ERK磷酸化水平有关。
——水芹主要害虫识别与为害症状

