转录调控因子BglR对东方肉座菌纤维素酶表达的影响
刘富川,薛 勇,刘 健,甘礼惠,龙敏南
(厦门大学能源学院,福建 厦门 361102)
天然纤维素是自然界储量最丰富的可再生生物质,是生物质燃料的主要原料.纤维素的多种加工利用过程依赖于微生物,尤其是丝状真菌,其在降解生物质过程中形成了一种高效、复杂的机制用来分泌一组水解酶,对纤维素降解起主要作用[1].然而,目前高效分泌纤维素酶和半纤维素酶的丝状真菌仅有少数,如里氏木霉(Trichodermareesei)等被开发应用[2].
转录调控因子在丝状真菌的纤维素酶表达调控过程中起关键作用.木聚糖基因调控因子xlnR是第一个被鉴定的转录因子[3],也是纤维素利用过程中的重要调控因子,其同源序列存在于多数丝状真菌中.在里氏木霉中,Xyr1可调控纤维素酶基因和半纤维素酶基因的转录[4].对黑曲霉(Aspergillusniger)和粗糙脉孢菌(Neurosporacrassa)中的CREA/1进行敲除[5],可有效抑制碳源代谢阻遏,提高其纤维素酶基因和半纤维素酶基因在非诱导表达条件下的表达.另一个调控因子ACE1在里氏木霉和康氏木霉(T.koningii)中作为负调控因子,在槐糖和纤维素的诱导下,里氏木霉ACE1敲除菌株的主要纤维素酶基因和半纤维素酶基因表达量均有所提高[6].
东方肉座菌(T.orientalis) EU7-22是由本实验室经诱变、筛选获得的木霉属(Trichoderma)真菌,其不仅具有完整的纤维素酶系,而且与其他丝状真菌相比具有较高的产纤维素酶能力,是一株具有工业化潜力的菌株,对其转录调控因子进行研究具有重要意义.锌指蛋白BglR是利用单核苷酸多态性检测技术发现的特异性调控β-葡萄糖苷酶基因表达的转录因子[7].在里氏木霉中bglr基因的缺失可使其纤维素酶活力在碳源纤维二糖诱导下提高[7],且其同源蛋白COL-26在粗糙脉孢菌的生物碳氮平衡中起调控作用[8].因此,本研究克隆获得东方肉座菌的BglR缺失菌株,并对其产纤维素酶活力、蛋白分泌量和相关产酶基因的表达量进行分析,探究bglr基因在东方肉座菌中的功能,以期为进一步构建高效降解纤维素的工业菌株提供理论参考.
1 材料和方法
1.1 材 料
1.1.1 菌株和质粒
东方肉座菌EU7-22菌株为本实验室分离筛选获得,大肠杆菌(Escherichiacoli) DH5α菌株也为本实验室保存.pMD19-T载体质粒购自宝生物工程(大连)有限公司;pUR5750质粒为本实验室保存,它带有真菌筛选标记潮霉素抗性基因hph.
1.1.2 培养基
LB培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠 10 g/L,pH 7.2.MM液体培养基(种子培养基):葡萄糖20 g/L,硫酸铵5 g/L,磷酸二氢钾15 g/L,硫酸镁0.6 g/L,氯化钙0.6 g/L.PDA固体培养基:马铃薯(去皮,切块)200 g 煮沸30 min后纱布过滤,将滤液定容至1 L,葡萄糖20 g/L,琼脂20 g/L.产酶培养基(质量分数):微晶纤维素(PH101,优普惠,深圳)1%,小麦麸皮1%,蛋白胨0.5%,氯化钙0.05%,硫酸镁0.05%,磷酸二氢钾0.25%,吐温-80 0.4%(体积分数).上述化学药品和试剂均为分析纯,购自国药化学试剂有限公司.
1.2 方 法
1.2.1 东方肉座菌基因组DNA、RNA的提取及cDNA的合成
将东方肉座菌接种至MM液体培养基中,置于温度30 ℃、转速180 r/min的摇床上培养48 h,过滤,收集菌丝,液氮研磨,使用CTAB法[9]提取基因组DNA,-20 ℃保存.用RNAiso Plus试剂(TaKaRa,日本)提取RNA,使用PrimeScript®RT试剂盒(TaKaRa,日本)将RNA反转录为cDNA.RNA与cDNA均置于-80 ℃保存.
1.2.2 bglr基因及其上下游序列的克隆
在NCBI数据库(https:∥www.ncbi.nlm.nih.gov/)中将bglr基因与里氏木霉QM6a菌株(XM_006969261.1)、绿色木霉(T.virens)Gv29-8菌株(S. XM_014098216.1)和深绿木霉(T.atroviride)IMI 206040菌株(S. XM_014092063.1)的同源基因进行序列比对,选择保守区序列设计引物bglr-F和bglr-R,以东方肉座菌基因组DNA为模板进行PCR扩增;胶回收产物连接到pMD19-T载体上,并转入大肠杆菌DH5α感受态细胞,通过含有100 μg/mL氨苄青霉素的抗性LB平板筛选转化子;再利用通用引物M13对获得的阳性克隆子进行PCR检测和测序,将所得序列在NCBI数据库中进行比对验证.
对bglr基因上游未知序列进行克隆,简并引物设计参照Liu等[10]的方法,设计bglr基因上游序列巢式引物bglr-U1、bglr-U2、bglr-U3(表1),经3次PCR反应,对上游序列进行扩增,将所得产物进行回收转化,对阳性克隆子筛选后进行测序.根据测序结果,进而设计上游巢式引物bglr-U11、bglr-U22、bglr-U33(表1)以得到足够长的上游同源臂,并进行第2轮序列扩增,方法与上述步骤相同.交错式热不对称PCR(TAIL-PCR)简并引物SP1~4见表1.
借助bglr基因下游序列在NCBI数据库中的比对结果,根据其下游序列保守位点,设计下游简并引物bglr-DF1和bglr-DR1(表1),以东方肉座菌基因组DNA为模板进行PCR扩增,采用与上游同源臂相同的方法进行测序,得到东方肉座菌下游同源臂序列.
表1 本研究所用引物
Tab.1 Primers used in this study
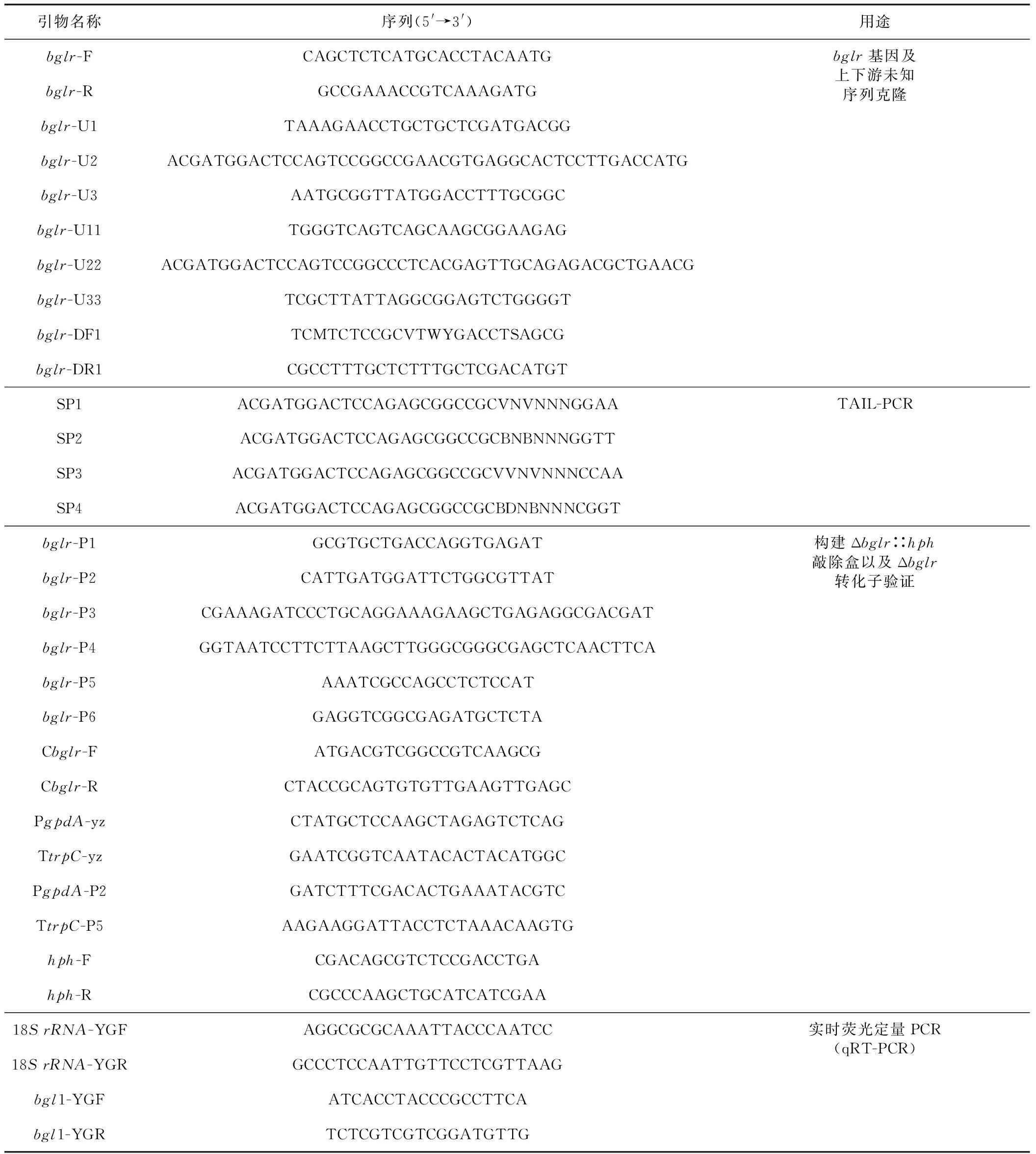
引物名称序列(5'→3')用途bglr-FCAGCTCTCATGCACCTACAATGbglr-RGCCGAAACCGTCAAAGATGbglr-U1TAAAGAACCTGCTGCTCGATGACGGbglr-U2ACGATGGACTCCAGTCCGGCCGAACGTGAGGCACTCCTTGACCATGbglr-U3AATGCGGTTATGGACCTTTGCGGCbglr-U11TGGGTCAGTCAGCAAGCGGAAGAGbglr-U22ACGATGGACTCCAGTCCGGCCCTCACGAGTTGCAGAGACGCTGAACGbglr-U33TCGCTTATTAGGCGGAGTCTGGGGTbglr-DF1TCMTCTCCGCVTWYGACCTSAGCGbglr-DR1CGCCTTTGCTCTTTGCTCGACATGTbglr基因及上下游未知序列克隆SP1ACGATGGACTCCAGAGCGGCCGCVNVNNNGGAASP2ACGATGGACTCCAGAGCGGCCGCBNBNNNGGTTSP3ACGATGGACTCCAGAGCGGCCGCVVNVNNNCCAASP4ACGATGGACTCCAGAGCGGCCGCBDNBNNNCGGTTAIL-PCRbglr-P1GCGTGCTGACCAGGTGAGATbglr-P2CATTGATGGATTCTGGCGTTATbglr-P3CGAAAGATCCCTGCAGGAAAGAAGCTGAGAGGCGACGATbglr-P4GGTAATCCTTCTTAAGCTTGGGCGGGCGAGCTCAACTTCAbglr-P5AAATCGCCAGCCTCTCCATbglr-P6GAGGTCGGCGAGATGCTCTACbglr-FATGACGTCGGCCGTCAAGCGCbglr-RCTACCGCAGTGTGTTGAAGTTGAGCPgpdA-yzCTATGCTCCAAGCTAGAGTCTCAGTtrpC-yzGAATCGGTCAATACACTACATGGCPgpdA-P2GATCTTTCGACACTGAAATACGTCTtrpC-P5AAGAAGGATTACCTCTAAACAAGTGhph-FCGACAGCGTCTCCGACCTGAhph-RCGCCCAAGCTGCATCATCGAA构建Δbglr∷hph敲除盒以及Δbglr转化子验证18S rRNA-YGFAGGCGCGCAAATTACCCAATCC18S rRNA-YGRGCCCTCCAATTGTTCCTCGTTAAGbgl1-YGFATCACCTACCCGCCTTCAbgl1-YGRTCTCGTCGTCGGATGTTG实时荧光定量PCR(qRT-PCR)
注:M=A/C,V=G/A/C,W=A/T,Y=C/T,S=G/C,B=G/T/C,D=G/A/T.
1.2.3 原生质体的制备和转化
东方肉座菌中原生质体的制备参照Szewczyk等[11]的方法,并适当优化.将所得转化子在潮霉素抗性平板上筛选,之后转接至PDA固体培养基上,37 ℃下培养5 d;在潮霉素抗性培养基上划线并得到单菌落,再转接至PDA固体培养基上,37 ℃下培养5 d后提取基因组DNA,-20 ℃保存.
1.2.4 Δbglr∷hph 敲除盒的构建
设计引物bglr-P1与bglr-P3、bglr-P4与bglr-P6(表1),以东方肉座菌基因组DNA为模板进行PCR扩增并通过1%(质量分数,下同)琼脂糖凝胶电泳切胶回收,分别得到bglr基因的上、下游序列产物.以pUR5750质粒为模板,利用引物PgpdA-P2与TtrpC-P5(表1)进行PCR扩增,琼脂糖凝胶电泳切胶回收后得到潮霉素抗性基因表达盒.利用引物bglr-P2与bglr-P5(表1),以3次PCR产物为模板进行融合PCR,琼脂糖凝胶电泳切胶回收后获得Δbglr∷hph敲除盒.
1.2.5 酶活力和蛋白含量测定
将菌株接种至PDA固体培养基上,30 ℃下培养5 d,将1.0 mL密度为107mL-1的孢子悬液接入50 mL种子培养基中,培养18 h,然后按照体积比1∶10接种至产酶培养基中,在温度30 ℃、转速180 r/min的摇床上培养,每隔24 h取样,6 000 r/min下离心10 min,收集上清酶液,测定酶活力[12-13].测定相关酶活力所用底物见表2,每分钟水解底物产生1 μmol还原糖或对硝基苯酚所需的酶量定义为1个酶活力单位(IU).用改良型Bradford法蛋白质浓度测定试剂盒(生工生物工程(上海)股份有限公司)测定酶液中的蛋白含量,方法参照试剂盒说明书.
表2 活力测定实验的酶以及所用底物
Tab.2 Enzymes and substrates for activity assays

酶底物滤纸酶定量滤纸,Whatmanβ-葡萄糖苷酶水杨苷,Sigma内切葡聚糖酶羧甲基纤维素钠,国药(分析纯)外切葡聚糖酶对硝基苯纤维二糖苷,Sigma木聚糖酶木聚糖,甘蔗渣提取
1.2.6 转化子菌落生长速度与表型分析
用ddH2O将孢子稀释至107mL-1,点接1 μL于以2%(质量分数,下同)葡萄糖、1%微晶纤维素、1%纤维二糖、2%羧甲基纤维素钠分别作为唯一碳源的固体培养基上,各3个平行平板.从培养36 h开始,每隔12 h测量菌落的直径,连续培养4 d后观察菌落生长表型.
1.2.7 qRT-PCR
分别取培养48和72 h后的发酵液,4 000 r/min离心5 min获得菌丝体,称取200 mg加入液氮研磨,用RNAiso Plus试剂从原始菌和Δbglr敲除菌中提取RNA,用PrimeScript®RT 试剂盒反转录获得cDNA,以18SrRNA基因为内参,采用嵌合染料SYBR Green Ⅰ进行qRT-PCR,分析目的基因的相对表达量[14],所用引物见表1.
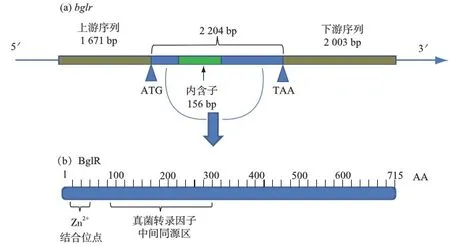
图1 基因bglr(a)及其编码蛋白BglR保守区(b)的示意图Fig.1 Sketch maps of bglr gene(a) and the conservative domain in BglR(b)
2 结果与分析
2.1 东方肉座菌bglr基因克隆及生物信息学分析
用DNAMAN软件将测序结果进行拼接,并在NCBI数据库中进行核酸序列比对,在东方肉座菌中得到了总长度为5 878 bp的基因序列,包括bglr基因编码序列2 204 bp(包含1个位于784~839 bp的内含子)、上游同源臂序列1 671 bp和下游同源臂序列2 003 bp;使用Primer Premier 5.0软件将其翻译为715个氨基酸残基的蛋白序列,并在NCBI数据库中进行蛋白序列比对,发现该蛋白属于Zn(Ⅱ)2C6型锌指蛋白(图1).将东方肉座菌bglr基因序列上传至GenBank数据库(登录号MG720023).
采用邻接(neighbor-jointing)法使用MEGA 6.0软件构建系统进化树,结果表明bglr基因在真菌中具有较高的同源性(图2),其中与里氏木酶的同源性为87%,与Isariafumosorosea的同源性为77%,与Purpureocilliumlilacinum的同源性为69%.转录调控因子在丝状真菌产纤维素酶过程中起关键作用,但仅有少数调控因子(如碳阻遏代谢调控因子Cre1/A)的保守序列存在于整个真菌家族中,而大多数仅限于真菌种类的亚群[1].转录调控因子BglR在真菌中广泛存在,但BglR在不同菌株中表现出的功能也不同,例如在里氏木霉中正向调控β-葡萄糖苷酶活力[7],而在斜卧青霉(Penicilliumdecumbens)中则对该酶活力起负调控作用[15].
2.2 Δbglr敲除盒的构建与转化子验证
以东方肉座菌基因组DNA为模板用引物bglr-P1与bglr-P3克隆得到大小为2 069 bp的上游同源臂,用bglr-P4与bglr-P6得到大小为1 994 bp的下游同源臂;进而用引物bglr-P2与bglr-P5,以上、下游同源臂片段和潮霉素表达盒为模板进行融合PCR,得到大小为8 047 bp的Δbglr∷hph敲除盒(图3).
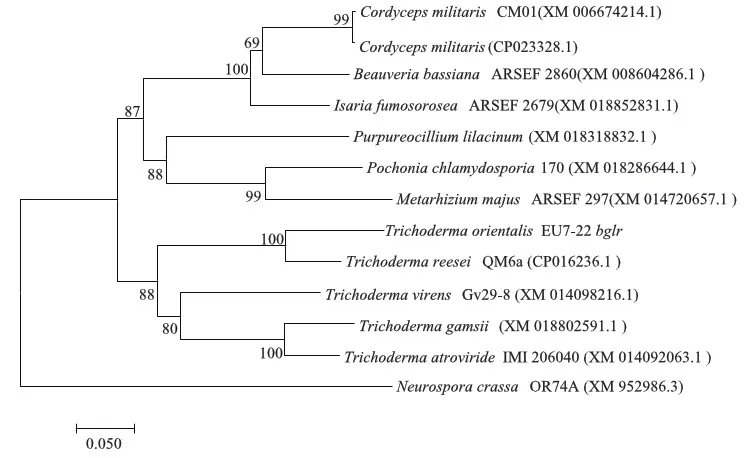
图2 东方肉座菌bglr基因的系统进化树分析Fig.2 Phylogenetic tree analysis of the bglr gene in T. orientalis
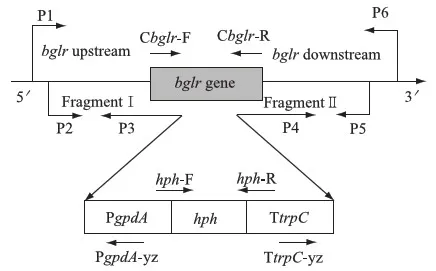
图3 Δbglr∷hph敲除盒构建及转化子PCR验证引物示意图Fig.3 Schematic map of constructing Δbglr∷hph deletion cassette and primers for PCR identification of the Δbglr transformant
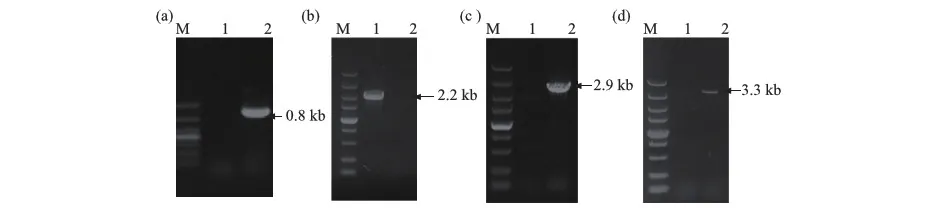
(a) 验证bglr基因序列;(b) 验证hph基因序列;(c) Δbglr∷hph 敲除盒上游定位;(d) Δbglr∷hph 敲除盒下游定位.M.DNA分子质量标准,(a)中为1 000 bp,(b)~(d)中为5 000 bp;1.EU7-22原始菌;2.Δbglr转化子.图4 Δbglr转化子PCR产物的琼脂糖凝胶电泳验证Fig.4 PCR products verification of the Δbglr transformant by agarose gel electrophoresis
将潮霉素抗性平板筛选得到的转化子分别以原始菌EU7-22和转化子Δbglr的基因组DNA作为模板,用引物hph-F与hph-R进行PCR,在转化子Δbglr中检测到大小约为811 bp的潮霉素抗性基因片段,而EU7-22中并无条带出现,证明敲除盒成功转入(图4(a)).用引物Cbglr-F和Cbglr-R对转化子bglr基因进行扩增验证,结果如图4(b)所示,在原始菌EU7-22中,扩增出bglr基因条带(长度2 204 bp),而转化子Δbglr中相同位置未出现该条带,说明bglr基因在转化子中成功敲除.用引物bglr-P1与PgpdA-yz进行PCR扩增定位,结果如图4(c)所示,在转化子Δbglr中扩增出长度为2 933 bp的条带,在原始菌EU7-22中相同条件下相同位置没有出现相应的条带,可见敲除盒在bglr基因上游区域发生了同源重组.类似地,用引物bglr-P6与TtrpC-yz进行PCR扩增定位,结果如图4(d)所示,在转化子Δbglr中扩增出长度为3 316 bp的条带,而原始菌EU7-22中未出现相同条带,说明敲除盒在bglr基因下游区域插入位点正确.经验证,敲除盒成功导入到转化子Δbglr并且产生了双同源交换,即得Δbglr突变菌.
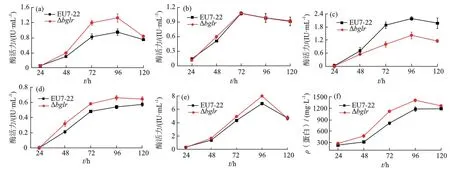
(a) 滤纸酶活力;(b) 内切葡聚糖酶活力;(c) β-葡萄糖苷酶活力;(d) 外切葡聚糖酶活力;(e) 木聚糖酶活力;(f) 蛋白含量.图5 东方肉座菌EU7-22和Δbglr突变菌的酶活力与蛋白含量Fig.5 Enzyme activities and protein concentrations in T. orientalis EU7-22 and the Δbglr mutant
2.3 Δbglr突变菌产酶和蛋白含量的变化
以1%微晶纤维素和1%麸皮作为产酶培养基的诱导物,分别培养原始菌EU7-22和突变菌Δbglr,每隔24 h取发酵液测定酶活力和蛋白含量,共培养5 d,每个时间点取3个平行样.如图5所示,突变菌Δbglr的滤纸酶、外切葡聚糖酶、木聚糖酶活力及蛋白含量的最高值分别升高39%,22%,16%和20%,β-葡萄糖苷酶活力下降47%,而内切酶活力无明显变化.这表明BglR对东方肉座菌的β-葡萄糖苷酶活力起正调控作用,使水解产物减少,减小了代谢系统中葡萄糖的反馈抑制作用,进而使其他酶的活力升高.

图6 qRT-PCR分析bgl1基因表达量Fig.6 qRT-PCR analysis of the bgl1 gene expression
2.4 β-葡萄糖苷酶基因表达的qRT-PCR分析
在1%微晶纤维素和1%麸皮的诱导下,利用qRT-PCR分析原始菌EU7-22与突变菌Δbglr中主要β-葡萄糖苷酶基因bgl1的表达量,以内参基因18SrRNA校正,结果显示原始菌发酵培养48和72 h后的表达量分别为突变菌的6.89倍和10.41倍(图6).该结果与突变菌的β-葡萄糖苷酶活力较原始菌降低(图5(c))相吻合,说明BglR对东方肉座菌bgl1基因的表达起正调控作用.
2.5 发酵液pH值变化分析
对菌株EU7-22和Δbglr在不同时间段发酵液的pH值进行测定,结果如图7所示,两菌株的发酵液pH值变化曲线差异明显:原始菌EU7-22发酵液的pH值在24 h时下降到最低值4.6,后随发酵时间增加而逐渐升高,在120 h时达到6.6;而突变菌Δbglr发酵液的pH值先升高,然后快速降低,在72 h时达到最低值4.7,后随发酵时间逐渐升高,在120 h时与原始菌EU7-22发酵液趋近一致.由此可见BglR的缺失对东方肉座菌发酵过程中的pH环境产生了影响,推测与其有机酸代谢变化相关.
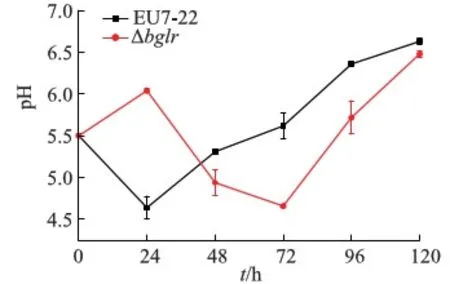
图7 东方肉座菌EU7-22与Δbglr突变菌发酵液的pH值变化Fig.7 The supernatant pH value changes of T. orientalis EU7-22 and the Δbglr mutant
2.6 菌落生长速率测定和表型分析
研究转录调控因子BglR的缺失对菌落生长的影响,分别以2%葡萄糖、1%纤维二糖、1%微晶纤维素、2%羧甲基纤维素钠作为碳源,培养4 d后对其表型进行观察,结果如图8所示,在4种培养基上突变菌Δbglr产孢子量均明显少于原始菌EU7-22.进而测定并比较在相同碳源平板上生长的两菌株的菌落直径生长速率,结果如图9所示,突变菌Δbglr的菌落直径生长速率均小于原始菌EU7-22.以上数据表明,BglR的缺失对东方肉座菌的生长产生了明显影响.由于微晶纤维素无法溶解,在培养基中分散不够均匀,难以直接测量菌落直径,因此未给出定量数据.

图8 东方肉座菌 EU7-22 与 Δbglr 突变菌在不同碳源平板上的产孢子分析Fig.8 Analysis on spores production of T. orientalis EU7-22 and the Δbglr mutant with different carbon resources
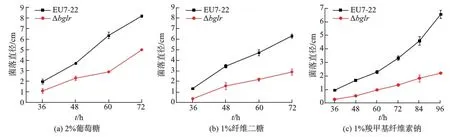
图9 东方肉座菌EU7-22与Δbglr突变菌在不同碳源平板上的菌落生长速率Fig.9 The colony growth rates of T. orientalis EU7-22 and the Δbglr mutant on different carbon resource plates
3 讨 论
为研究BglR对东方肉座菌产酶特性的影响,根据在GenBank中比对的丝状真菌bglr基因的保守序列设计简并引物,得到了东方肉座菌bglr基因的部分序列;进而通过TAIL-PCR对bglr基因上、下游未知序列进行扩增,克隆出包括上、下游同源臂在内的bglr基因序列.通过同源重组双交换方式得到了BglR缺失突变菌株Δbglr,并验证了调控因子BglR的缺失对产酶活力和蛋白分泌量的影响,以及不同碳源对菌株生长的影响.
纤维素酶活力测定结果表明,bglr基因的缺失可使东方肉座菌的滤纸酶、外切葡聚糖酶、木聚糖酶活力和蛋白含量上升,而使β-葡萄糖苷酶活力下降.对β-葡萄糖苷酶编码基因bgl1表达水平的检测结果表明,突变菌Δbglr中的表达量较原始菌显著降低.此外,BglR的缺失对东方肉座菌在不同碳源培养基上的生长均造成了影响.β-葡萄糖苷酶属糖苷水解酶,在碳阻遏代谢过程中对纤维素的水解起关键作用,是纤维素水解过程中的限速酶.在纤维素水解过程中,先由内切葡聚糖酶与外切葡聚糖酶协同产生纤维二糖,而后纤维二糖被β-葡萄糖苷酶彻底水解成葡萄糖[16].微生物在生长代谢过程中会优先利用环境中葡萄糖,当葡萄糖的量降低时,纤维素酶的生产得到激发,从而实现对纤维素的降解.因此,本研究通过对突变菌Δbglr的酶活力进行分析,发现BglR在东方肉座菌中正调控β-葡萄糖苷酶.由于BglR的缺失,阻碍了菌株利用纤维素/纤维二糖等碳源的生长,进一步证明了转录调控因子BglR作为一个主要的潜在产糖信号,调控碳阻遏代谢循环.滤纸酶活力代表纤维素酶的3种酶组分协同作用后的总酶活[17],均相水溶性纤维素的水解速度高于非均相不溶性纤维素,其水解底物又依赖于不溶性纤维素的水解产物,因此不溶性纤维素水解是影响滤纸酶活力的限速步骤[18].本研究中BglR的缺失导致东方肉座菌β-葡萄糖苷酶活力降低,从而使诱导物纤维寡糖含量相对升高,继而造成降解不溶性纤维素的外切葡聚糖酶活力升高,导致滤纸酶活力的增加.诱导物的增加也促使了木聚糖酶表达量增加,同时胞外蛋白量的增加,侧面验证了胞外酶量的增加.
本实验室前期已对相关产酶基因的功能进行了研究和鉴定[19-22],目前东方肉座菌的全基因组测序工作正在进行中.本研究揭示了东方肉座菌中BglR调控纤维菌酶生产相关的功能,对进一步完善其纤维素酶基因的表达调控机制奠定了基础,为利用分子生物学方法构建新的高效产纤维素酶工业菌株提供了参考.

