家蚕非编码RNA Bm-152功能初探
刘 晓,邱妩洁,李新梅,阚云超,李丹丹
(南阳师范学院 河南省伏牛山昆虫生物学重点实验室, 河南 南阳 473061)
0 引言
非编码RNA (non-coding RNA,ncRNA) 是指一类不能编码蛋白质但能够行使功能的RNA的总称.依据其成熟体的序列长度可分为3大类:小于50 nt的ncRNA,包括 microRNA ( miRNA)、small interference RNA( siRNA)、piwi interacting RNA (piRNA)等;中等长度的ncRNA,包括snRNA、snoRNA等;大于500 nt的ncRNA,如long non-coding RNA (lncRNA)等[1].目前对家蚕miRNA的研究较多,在miRbase数据库中公布的家蚕成熟miRNA共563条[2-9],对其功能的研究也在逐步加深.如miRNA-965 和miRNA-1926靶基因是家蚕丝素重链基因Fib-H,在个体中过表达miRNA-965 和miRNA-1926会导致Fib-H表达水平下调[10].在家蚕5龄3天幼虫后部丝腺高表达bmo-miR-0001和bmo-miR-0015,能抑制家蚕丝素蛋白轻链基因Fib-L的表达[11].在家蚕个体中干涉let-7表达,可上调蜕皮激素信号通路基因E74、FTZ-F1表达,从而导致家蚕变态发育停滞[12].而MicroRNA281能抑制蜕皮激素受体BmEcR-B的表达,从而参与家蚕发育调控[13].在长链非编码RNA研究方面,WU等[14]从家蚕18个RNA-seq数据库中获得的11810个新的lncRNA.ZHOU等[15]比较了野生蚕和家蚕丝腺中的lncRNA,发现3个lncRNA的表达量在家蚕和野生蚕之间存在显著差异,表明它们可能会通过转录后调控影响蚕丝产量.
目前,虽然在家蚕非编码RNA方面开展了较多的工作,但是对家蚕中等长度ncRNA功能的解析还较少[16,17-19].越来越多的研究表明,中等长度的RNA如snoRNA,除了能够指导rRNA和tRNA的2’-O-核糖的甲基化和假尿嘧啶化修饰外,具有更多新的功能[20,21].例如,在人和小鼠脑中特异性表达的SNORD115 (H/MBII-52) 和SNORD116 (H/MBII-85),可调控5-羟色胺受体5-HT2cR基因的选择性剪接和RNA编辑,它们的缺失可能是形成Prader-Willi综合症的主要诱因[22-25].同时,snoRNA的表达水平可以影响细胞、组织和器官的生理状况,从而导致多种疾病的发生[28].如与正常未迁移人类乳腺细胞MCF-10A相比,乳腺癌细胞系ZR-75-1中boxC/D snoRNAs(U22, U3, U8, U94, U97)表达水平明显升高[27].box H/ACA snoRNA42在非小细胞肺癌(NSCLC)中出现过表达现象,已被鉴定为肺癌的致癌基因[28].Wu等研究发现核仁小分子RNA 中ACA11能通过激活PI3K/AKT信号通路来促进肝细胞癌的细胞增殖、迁移和侵袭,从而增加细胞周期蛋白D1(cyclinD1)的表达并诱导发生上皮细胞-间充质转化(Epithelial-Mesenchymal Transition,EMT),因此ACA11将可能选为生物治疗靶标[29].另外,Angrisani等发现参与果蝇发育调控中的snoRNA表达呈现出不一致的现象[30].
在前期研究中发现一个丝腺高表达的ncRNA Bm-152,其在细胞核、质中均有分布.同时Bm-152可结合在snoRNA protein complex (snoRNP)中[16,31].为了进一步探索Bm-152的功能,利用荧光定量PCR技术检测Bm-152在家蚕5龄幼虫及预蛹期丝腺不同发育天数的表达变化.同时丝腺的发育离不开激素信号通路的调控,为了进一步研究是否通过蜕皮激素或保幼激素信号通路参与家蚕发育调控,我们在家蚕5龄幼虫血淋巴中注射piggyBac [A3-EGFP-A3-Bm-152] 过表达载体,检测Bm-152、蜕皮激素和保幼激素信号通路基因Usp、E75A、Met表达量的变化,为进一步探索家蚕ncRNA Bm-152功能提供理论依据.
1 材料与方法
1.1 材料与主要试剂
家蚕品系为大造P50,由中国农业科学院蚕业研究所李木旺研究员惠赠.
Trizol RNA提取试剂(Invitrogen),Premix Extaq酶(Takara),FastDigest内切酶(Fermentas),DNA胶回收试剂盒(Axygen),T4连接酶(Fermentas),cDNA 反转录试剂盒(TaKaRa),FastStart Universal SYBR Green荧光定量PCR试剂(Roche).
1.2 方法
1.2.1 家蚕饲养及取样方法
饲养温度25 ℃,相对湿度60%,光周期12L:12D,用新鲜桑叶饲养.从家蚕5龄第1天至预蛹期第1天(家蚕5龄共7天,吐丝期3天,预蛹期1天),每天取丝腺组织,速冻于液氮中.
1.2.2 载体构建
利用昆虫多基因表达载体pFBDM(由Richmond教授惠赠)[16]作为中间载体构建Bm-152过表达载体.首先利用Trizol法提取家蚕丝腺总RNA,Ramdom引物反转录为 cDNA,利用ExTaq酶PCR 扩增Bm-152.以伏牛山昆虫生物学重点实验室保存的piggyBac[A3-EGFP]载体为模板,扩增actinA3启动子.BmHI、NcoI双酶切actinA3启动子,连接在pFBDM载体上,获得pFBDM[A3]载体.NcoI、KpnI双酶切Bm-152 PCR产物,连接在pFBDM[A3]上,获得pFBDM[A3-Bm-152]载体.BamHI、BglII双酶切pFBDM[A3-Bm-152]载体,BglII双酶切piggyBac[A3-EGFP],连接获得piggyBac[A3-EGFP-A3-Bm-152]过表达载体.阴性对照为实验室之前构建成功的piggyBac[A3-EGFP-A3-mecherry]载体(构建方法同piggyBac[A3-EGFP-A3-Bm-152]过表达载体).
1.2.3 个体注射
利用脂质体携带载体的方法注射5龄3天幼虫血淋巴,分别注射2 μg piggyBac[A3-EGFP-A3-mcherry]载体和2 μg piggyBac[A3-EGFP-A3-Bm-152]过表达载体,各注射6头家蚕,2头为一组,生物学重复3个.注射后48 h解剖幼虫,分丝腺和非丝腺组织,速冻于液氮中.空白对照为5龄3天正常培养48 h后的家蚕.
1.2.4 实时荧光定量PCR
Trizol法提取总RNA.取不同组织的总RNA各2 μg,使用PrimeScriptTMII 1st Strand cDNA Synthesis Kit(TaKaRa)合成cDNA.利用表1引物进行PCR扩增(FastStart Universal SYBR Green,Roche).PCR 反应条件为:95 ℃ 变性30 s;55 ℃ 退火30 s,72 ℃ 延伸30 s,40个循环.U6和actinA3为内参基因.PCR结果采用2-△△Ct法计算相对表达量(其中,Ct为循环阈值,表示每一个反应管内的产物荧光强度首次超过设定的阈值时所需的循环数;△Ct=目的基因的Ct平均值-内参基因的Ct平均值,△△Ct为两个样本的△Ct之间的差值).

表1 基因的PCR扩增引物Tab. 1 Primer sequences of genes
注:表中的下划线“_”代表限制性酶切位点 .
2 结果
2.1 Bm-152在家蚕丝腺中的表达谱
为了获得Bm-152在家蚕丝腺中的表达情况,我们选取5龄第1天到预蛹期共11天的家蚕丝腺为研究对象,提取总RNA,Random引物反转为cDNA,实时荧光定量PCR检测Bm-152在家蚕不同发育时期丝腺中的表达量.结果如图1所示,Bm-152在家蚕5龄幼虫丝腺发育过程中无明显的变化规律,但在吐丝第1天表达量较高,随后表达量又下调.
2.2 Bm-152过表达载体构建结果
将前期扩增的actinA3启动子和Bm-152双酶切后,依次连接在pFBDM载体上,构建出重组载体pFBDM[A3-Bm-152].双酶切结果如图2所示,经NcoI、KpnI双酶切获得Bm-152,位置在135 bp左右(第3泳道).经BmHI、NcoI双酶切,获得actinA3启动子,大小为820 bp(第4泳道),酶切结果显示目的条带单一,位置正确.将pFBDM[A3-Bm-152]经BamHI和BglII双酶切后的片段连接在piggyBac[A3-EGFP]上,获得piggyBac[A3-EGFP-A3-Bm-152]过表达载体,测序表明重组载体构建成功.

图1 Bm-152在家蚕丝腺中的表达情况Fig. 1 Expression profiles of Bm-152 in the silk gland of Bombyx mori
注:1-7为5龄第1天到第7天,8-10为吐丝期,11为预蛹期第1天

图2 pFBDM[A3-Bm-152]双酶切产物电泳分析Fig. 2 Electrophoresis analysis of enzyme digestion products of pFBDM[A3-Bm-152]
注:Marker为DL2000;1为原始重组载体,2为NcoI、KpnI双酶切产物,3为BmHI、NcoI双酶切产物,4为BmHI、KpnI双酶切产物
2.3 个体注射实验结果
2.3.1 Bm-152基因在家蚕非丝腺组织和丝腺中表达变化
为了进一步探索Bm-152的功能,将构建好的piggyBac [A3-EGFP-A3-Bm-152]过表达载体和piggyBac [A3-EGFP-A3-mCherry]载体注射家蚕5龄第3天幼虫血淋巴,注射量为2 μg,48 h取样检测Bm-152的表达变化.结果如图3所示,注射后Bm-152在非丝腺组织实现明显过表达,但在丝腺中无明显变化,表明actinA3启动子在丝腺中过表达效果不明显.

图3 Bm-152在家蚕非丝腺和丝腺中的表达变化Fig. 3 Changes of Bm-152 in the non-silk gland and slik glandof Bombyx mori
注:*表示差异显著(P<0. 05),**表示差异极显著(P<0. 01)
2.3.2 E75A、USP和 Met在家蚕非丝腺组织中的表达变化
为了进一步探索Bm-152可能参与的信号途径,选择与家蚕变态发育相关性最强的蜕皮激素和保幼激素信号通路基因为研究对象,进一步探索Bm-152是否参与激素调控的家蚕变态发育.结果发现,在注射2 μg piggyBac [A3-EGFP-A3-Bm-152]过表达载体后,蜕皮激素受体复合物EcR-USP中Usp基因的表达量变化明显,上调1.95倍,蜕皮激素信号通路下游E75A基因的表达量变化显著,上调2.26倍.对保幼激素信号通路基因Met而言,在注射2 μg piggyBac [A3-EGFP-A3-Bm-152]过表达载体后,其表达量变化明显,上调1.79倍(图4).
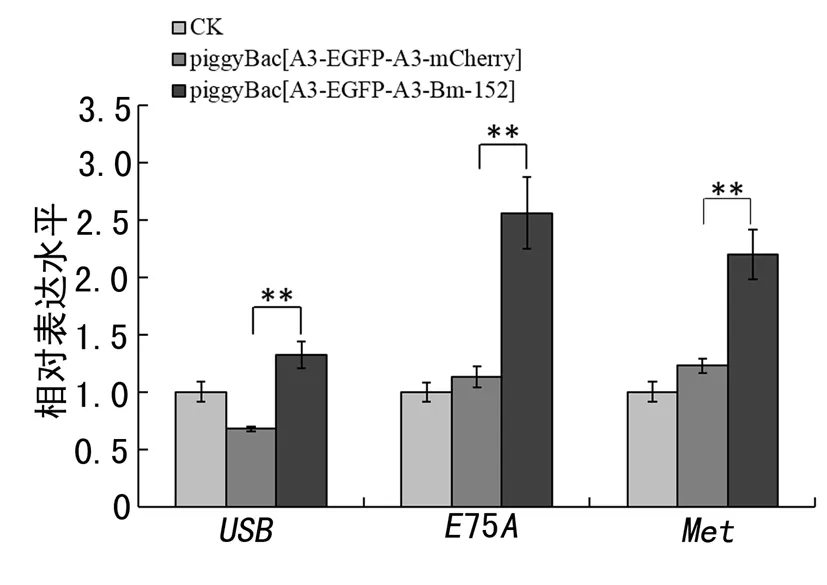
图4 转染piggyBac [A3-EGFP-A3-Bm-152]过表达载体和piggyBac [A3-EGFP-A3-mCherry] 载体后USP、E75A和Met在家蚕非丝腺组织中的表达情况Fig. 4 Expression of USP、E75A and Met in the non-silk gland after transfection of piggyBac [A3-EGFP-A3-Bm-152] overexpression vector and piggyBac [A3-EGFP-A3-mCherry] vector
注:*表示差异显著(P<0. 05),**表示差异极显著(P<0. 01)
3 讨论
昆虫的变态发育主要是由保幼激素(Juvenile hormone,JH)和蜕皮激素(20-hydroxyecdysone hormone,20E)协同调控.(Methoprene tolerant,Met)作为JH的受体,可通过招募一些共激活因子与20E受体复合物EcR-USP结合来调控20E诱导的基因转录,从而在家蚕由幼虫到蛹期的变态发挥关键作用[32].最新研究表明,家蚕的E93蛋白中的两个HTH结构域能参与诱导20E的靶基因表达,从而使Bombyx E93在转录水平对蜕皮激素促进的家蚕变态发育发挥正调控作用[33].
本研究对丝腺高表达的ncRNA Bm-152在家蚕变态发育过程中的功能进行深入探索,发现Bm-152在吐丝第1天出现明显过表达,到预蛹期后表达量又下调,表明其可能在丝蛋白合成过程中发挥关键调控作用.同时为了进一步探索Bm-152可能的功能,我们检测了注射2 μg剂量piggyBac [A3-EGFP-A3-Bm-152]过表达载体后,家蚕非丝腺组织中蜕皮激素和保幼激素信号通路基因的表达变化.结果发现,蜕皮激素信号通路基因 Usp和E75A分别明显上调1.95倍和2.26倍,保幼激素信号通路基因Met也上调1.79倍.生物信息学预测发现Bm-152与Usp、E75A和Met无明显的序列互补区域,可能不是通过直接结合在激素信号通路基因的DNA序列上发挥作用.但在前期研究中我们也发现Bm-152作可结合在核蛋白复合体上[16,31],表明Bm-152可能通过与蛋白的互作参与蜕皮激素和保幼激素信号通路基因的表达调控.但是具体机制如何,是否直接作用在信号通路相关基因上还需进一步研究.
该结果为进一步探索Bm-152功能提供了方向,为研究ncRNA参与昆虫的变态发育调控提供更多可以借鉴的依据.

