浅谈浙江省新高考化学答题策略
袁文权
(浙江省温州市第二十二中学,浙江 温州)
不仅是高考化学,其他的考试中,答题的策略也是至关重要的,好的答题策略是建立在知己知彼和针对性训练之上的。
一、培养良好的答题习惯
化学试题由学考部分和加试部分组成,分值分别是70分和30分。学考部分难度相对较小,但地位举足轻重,学考部分答不好难以获得高分,因为加试部分难度大得多,想要在加试部分获得高分是很困难的。学考部分要做到少丢分甚至不丢分,但很多考生由于粗心大意在学考部分轻易失分,所以,良好的答题习惯是学考部分取得高分的法宝。
例1:(2017年4月浙江)设NA为阿伏加德罗常数的值,下列说法不正确的是 ( )
A.含0.2 mol H2SO4的浓硫酸和足量的镁反应,转移电子数大于0.2NA
B.25℃时,pH=3的醋酸溶液1 L,溶液中含H+的数目小于0.001NA
悦.任意条件下,1 mol苯中含悦-H键的数目一定为6NA
D.a mol R2+(R的核内中子数为N,质量数为A)的核外电子数为 a(A-N-2)NA
考生很容易审题不清,把悦选项中的悦-H键习惯性地以为是碳碳双键而错选悦。
二、知己知彼,合理取舍
高考化学的时间紧张,多数考生做不完题目。这就要求考生在答题时进行合理取舍,在有限的时间尽可能把能拿的分数都拿到。所谓的合理取舍主要是针对个别学考题和加试题中的某些小题,如复杂计算或者需要复杂计算的作图题以及同分异构体书写。
例2:(2017年11月浙江)Ⅰ.十氢萘是具有高储氢密度的氢能载体,经历“十氢萘(悦10H18)→四氢萘(悦10H12)→萘(悦10H8)”的脱氢过程释放氢气。已知:
悦10H18(l)⇌悦10H12(l)+3H2(g)ΔH1
悦10H12(l)⇌悦10H8(l)+2H2(g)ΔH2
ΔH1>ΔH2>0;悦10H18→悦10H12的活化能为 Ea1,悦10H12→悦10H8的活化能为Ea2,十氢萘的常压沸点为192℃:在192℃,液态十氢萘的脱氢反应的平衡转化率约为9%。请回答:
(1)有利于提高上述反应平衡转化率的条件是_______。A.高温高压 B.低温低压 悦.高温低压 D.低温高压
(2)研究表明,将适量十氢萘置于恒容密闭反应器中,升高温度带来高压,该条件下也可显著释氢,理由是_____________。
(3)温度335℃,在恒容密闭反应器中进行高压液态十氢萘(1.00 mol)催化脱氢实验,测得悦10H12和悦10H8的产率x1和x2(以物质的量分数计)随时间变化关系如图1所示。
①在8 h时,反应体系内氢气的量为_________mol(忽略副反应)。
②x1显著低于x2的原因是_______________________。
③在图 2 中绘制“悦10H18→悦10H12→悦10H8”的“能量~反应过程”示意图。
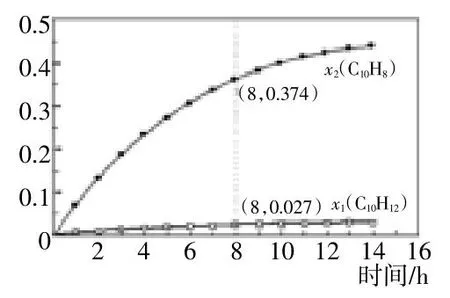
图1
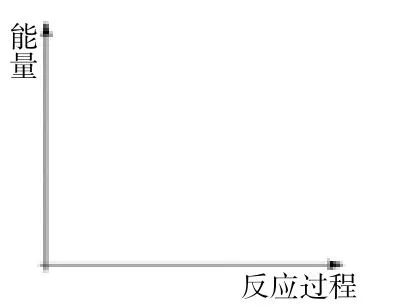
图2
Ⅱ.科学家发现,以H2O和N2为原料,熔融NaOH-KOH为电解质,纳米Fe2O3作催化剂,在250℃和常压下可实现电化学合成氨。
(4)阴极区发生的变化可视为按两步进行,请补充完整。
电极反应式:____________和2Fe+3H2O+N2=Fe2O3+2NH3。
本题(3)的难度相对较大,考生可以根据时间和个人情况处理,不必在此过多纠缠。
但(1)(4)则务必拿分,这样处理得分效率能大大提高。
三、意志顽强,坚韧不拔
高考试题中经常出现一些新题型,如24题由考查离子方程式书写及相关计算到考查化工流程。考生在遇到新题型时容易不知所措,方寸大乱,这就要求考生有充分的心里准备和顽强的意志,不能崩溃,坚信自己有困难,其他人也有困难。因为有些题目就是为勇敢者准备的。
例 3:(2017 浙江“五校联考”)
(4)图3中虚线为反应2NO(g)+O2(g)⇌2NO2(g)ΔH<0在使用催化剂条件下,起始O2、NO投料比和NO平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下,起始O2、NO投料比和NO平衡转化率的关系示意图。
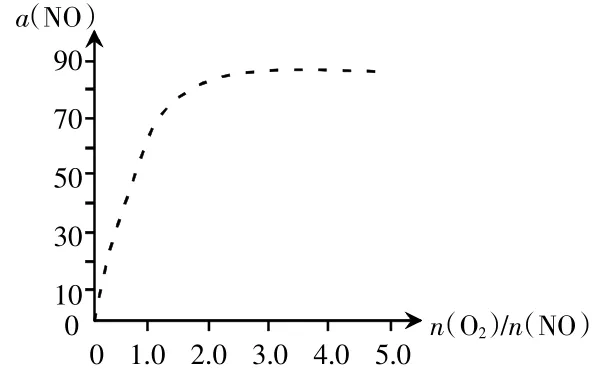
图3
考查知识点:催化剂只改变化学反应速率,而不改变平衡转化率。这知识点几乎所有考生都知道,然而在题目中出现时,很多考生不敢把自己的想法答出来,因为平时几乎没接触到画出来的图像和已知图像重合的情况,于是胆怯而放弃了。考生所缺的只是自信和勇气。考生应该意识到,画上去可能对可能不对,但不画上去肯定对不了。所以,顽强的意志和坚忍不拔的品质至关重要。
四、精打细算,把握节奏
多次的模拟练习和真题研究后,考生必须精确掌握每一道题所涉及的知识点以及难度,从而确定答题取舍和时间分配,形成自己的答题节奏。若高考中发现在自己正常的节奏时间里未完成预定的题目,切记过多纠缠而破坏自己整个答题节奏,影响大局。
综上所述,针对当前高考化学形势,考生很有必要掌握一些考试策略,在高考中扬长避短,发挥出自己的水平,取得理想成绩。

