蛹虫草固态发酵杜仲的工艺优化
徐丽丽,梁建东,柴宇航,陈万浩,田维毅,韩燕峰,梁宗琦,王 平
(1.贵阳中医学院基础医学院,贵州 贵阳 550002;2.贵州大学真菌资源研究所,贵州 贵阳 550025)
生物转化是利用微生物、动植物培养体系(包括真菌、细菌、植物离体细胞、组织或器官及动物细胞等)或其产生的酶系对外源性化合物进行修饰以获得新的衍生物的反应过程[1]。在此过程中,真菌因具有分解纤维素、淀粉、蛋白质、脂类等营养物质的胞内或胞外酶系,较强的分解利用能力,及种类繁多、次生代谢产物多等优点,因而成为主要的功能菌[2]。随着人们对健康需求的增加和形势发展,许多药材的传统应用方式已无法满足市场对这类中药资源的开发需求和多样化应用。提高药材的应用范围和层次,本着减毒、增效、拓展应用的目的,结合真菌与中药的生物转化技术应运而生,并逐步深入我国传统中药的研发中,如应用蛹虫草〔Cordyceps militaris (L.) Link〕固态发酵西洋参、人参根须等,发现其发酵前后人参皂苷的种类及含量均有较大差异,表明蛹虫草菌株所产生的酶系对传统中药具转化作用[3-4]。
杜仲(Eucommia ulmoides oliv)为冰川运动残留下来的杜仲科植物,主要以树皮入药,是贵州主要的道地药材之一。《中国药典》规定其树皮和叶均可入药,具备补肝肾、强筋骨、安胎等功效,用于肝虚肾弱、腰酸膝痛、痿软无力、胎动不安、妊娠漏血[5]。现代研究表明,杜仲的主要特征性成分为松脂醇二葡萄糖苷(pinoresinol diglucoside,PDG),具双向调节血压这一特有功能[6]。
通过前期蛹虫草固体发酵杜仲的单因素实验,选出最优单因素条件为:添料(杜仲粉)量10%、维生素E(Vitamin E,VE)4 g/kg,葡萄糖4 g/kg,硫酸铵4 g/kg,初始pH 8,接种量40%,最适温度25℃,培养时间15 d,并且发现在考察添料(杜仲粉)量、碳源、氮源、初始pH时,PDG和虫草素的含量同时降低,对于生长因子和接种量则表现为同时升高,而培养温度和培养时间是一升一降。本研究在这些前期实验基础上对蛹虫草固体发酵杜仲的培养基组成及发酵条件进一步优化,以期最大限度地提高发酵产物中有效成分PDG和虫草素的含量,为固体发酵产物的规模化生产提供参考,也将为发酵产物在药品和保健品等领域的应用发挥促进作用,服务于大健康产业。
1 材料与方法
1.1 试验材料
蛹虫草菌株C. militaris B1 528于2 015年2月分离自贵阳花溪农贸市场购买的蛹虫草人工子实体,使用甘油冻存管,-80℃保存于贵阳中医学院基础医学院真菌室。
平板培养基:常规PDA培养基。
液体种子培养基:土豆(20%),葡萄糖(2%),水(1 000 mL),pH值自然。
初始固体发酵培养基:杜仲粉(30%),大米(70%,自来水浸泡过夜),土豆汁(含20%土豆,0.2%),pH值自然,121℃灭菌45 min。
最终优选的固体发酵培养基:杜仲粉(27%),大米(73%,pH 8的自来水浸泡过夜),VE 4 g/kg、葡萄糖4 g/kg,硫酸铵8 g/kg,土豆汁(含20%土豆,0.2%,pH 8),121℃灭菌45 min。
主要仪器与试剂:HCB-1300V型垂直层流洁净工作台(青岛海尔特种电器有限公司),HZQ-QB培养摇床、SPX-150A生化培养箱(苏州威尔实验用品有限公司),安捷伦高效液相色谱仪1260,200T高速多功能粉碎机(永康市铂欧五金制品有限公司),PL303型精密电子天平(梅特勒-托利多仪器上海有限公司),港威超声(江苏省张家港市港威超声电子有限公司)。松脂醇二葡萄糖苷对照品(北京世记奥科生物技术有限公司,批号为63902-38-5C32H42016),虫草素对照品(中国食品药品检定研究所,批号为110858-201503),乙腈(色谱纯,美国天地),甲醇(色谱纯,天津科密欧化学试剂公司),氯仿(分析纯,西陇科学股份有限公司),娃哈哈纯净水,杜仲购于贵阳药材市场(经贵阳中医学院李玮教授鉴定为杜仲的干燥树皮)。
1.2 试验设计
1.2.1 平板培养 将蛹虫草B1 528转接于PDA培养基上,25℃黑暗条件下培养7 d。
1.2.2 种子培养 无菌条件下,用打孔器从平板中打取直径为5 mm的活化菌种并接入液体种子培养基中,于25℃、200 r/min黑暗条件下震荡培养5 d。
1.2.3 固体发酵培养 将40%液体菌种移接于初始固体培养基中,搅拌均匀,并于25℃恒温培养箱中培养15 d(优化后培养基培养18 d)。
1.3 检测方法
精密称取发酵产物4.0 g,加入40 mL氯仿液,超声30 min,弃去氯仿残液,挥干药渣,再加入40 mL甲醇,超声45 min,提取液过滤并浓缩至10 mL以下,移至10 mL量瓶中,用甲醇定容,摇匀,0.22 μm滤膜滤过,取续滤液,即得发酵产物提取液[7],采用高效液相色谱法(HPLC)进行测定。
色谱条件:色谱柱Agilent TC-C18(250 mm×4.6 mm,5 μm),柱温20℃,检测波长277 nm,流速1.0 mL/min,进样体积10 μL,流动相:水(A)-乙腈(B),梯度洗脱条件:0~10 min,95%~85.5%A;10~23 min,85.5%~85.4%A;23~33 min,85.4%~95%A。
1.4 Plackett-Burman实验
根据前期单因素实验结果,运用Design-Expert.V8.0.6软件的Plackett-Burman,选取实验次数N=12的实验设计,对发酵培养基组成及培养条件共8个因素进行考察,每个因素分别取高、低两个水平,同时另设3个虚拟变量以考察实验误差,发酵产物经HPLC法检测虫草素和PDG含量,作为PB实验的响应值,筛选显著因子。
1.5 最陡爬坡实验
响应面拟合方程只有临近考察领域内才能充分体现真实情况,因此采用最陡爬坡法逼近最佳值区域,建立有效的响应面拟合方程。以PB实验结果为依据,以实验值变化的方向为爬坡方向,结合各因素效应值大小的比例设定其变化步长,以坡度最高点作为后续实验的零点。
1.6 Box-Benhnken实验
根据最陡爬坡实验找到的中心点,利用Design-Expert响应面分析中的Box-Benhnken实验法进行三因素三水平的实验,取实验次数N=15,其中零点实验重复3次,以估计实验误差,进而得到优化条件及相应的理论值。
1.7 验证试验
对优化后的发酵条件进行平行验证实验,以检验实验数据与理论预测值是否相符,从而得到优化配方。
2 结果与分析
2.1 Plackett-Burman实验设计及显著因子确定
采用N=12的Plackett-Burman设计,对接种量(X1)、添料(杜仲粉)量(X2)、培养温度(X3)、培养时间(X4)、硫酸铵(X5)、初始pH(X6)、VE(X7)、葡萄糖(X8)8个因素进行考察,每个因素分别取高低两个水平,响应值为虫草素和PDG,实验设计及结果见表1。
方差分析结果(表2)表明,添料(杜仲粉)量、培养时间、硫酸铵这3个因素对应虫草素置信区间95%以上,PDG置信区间在95%以上的有接种量、添料(杜仲粉)量、培养温度、培养时间、硫酸铵5个因素。其中添料(杜仲粉)量、培养时间、硫酸铵等因素显著性最明显,是影响蛹虫草转化杜仲固体培养的重要因素,因此,把其他因素控制在较好水平上,选择添料(杜仲粉)量、培养时间、硫酸铵3个因素做进一步响应面实验。
2.2 爬坡实验
最陡爬坡法是以Plackett-Burman实验结果为基础,主要因素添料(杜仲粉)量(X2)、培养时间(X4)、硫酸铵(X5)均为正效应,爬坡方向应增加,根据其效应值大小的比例分别设定其爬坡步长,虫草素、PDG及综合评分为响应值。综合评分是以各成分的最大值为参照将数据进行归一化,再给出不同的权重,各成分权重系数均设为0.5,Y=(各样品中虫草素含量÷样品中虫草素最高含量)×0.5×100 +(各样品中PDG含量÷样品中PDG最高含量)×0.5×100[8]。由于杜仲浓度过高时菌种生长较弱或未见生长,因此采用添料(杜仲粉)量2%为其爬坡步长。实验设计及结果(表3)表明,实验3添料(杜仲粉)量(X2)20%、培养时间(X4)18 d、硫酸铵(X5)8.0 g/kg的综合评分达92.50分,为最优实验条件,因此是后续实验的中心点。

表1 Plackett-Burman实验设计与结果

表2 方差分析结果
2.3 Box-Benhnken实验及响应面分析
在爬坡实验结果的基础上,以添料(杜仲粉)量(X2)20%、培养时间(X4)18 d、硫酸铵(X5)8.0 g/kg为中心点,根据Box-Benhnken实验设计进行,实验设计及结果见表4、表5。
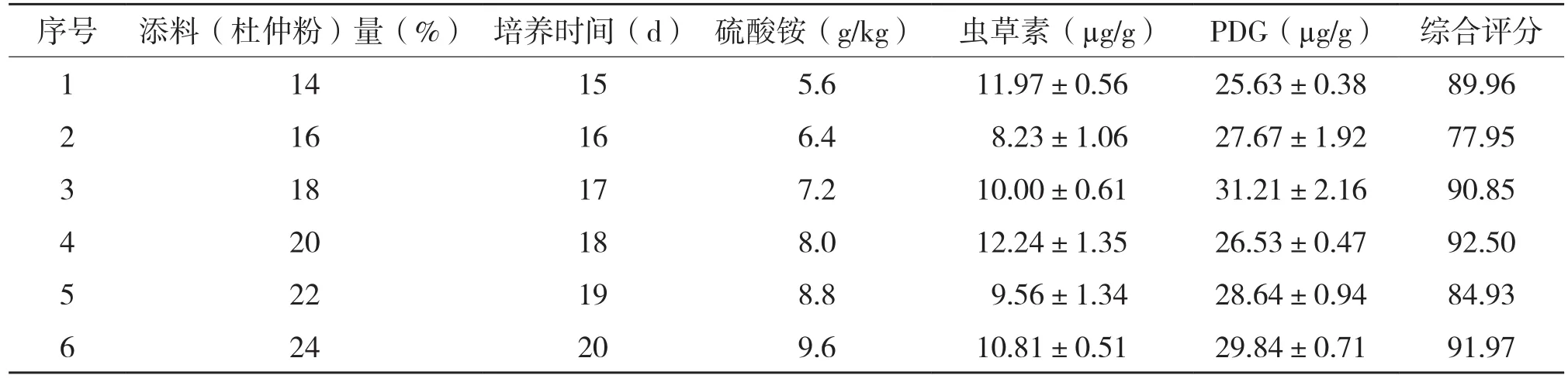
表3 最陡爬坡实验设计和结果

表4 Box-Behnken实验因素与水平

表5 Box-Behnken实验设计及结果
利用Design-Expert V8.0.6.1软件进行二次回归拟合,可得到拟合方程:

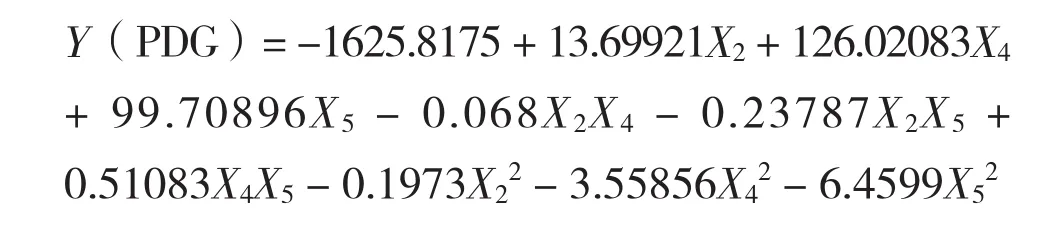
从方差分析结果(表6)可知,虫草素、PDG模型项P值<0.05,说明方程拟合很好;虫草素、PDG失拟项P值>0.05,说明该方程残差由随机误差引起。模型决定系数分别为R2=0.9920、0.9337,说明相关性良好,模型与实际情况拟合很好。
根据表5的实验结果作三维响应面图(图1、图2、图3),并对模型进行求导,对求导结果四舍五入取整数得添料(杜仲粉)量(X2)=27、培养时间(X4)=18、硫酸铵(X5)=8,结合前期单因素实验结果,得最优培养条件和培养基组成为:VE 4 g/kg,葡萄糖4 g/kg,硫酸铵8 g/kg,初始pH8,添料(杜仲粉)量27%,接种量40%,培养温度25℃,培养时间18 d,在此条件下虫草素和PDG的预测产量分别为2.93、89.00 μg/g。

表6 回归模型方差分析结果
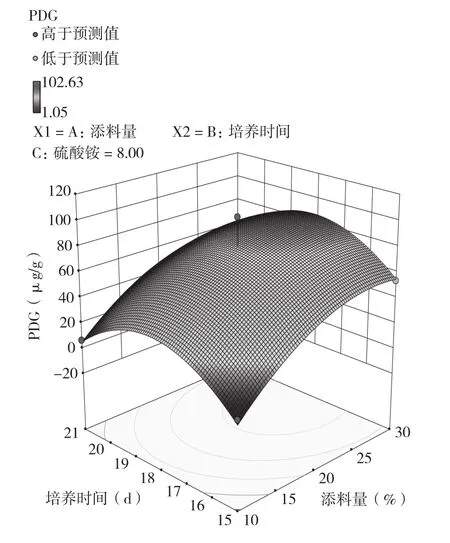
图1 培养时间、添料(杜仲粉)量与PDG产量的响应面图
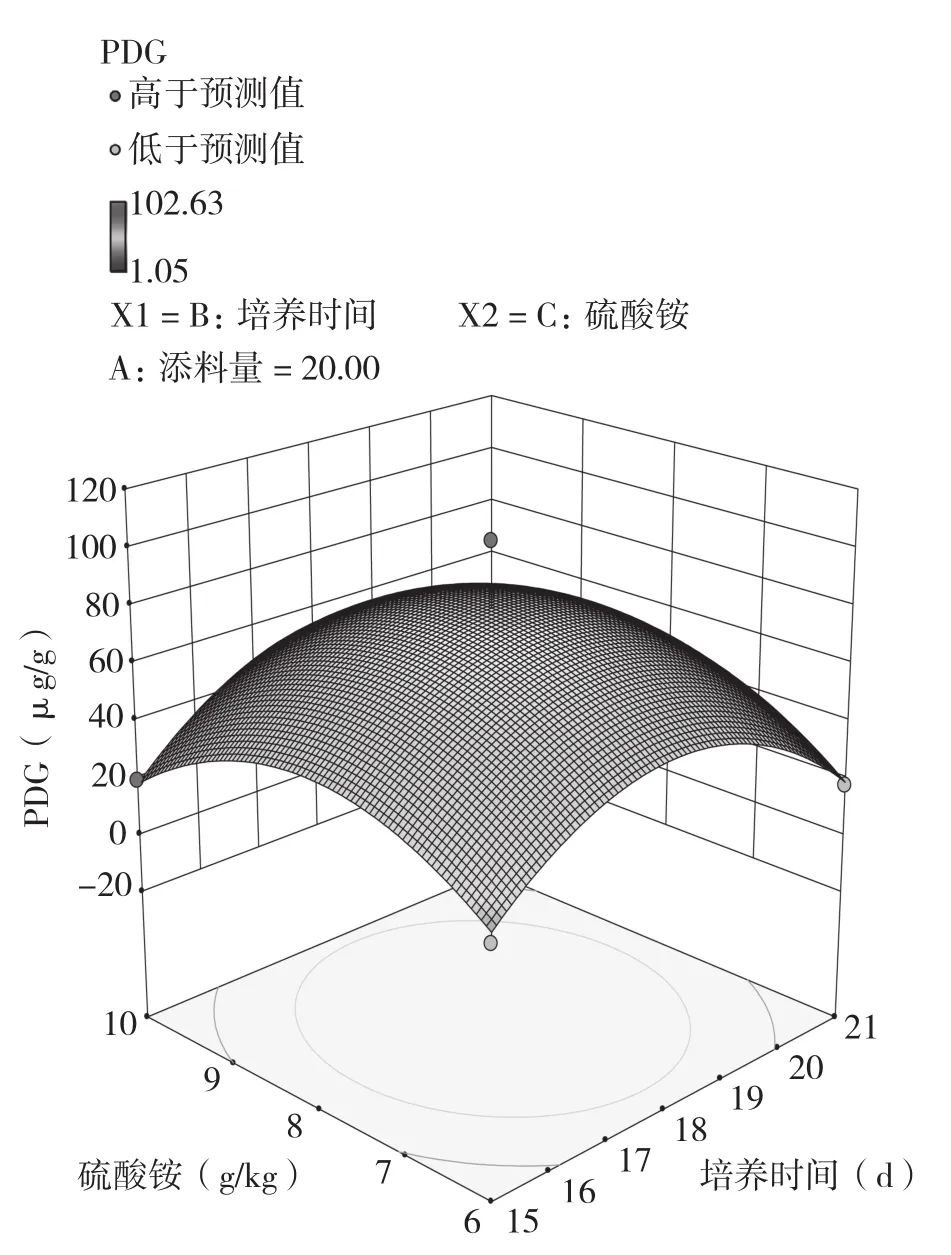
图3 硫酸铵、培养时间与PDG产量的响应面图
2.4 实验结果验证
为验证预测值的准确性,按响应面实验分析出的最优培养基组合和培养条件进行发酵,并与初始培养基作对比。结果虫草素和PDG的产量分别为 2.92±0.07、90.03±1.07 μg/g,与预测值非常接近,且较优化前虫草素和PDG产量(1.82±0.03、58.88±0.84 μg/g)分别提高60.44%、52.90%。

表7 验证实验结果
3 结论与讨论
采用真菌固体发酵能显著提高中药材中有效成分的含量,如土生曲霉以三七为基质原料进行固态转化,三七中原人参二醇型皂苷Rd及原人参三醇型皂苷Rg1含量得到大幅度提高[9];冬虫夏草蝙蝠蛾拟青霉固态发酵人参药材可同时获得人参稀有皂苷Rd、腺苷、虫草素、甘露醇等活性物质,实现一次发酵双向转化,同时获取两种药物的有效成分,起到协同增效的作用[10];灵芝发酵人参残渣可显著提升人参皂苷Rd的含量[11];功能真菌M1固体发酵人参,能够大幅度提高人参药材中总皂苷的含量,其增长率最高可达103.82%[12]。逄世峰等[3]、闫梅霞等[4]的研究也表明,蛹虫草作为一种食药用真菌,在中药的生物转化中是一种可利用的有效资源,与本试验结果一致。
发酵培养基组成、培养条件及原材料质量对代谢产物的种类及产量均有较大影响,通过改变培养基组份、培养条件,选取高质量的药材和优质菌种可显著提高其有效成分的产量及成分配比。本研究选取未经任何处理的生杜仲作为试验材料,以确保药材的质量。在实际生产中,大米作为天然养分,可向培养基提供一定量的碳氮源,培养更易成功。同时,在培养基中添加一些辅料,如维生素B1、复合碳源(葡萄糖&土豆)等[13],能促进蛹虫草培养基中虫草素的积累及菌丝的生长,调节适宜的pH有利于蛹虫草生长[14],较高温度下更利于蛹虫草中虫草素的合成和积累[15]。本研究通过Plackett-Burman实验筛选出添料(杜仲粉)量、培养时间、硫酸铵3个显著影响蛹虫草转化杜仲培养基成分的因素,这与添加NH4+对蛹虫草发酵产虫草素具显著促进作用[16]的结论相吻合。蛹虫草利用NH4+合成谷氨酰胺,也就是核苷的间接前体,进而生成核苷[17],而虫草素是一种核苷类物质,由此说明为什么培养基中添加NH4+可以提高虫草素的产量了。从微生物代谢角度分析可知,虫草素合成的直接前体物是腺苷,腺嘌呤、次黄嘌呤等间接参与虫草素合成[18]。本实验中虫草素含量增长,可能还与腺苷、腺嘌呤等化合物的含量变化有关。杜仲皮中葡萄糖类物质转化形成松伯醇[19],松伯醇经松脂醇合酶催化聚合生成松脂醇[20],松脂醇在酶的作用下糖基化生产PDG[21],从而构成杜仲PDG的生物合成途径,该途径中任何一个酶体系的改变都可以影响PDG的产量,本实验利用蛹虫草所具有的酶系去影响PDG合成途径,使其产量发生改变。

