头孢克肟脂质体的制备工艺研究
陈淑云 邱礼臻 庞国棉 李晓玲 朱岳鑫
(1广东省中医院广州中医药大学第二附属医院大学城药剂科 广东 广州 510006)(2广东药科大学药学院 广东 广州 510006)
头孢克肟(cefixime)是由日本藤泽药品工业株式会社于上世纪80年代初合成开发的β-内酰胺类第三代头孢类广谱抗生素[1-3],其对淋球菌、链球菌、大肠杆菌、变形杆菌等多种菌属均有较强的杀菌能力,临床上广泛应用于敏感菌引起的多种疾病。目前,头孢克肟的剂型主要有胶囊剂、散剂、颗粒剂、片剂等形式,而头孢克肟易受外界环境(光、水、热等)影响,使其功能官能团发生降解,从而减小其抗菌活性和增加过敏风险,为能使头孢克肟药物剂型能减毒增效,扩大其临床应用范围,本文将对头孢克肟制成脂质体[4-6],提高其稳定性和生物利用度,以期开发出一种适用于临床的新剂型。
1.试验和设备
1.1 实验试剂
头孢克肟原料药(湖北康宝泰精细化工有限公司提供);头孢克肟对照品(中国药品生物制品鉴定所);葡聚糖凝胶G-50(上海伯奥生物科技有限公司);卵磷脂(国药集团化学试剂有限公司);胆固醇(国药集团化学试剂有限公司);胆酸钠(国药集团化学试剂有限公司);其余试剂均为分析纯,水为双蒸水。
1.2 仪器设备
实验中主要的设备高效液相色谱仪HPLC(1260型,美国Agilent公司);精密电子天平(JJ224BC型,江苏双杰测试仪器厂);真空干燥箱(ZK-82A型,上海实验仪器总厂);电热恒温水浴锅(HH-8A型,北京科伟仪器公司);PH 计(PHS-3C型,上海仪电科学仪器公司)。WH-2微型漩涡混合仪(上海沪西分析仪器厂);超声破碎乳化仪;SHZ-Ⅲ型循环水真空泵(上海亚荣生化仪器厂);HP-01抽滤仪;恒温磁力搅拌器(TH2-82A上海);PH值测定仪(PB-10);600三用水箱。
2.实验方法与结果
2.1 头孢克肟含量测定
2.1.1 色谱条件 在全波长下对头孢克肟溶液进行扫描,其在254nm条件下具有最高吸收峰,HPLC所用色谱柱为Kromsail-C18柱(250*4.6mm,5um),流动相选用乙腈-0.2%磷酸二氢钠溶液(20∶80)(稀磷酸调节至4.0),柱温为35℃,进样量为20μL,流速为1.0mL/min。
2.1.2 标准曲线绘制 准确称取头孢克肟对照品10.00mg于20ml容量瓶,用20%乙腈定容至刻度线,摇匀即得浓度为0.5mg/ml的对照品溶液。分别量取对照品溶液母液1.0ml、2.0ml、3.0ml、4.0ml、5.0ml、6.0ml、7.0ml置于10ml容量瓶中,并用20%乙腈稀释至刻度线,摇匀备用。按照‘2.1.1’项下色谱条件进样,记录头孢克肟浓度(X)相应的峰面积(Y),确定标准曲线:Y=2580.6X+202.14(R2=1.0000),头孢克肟在浓度为50-350mg/L之间线性关系良好。
2.2 头孢克肟脂质体制备工艺
2.2.1 头孢克肟微囊评价指标 头孢克肟脂质体评价指标采用脂质体包封率(EE%)和载药量(LD%)进行综合评价。包封率测定方法采用葡聚糖凝胶层析法分离游离药物和脂质体,通过预实验确定收集含药脂质体洗脱液部位,精密量取4ml于10ml容量瓶中,用乙醇破乳后用20%乙腈定容,摇匀,按“2.1.1项下”进样测定峰面积,按“2.1.2项下”计算相应浓度C1:(ug/mL)。另取制备好的头孢克肟脂质体5.0ml直接用20%乙腈定容至200ml,精密量取4ml于10ml容量中,用乙醇溶液破乳后定容。摇匀,同样测定峰面积A,并计算药物浓度C2:(ug/mL)。包封率EE%=C1/C2:×100%。载药量取样本适量,按上述方法测药物浓度,载药量DL%=WD/WP×100%,其中WD为脂质体包裹的药物量,WP为载体用量。
2.2.2 头孢克肟脂质体制备工艺 定量称取胆固醇、卵磷脂、头孢克肟于圆底烧瓶中,加入l0.0ml氯仿-甲醇(1:1)复合溶剂于混合仪上充分溶解后,于35℃恒温水浴中旋转减压蒸发除去有机溶剂,形成类脂薄膜,继续用氮气吹干残余溶剂。再加入含有定量胆酸钠的水和介质溶液l0.0ml至烧瓶中,旋转继续洗膜l小时,使得脂质膜充分溶胀水化,得到脂质体混悬液。将混悬液分别置于冰水浴中探针式间断超声一段时间后,室温静置后用0.2um微孔滤膜滤过除去杂质即得头孢克肟脂质体。
2.2.3 优选头孢克肟脂质体制备工艺 根据预实验结果,确定影响头孢克肟脂质体制备的主要因素为药物:卵磷脂比、胆固醇:卵磷脂、胆酸钠:卵磷脂、水和介质pH值,针对4个主要因素选取主要水平,并以综合评分评价头孢克肟脂质体质量(综合评分=包封率×50%+载药量×50%)进行评价,采用L9(34)正交实验进行工艺优选。结果如下:

表1 正交试验主要因素与水平表
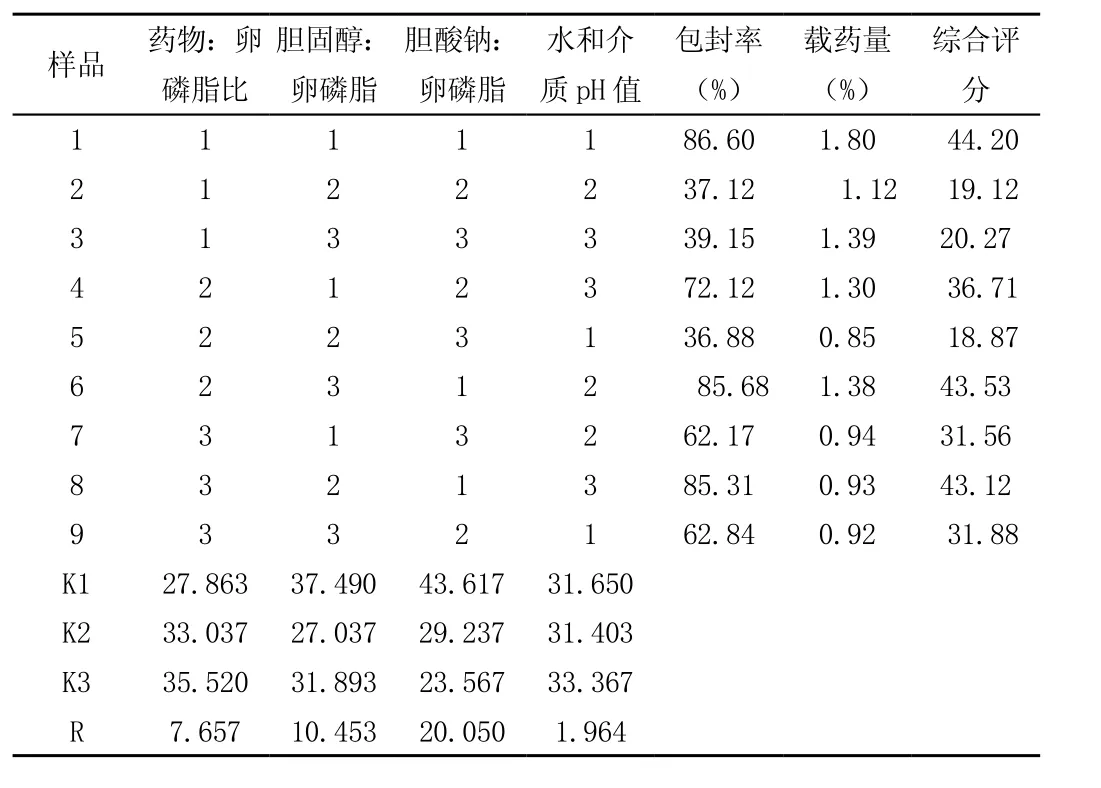
表2 头孢克肟脂质体制备正交试验结果

表3 头孢克肟脂质体综合评分方差分析表
由表2结果直观分析可得,以头孢克肟脂质体包封率和载药量综合评分为考察指标,三个因素影响程度依次为C>B>A>D,且A3>A2>A1,B1> B2>B3,C1>C2> C3,D3>D1>D2可得出最佳工艺条件为A3B1C1D3。
由表3方差分析可得:以头孢克肟脂质体包封率和载药量综合评分为考察指标时,因素B和C对试验结果有显著性影响,因素A和D对实验结果均无显著性影响,因此最佳制备工艺为A3 B1C1D3,即药物:卵磷脂比为1:45、胆固醇:卵磷脂为1∶4、胆酸钠:卵磷脂为1∶1、水和介质pH值为7.5。
2.2.4 验证最优条件 采用正交试验结果最佳工艺制备6份头孢克肟脂质体进行验证试验,结果得到头孢克肟脂质体包封率、载药量和综合评分,见表4。验证试验中制备的头孢克肟脂质体包封率平均值为89.63%,其载药量为1.93%,综合评分为45.78%。
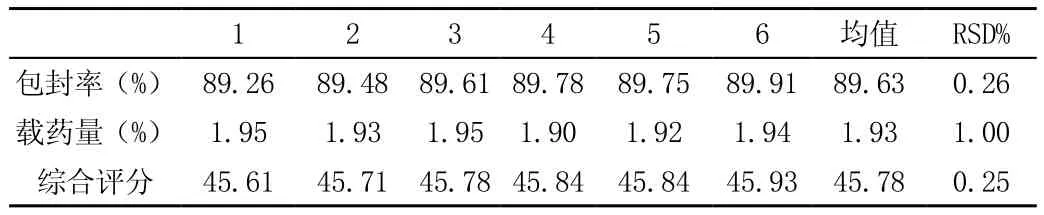
表4 头孢克肟脂质体工艺验证
3.讨论
通过正交试验[7-9]对头孢克肟脂质体工艺进行筛选,其综合评分为45.78%,而脂质体包封率平均值为89.63%,其载药量为1.93%,得到较为可靠的质量。包封率是脂质体质量控制的重要指标,反应药物被载体包封的程度及药物和载体的浓度,由于脂质体比药物粒子在体积上差异较大,故考虑用葡聚糖如Sephadex G-50柱层析作为区分和富集方法。经皮给药是药物通过皮肤吸收的一种给药方法,药物应用于皮肤上后,通过皮肤扩散,由毛细血管吸收进入体循环的过程称经皮吸收或透皮吸收。脂质体具有双重特性一亲水性和疏水性,因此可改善药物对皮肤的通透性,并可促进表皮及真皮组织的吸收,增加药物对角质层的穿透性。将头孢克肟制成脂质体,经皮给药可避免肝脏首过效应,且药物吸收不经胃肠道,同时能长时间持续扩散进入血液循环,减少用药次数,改善患者用药顺应性,提高治疗效果,是一种理想的剂型选择。本文制备的头孢克肟脂质体质量可靠,扩展了临床应用剂型,具有良好的前景。
[1]张明发,季珉.国内对头孢克肟的临床研究与评价[J].抗感染药学,2010,7(1):1-9.
[2]边磊,宋敏,杭太俊,等.乙腈辅助电喷雾LC-MS/MS法分析头孢克肟中的有关物质[J].药物分析杂志,2010,30(5):872-878.
[3]Yu RX,Yin Y,Wang GQ,et al.Worldwide susceptibility rates of Neisseria gonorrhoeae isolates to cefixime and cefpodoxime: a systematic review and meta-analysis.PLoS One.2014 Jan 31;9(1):e87849.
[4]李赛侯,冬枝,孙敏捷,等.壳聚糖包覆左旋多巴脂质体冻干制剂的制备及大鼠口服药动学[J].中国药科大学学报,2009,40(5):406-411.
[5]郑杭生,黄绳武,李范珠,等.盐酸青藤碱脂质体的制备工艺研究[J].中草药,2013,44(4):408-413.
[6]刘梦娇,符华林,付强,等.硫酸头孢喹肟脂质体的制备工艺[J].过程工程学报,2013,13(5):877-881.
[7]于莲,张传美,李爱臣,等.参芎明胶微球的制备工艺研究[J].时珍国医国药,2010,21(3):667-668.
[8]杜旭,冯涌,曹晓云.高效液相色谱法测定头孢克肟及其片剂和胶囊剂的含量和有关物质[J].天津药学,2009,21(3):27-29.
[9]Raj R,Raj PM,Ram A.Nanosized ethanol based malleable liposomes of cytarabine to accentuate transdermal delivery:formulation optimization, in vitro skin permeation and in vivo bioavailability[J].Artif Cells Nanomed Biotechnol,2018.

