2013—2018年我国H9亚型禽流感分子流行病学监测
刘 东,宋姗姗,于 静,刘红祥,高天佐,李 彬,王群义,刘丰波,刘 平,栾栋祖,杜元钊
(青岛易邦生物工程有限公司动物基因工程疫苗国家重点实验室,山东青岛 266032)
禽流感(Avain Influenza,AI)是由禽流感病毒(AIV)引起的禽类全身性或呼吸系统性疾病。AIV属于正黏病毒科A型流感病毒属,其关键致病性基因为HA基因。在宿主胰蛋白酶的作用下,HA基因能裂解为HA1和HA2,因而产生具有感染性的病毒粒子[1]。
根据对禽类致病性的不同,AI又分为高致病性(High pathogenic AI,HPAI)和低致病性(Low pathogenic AI,LPAI)或温和性(Mildly pathogenic AI,MPAI)[2]。MPAI 虽然对禽类的致病性较弱,但其基因来源复杂、分布广,又易继发其他致病微生物感染,对养禽业具有潜在危害,尤其是 H9 亚型。目前监测发现,有些毒株的基因组已发生了多元重组,基因片段来源也多样化[3]。因此,有必要实时监测当前H9N2亚型AIV流行毒株HA基因的遗传变异情况。本研究对2013年到2018年4月河北、河南、江苏、安徽、山东、湖南、吉林和四川等省份养殖场采集的鸡群喉、泄殖腔拭子以及疑似病料进行了 H9 亚型 AIV病原学检测,对其HA基因进行扩增、测序与分析,绘制了系统进化树并进行了分子遗传进化分析,为H9亚型AI防控提供理论依据。
1 材料与方法
1.1 样品来源
采集2013—2018年我国河北、河南、江苏、安徽、山东、湖南、吉林和四川等15个省份养殖场疑似流感暴发鸡群的喉、泄殖腔拭子以及病料样品。
1.2 主要试剂和仪器
RNA提取试剂盒:购自天恩泽生物公司;HiScript®II One Step RT-PCR Kit:购自诺唯赞生物公司;DNA Marker DL2000:购于宝生物工程(大连)有限公司。
超净工作台(北京东联哈尔-DL-CJ-1NDII),低温冷冻离心机(湖南湘仪TGL-6),
PCR 扩增仪(美国Bio-rad T100),微波炉(格兰仕)和紫外光凝胶成像系统(培清-JS-680C)。
1.3 引物
按照农业行业标准《禽流感病毒 RT-PCR 试验方法》(NYT772-2004)中的H9 亚型AIV RT-PCR检测方法,选用 H9-732U/H9-732L 特异性引物,扩增H9 亚型血凝素基因片段。引物序列如下:H9-732U 5'-TCAACAAACTCCACCGAAACTGT-3';H9-732L 5'-TCCCGTAAGAACATGTCCATACCA-3'。引物由北京华大基因科技有限公司合成。
根据 GenBank 上已经发表的AIV毒株参考序列,设计扩增 HA 全长基因片段引物。设计的引物序列为:上游5'-TATTCGTCTCAGGGAGCGAAAGCAGGGG-3';下游 5'-ATATCGTCTCGTATTAGTAGAAACAAGGGTGTTTT-3'。引物由北京华大基因科技有限公司合成。
1.4 病毒RNA提取
参照天恩泽RNA提取试剂盒说明书,具体如下:取组织研磨液 200 µL,加 1 000 µL 溶液A,混匀;加 200 µL 氯仿溶液,震荡混匀,12 000 r/min,4 ℃离心10 min;小心吸取水相 600 µL 加入到新的DEPC 处理过的 1.5 mL 离心管中;加等体积的溶液B混匀,分两次加到离心吸附柱中,12 000 r/min,离心30 s;弃穿透液,加700 µL 洗液,12 000 r/min,离心30 s;弃穿透液,12 000 r/min,空离30 s;将离心柱转移至新的 DEPC 处理过的 1.5 mL 离心管中,加60 µL洗脱液,12 000 r/min,离心30 s,得到RNA,−20 ℃保存备用。
1.5 HA基因RT-PCR
采用HiScript®II One Step RT-PCR Kit试剂盒,进行RT-PCR反应。反应条件为:50 ℃ 30 min,94 ℃ 3 min;94 ℃ 45 s,52 ℃ 30 s,72 ℃ 1 min 45 s,33 次循环,72 ℃ 10 min。
1.6 基因序列测定
将PCR产物送往北京华大基因科技有限公司进行测序。
1.7 H9亚型毒株分子进化分析
利 用 NCBI(www.ncbi.nlm.nih.gov) 中 的Influenza virus resource 数据库,搜索H9 亚型 AIV HA 基因序列,并同测序结果进行Alignment在线对比,然后利用 MEGA 7.0 软件,绘制进化树,选取代表毒株进行HA 基因分子演化分析,了解近年来我国H9 亚型AIV毒株HA 基因的演化特点。
2 结果
2.1 HA区域核苷酸及推导氨基酸同源性分析
通过PCR产物纯化测序和序列拼接,得到80个毒株的HA基因开放阅读框,其中2013年11株,2014年 15株,2015年 8株,2016年 18株,2017年17株,2018年11株。BLAST检索发现,80株H9亚型AIV HA基因核苷酸同源性为85.4%~99.6%,氨基酸同源性为 85.9%~99.9%。
2.2 HA基因遗传进化分析
从 GenBank 中选取 5 个 H9 亚型代表毒株及11个我国普遍使用疫苗毒株的 HA 基因序列(表1),与分离的80株毒株HA 基因进行对比和遗传进化树分析(图1)。从图中可看出2013—2018年分离到的H9亚型 AIV大部分在H9.4.2.5分支上,只有2013年云南的A-CK-yunnan-2013在H9.4.2.6分支上。H9.4.2.5分支又有许多小分支,其中:79个分离株在Y4亚群,与Y4疫苗株的核苷酸同源性在93.7%以内;60个分离株在WJ57亚群,与WJ57疫苗株核苷酸同源性在95.5%以内。遗传进化树分析显示:2013—2018年的分离毒株在遗传进化树上基本按时间顺序排列,而且随着时间推移,新分离毒株逐渐远离疫苗毒株。
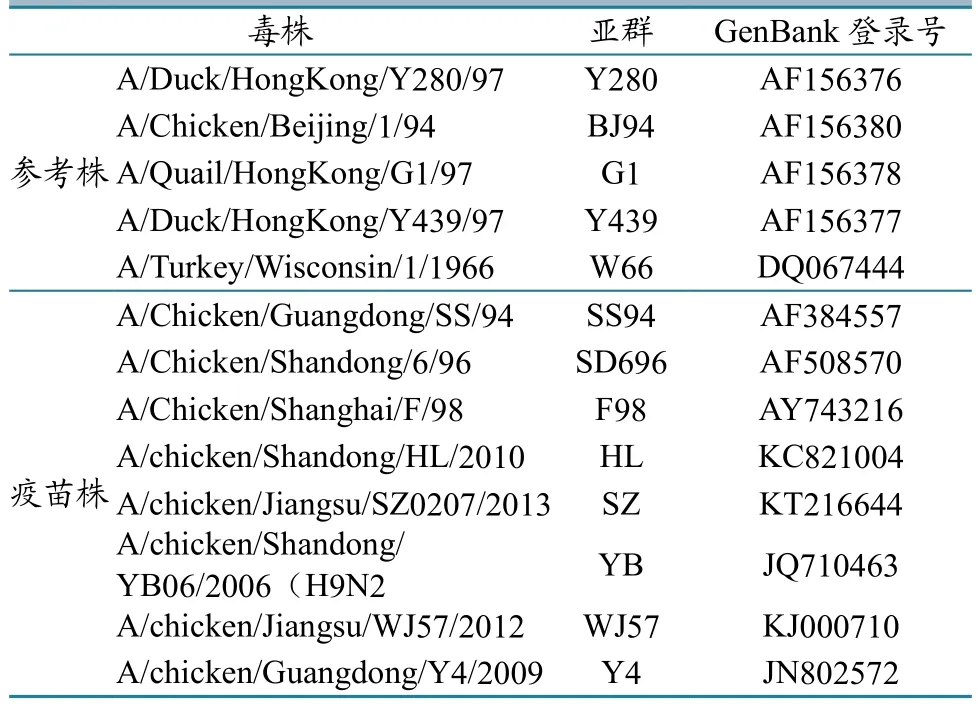
表1 选用的H9亚型AIV参考株
2.3 HA基因关键氨基酸变异分析

图1 2013—2018年我国大陆部分地区 H9 亚型 AIV 的 HA基因多样性分析
参照人源H3N2流感病毒A/Achi/2/1968毒株的HA基因氨基酸序列[8],推导并比较80个毒株HA基因关键位点的氨基酸序列。结果显示:80株病毒HA基因裂解位点氨基酸序列(321~329)中,除1株为PSRSSN、1株为PSRSNR外,其余78株均为PSRSSR,均符合低致病性禽流感特征。这些毒株的裂解位点氨基酸序列虽为低致病性特征,但不同于参考毒株Y280(PARSSR),其第2位氨基酸残基由非极性氨基酸(A)突变为极性氨基酸(S)。通过核苷酸序列分析发现,这80株毒株HA裂解位点序列的第5位氨基酸残基均为S,由AGT编码。
H9亚 型 AIV HA 基 因 在 109、161、163、191、198、202、203和146~150及232~237位(H9序列位置)构成受体结合位点的袋状结构。80株病毒基因受体结合位点右侧壁(146~150)比较保守,主要模式为GTSKA,受体结合位点左侧壁(232~237)中的234和235位正在发生突变,主要模式为NGLMGR,而国内参考毒株Y280的模式为NGLQGR,BJ94、F98的模式为NGQQGR。受体结合位点的改变主要是在198位,呈现T/V/A/K的突变,226位氨基酸位点与唾液酸受体α-2,6Gal和α-2,3Gal的结合特性有关。本研究中的所有H9N2亚型AIV的226位氨基酸均为亮氨酸(L),而早期的大多为谷氨酰胺(Q)。这说明2013年以后的H9N2病毒具备了结合α-2,6Gal唾液酸受体的能力,病毒感染哺乳动物,甚至是人的概率大大增加(表2)。

表2 H9亚型AIV裂解位点和袋状结合区的突变
4个毒株(4/80)含有8个潜在的糖基化位点,而且这4个毒株只有在2013年和2014年分离得到(表3),9个毒株含有6个糖基化位点,也是2013年和2014年的分离株。与Y280相比,其他毒株在第203位氨基酸大多发生了T→I/V,导致了第200位糖基化位点逐渐缺失,第297位氨基酸发生了P→S的变化,使得295位多出了一个潜在的糖基化位点NCS。新的糖基化位点的出现或者原有糖基化位点的缺失均有可能通过改变受体结合位点和HA蛋白的抗原性来感染新宿主。
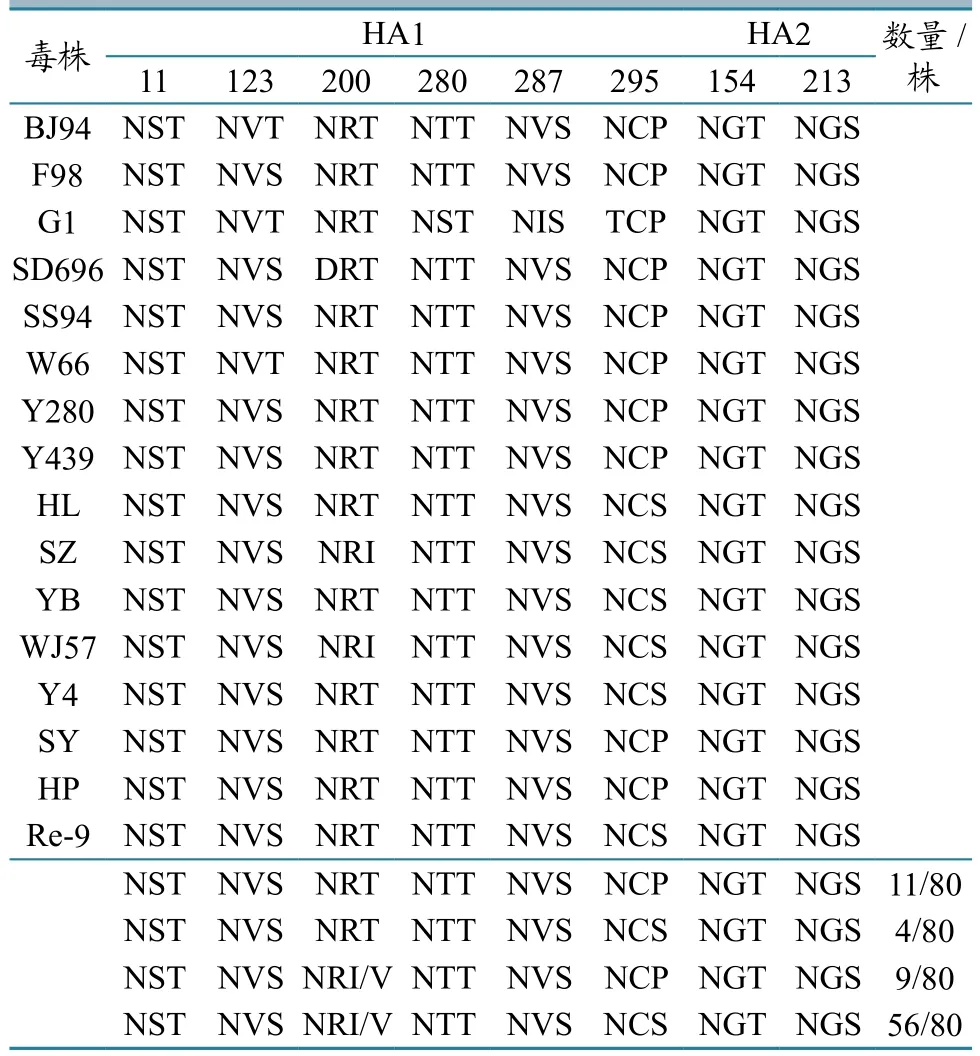
表3 H9亚型AIV HA蛋白糖基化位点
3 讨论
H9N2 亚型 AIV 在世界范围内广泛分布,在遗传进化上,可以分为北美系和欧亚系两大分支,而欧亚系又进一步衍生出以 BJ/94-like 或 Y280-like、G1-like、Y439-like 以及 F/98-like 等为代表的病毒亚群[4]。根据新的亚系命名系统,我国 H9N2 亚型AIV分离毒株主要来源于H9.4.2 分支,而4.2分支又演化为4.2.1~4.2.6分支。本次分离到的 80 株H9N2 亚型AIV毒株均属于H9.4.2.5 分支的独立(Y4)亚群。
本研究分析了2013—2018年分离得到的80株H9亚型AIV的HA基因序列,发现这80株HA基因的裂解位点序列大多为PSRSSR,与参考毒株Y280不同,其第2位氨基酸残基由非极性氨基酸(A)突变为极性氨基酸(S)。氨基酸序列分析发现,这80株病毒在HA裂解位点序列的第5位氨基酸残基均为S,由AGT编码,如果发生A替换T/C,该位点的S就会变为R,那么这些毒株就会变为高致性病毒株,因而具有潜在毒力增强的风险。
毒株的潜在糖基化位点也是影响毒株毒力的关键位点之一。在本研究分离的80株毒株中,2013—2014年有4株含有8个潜在糖基化位点,与F98、Y280等参考毒株相比多出了295NCS这一潜在糖基化位点,有9株含有6个潜在糖基化位点,与F98、Y280等参考毒株相比消失的潜在糖基化位点是200NRT,而其余分离株,特别是2015年以后的毒株,在第203位氨基酸大多发生了T→I/V的变化,导致了第200位糖基化位点逐渐缺失,第297位氨基酸发生了P→S的变化,使得295位多出了一个潜在的糖基化位点NCS。新的糖基化位点的出现或者原有糖基化位点的缺失均有可能通过改变受体结合位点和HA蛋白的抗原性来感染新宿主。
目前灭活疫苗免疫仍是防控 H9N2 亚型禽流感的主要方法。该方法虽然起到了一定的防控作用,但由于疫苗的长期使用,导致免疫压力持续存在,使得H9N2亚型AIV可能会不断重组和变异[5]。因此,疫苗株的选择一定要与现场流行毒株匹配,否则就起不到理想的保护作用。为及时了解和掌握H9N2亚型AIV的流行动态及变异情况,必须做好病毒的长期跟踪监测工作,这样可以根据病毒的流行和变异情况,及时研发有效的针对性疫苗,确保H9亚型AI的防控效果。

