MDR-TB患者采用不同化疗方案所致药物不良反应及治疗转归研究
李凤丽 阚晓红 李琦 张云玲 李东方 周云 姜雯 华小果 胡成洋 潘敏 张秀军
耐多药结核病(multidrug-resistance tuberculosis,MDR-TB)的影响正在全球范围内快速增加,2016年全球已有49万例MDR-TB患者[1]。中国是全球27个MDR-TB高负担国家之一,每年新发MDR-TB患者12万例,位居全球第2位[2]。MDR-TB因治疗效果不佳,治疗花费高,是结核病控制中亟待解决的难题。笔者探究不同MDR-TB化疗方案患者发生药物不良反应及治疗转归情况,为提高MDR-TB患者的治疗成功率提供依据。
对象和方法
1.研究对象:选取2009年10月至2014年5月在安徽省胸科医院就诊的(包括门诊及住院患者)符合本研究纳入标准并接受治疗的耐多药肺结核患者为研究对象,共纳入患者102例。根据患者入组时间排序,连续依次入选2种方案治疗组。方案一组纳入54例,男40例,女14例,平均年龄(35.4±10.3)岁;方案二组纳入48例,男32例,女16例,平均年龄(38.6±12.7)岁。两组研究对象性别及年龄差异均无统计学意义(χ2=0.67,P=0.412;t=1.42,P=0.158),均衡可比。
2.纳入及排除标准:(1)纳入标准。①自愿加入研究,并签署知情同意书;②年龄在18~65岁之间的住院及门诊患者,性别不限;③临床确诊为MDR-TB患者(痰结核分枝杆菌培养阳性,菌种鉴定除外非结核分枝杆菌,且至少同时对利福平和异烟肼耐药者),非广泛耐药结核病患者;④胸部X线摄片检查证实有肺内病变;⑤入组前4个月痰培养或痰涂片结果阳性;⑥育龄期妇女妊娠尿检阴性并同意在研究过程中使用高效避孕措施;⑦病程≤3年,有可选择的4种敏感药物构成有效的治疗方案。(2)排除标准。①对本研究使用药物或其中任何成份有过敏史者;②有严重并发症或肾功能受损(血清肌酐水平≥265 μmol/L)或肝功能受损[丙氨酸氨基转移酶(ALT)和(或)天冬氨酸氨基转移酶(AST)水平高于实验室参考值上限2.5倍];③临床上可见明显的心电图异常(男性患者QT间期延长超过430 ms;女性患者QT间期延长超过450 ms);④有心血管类疾病史或现患此类疾病,如心律失常、高血压(血压控制不佳)、心力衰竭或心肌梗塞后状态;⑤妊娠期或哺乳期妇女。
3.治疗方案:(1)方案一。3Clr-Z-Am-Mfx+XY/3Clr-Z-Am3-Mfx+XY/12Clr-Z-Mfx+XY;(2)方案二。3Z-Am-Lfx+XY/3Z-Am3-Lfx+XY/18Z-Lfx+XY。其中,Clr:克拉霉素;Z:吡嗪酰胺;Am:阿米卡星(丁胺卡那霉素);Lfx:左氧氟沙星;Mfx:莫西沙星。XY:指根据患者的药物敏感性试验及其耐受情况选择的2种敏感药物[可依次选择Pto(丙硫异烟胺)、PAS(对氨基水杨酸钠)、E(盐酸乙胺丁醇)]。
4.随访管理:患者在治疗过程中复查频率不得低于1次/月(出现不良反应及时就诊),按照研究设计对MDR-TB患者治疗检查的要求,为患者免费提供痰检、胸部CT检查、血尿常规、肝肾功能、心电图等检查。
5.治疗转归分类:(1)治愈:患者完成疗程且无治疗失败的证据,且在强化期结束后连续3次或以上痰培养阴性,每次间隔至少30 d;(2)完成治疗:患者完成疗程且无治疗失败的证据,且在强化期结束后没有证据显示连续3次或以上痰培养阴性,每次间隔至少30 d;(3)失败:患者由于以下原因需要中止治疗或永久性更改方案(更换2种以上药物),包括强化期(8个月)结束时痰菌未转阴、痰菌阴转后在继续期又复阳、发现对氟喹诺酮类及注射类药物耐药的证据及出现药物不良反应;(4)死亡:患者在治疗过程中由于任何原因造成的死亡;(5)丢失:因任何原因治疗中断连续2个月及以上;(6)迁出:患者转诊到其他结核病防治机构;(7)其他:确诊后拒绝治疗或不符合本研究纳入标准而未治疗者。
耐多药肺结核患者治疗成功率为在一定期间内某辖区中治愈或完成治疗的耐多药肺结核患者例数占纳入治疗的耐多药肺结核患者总例数的百分率。
6.不良反应种类和信息采集:MDR-TB患者治疗过程中常见的不良反应为肝功能损伤、肾功能损伤、胃肠道反应、血液系统影响、听神经损伤、视神经损伤、药物过敏、神经精神系统异常、关节肌肉痛、电解质异常、甲状腺功能异常及其他。将仅表现为尿酸升高未出现关节肌肉痛划归为单纯性尿酸升高。随访时记录患者的不良反应发生情况,包括:名称、程度、发生时间、处理措施、结束时间和转归。观察评价方法参照《药品不良反应报告和监测管理办法》中的相关规定。
7.质量控制:在课题实施前、现场实施阶段均做了质量保证。首先,由国内知名结核病临床、科研和流行病学专家对实施方案进行多次论证和完善。课题所有涉及到的相关人员(临床医生、实验室人员、课题管理人员)均接受统一安排的培训。连续随机纳入课题实施期间所有符合纳入标准的患者,不得挑选和漏选。患者信息采集时,调查员应接受课题的统一培训,按照统一设计的患者信息表中的要求准确填写相关内容;首诊医生完成患者信息采集后,由复核医生及时对信息表中的重要信息(病史、治疗史、用药史等)再次询问患者。
8.统计学分析:调查数据采用EpiData 3.1软件进行平行双录入,应用SPSS 16.0软件进行统计学分析。计数资料以“率(%)”表示,组间差异的比较采用χ2检验,以P<0.05为差异有统计学意义。
结 果
1.治疗情况:102例研究对象中54例接受方案一治疗,48例接受方案二治疗。方案一组治愈32例、完成治疗0例,治疗成功率为59.3%(32/54);36例(66.7%)发生药物不良反应。方案二组治愈31例、完成治疗0例,治疗成功率为64.6%(31/48);30例(62.5%)发生药物不良反应。两种方案治疗成功率差异无统计学意义(χ2=0.31,P=0.581),药物不良反应发生率差异无统计学意义(χ2=0.41,P=0.815)。
2.药物不良反应发生类型:对两种方案治疗所致的药物不良反应发生类型进行统计,方案一组药物不良反应发生率居前3位的是胃肠道反应(41.7%)、单纯性尿酸升高(41.7%)、血液系统影响(25.0%);方案二组药物不良反应发生率居前3位的是胃肠道反应(36.7%)、单纯性尿酸升高(33.3%)、肝功能损伤(20.0%)。两组各类型不良反应发生率之间差异均无统计学意义(表1)。本次研究有一类特殊的药物不良反应为QT间期延长,方案一组有12例(22.2%)患者出现,方案二组有3例(6.3%)患者出现;两种方案比较,QT间期延长发生率差异有统计学意义(χ2=3.97,P=0.046)。
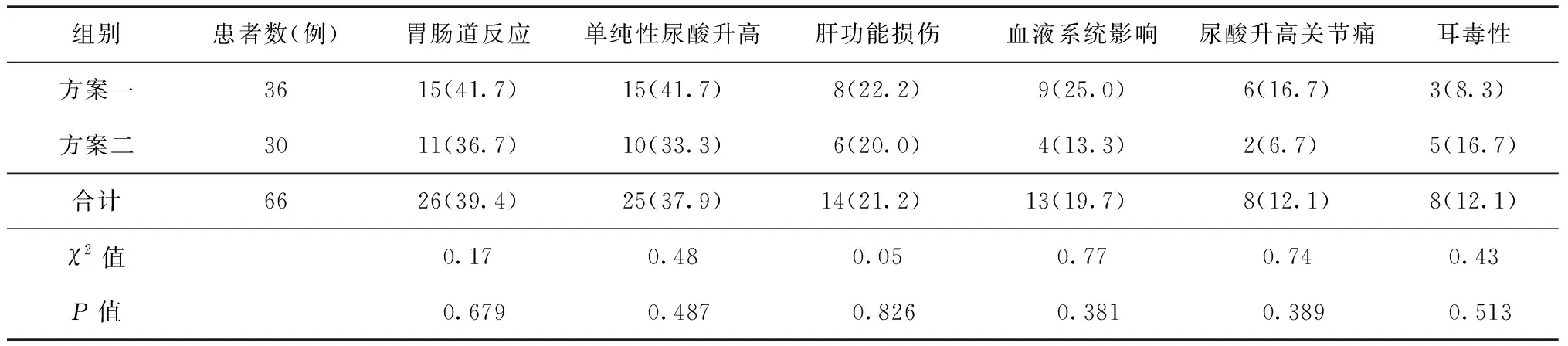
表1 两组患者药物不良反应发生类型的比较
注 表中括号外数值为“发生例数”,括号内数值为“发生率(%)”
3.药物不良反应对患者治疗依从性的影响:方案一组发生药物不良反应的患者有36例,其中3例(8.3%)调整药物剂量、5例(13.9%)暂停用药、6例(16.7%)终止治疗、22例(61.1%)无影响,患者治疗依从率为83.3%(30/36)。未发生药物不良反应者18例,有2例丢失,其余患者均完成治疗,治疗依从率为88.9%(16/18)。两者治疗依从率差异无统计学意义(χ2=0.02,P=0.892)。
方案二组发生药物不良反应的患者有30例,其中3例(10.0%)调整药物剂量、3例(10.0%)暂停用药、5例(16.7%)终止治疗、19例(63.3%)无影响,患者治疗依从率为83.3%(25/30)。未发生药物不良反应者18例,有2例丢失,其余患者均完成治疗,治疗依从率为88.9%(16/18)。两者治疗依从率差异无统计学意义(χ2=0.01,P=0.916)。
4.药物不良反应对治疗的影响:方案一组36例患者发生56例次药物不良反应,其中,50.0%(28/56)对治疗无影响、19.6%(11/56)调整药物剂量、19.6%(11/56)暂停用药、10.7%(6/56)造成治疗终止。方案二组30例患者发生38例次药物不良反应,其中,55.3%(21/38)对治疗无影响、15.8%(6/38)调整药物剂量、15.8%(6/38)暂停用药、13.2%(5/38)造成治疗终止,见表2。
5.药物不良反应对患者治疗转归的影响:方案一组36例发生药物不良反应的患者中治愈20例,完成治疗0例,治疗成功共计20例,治疗成功率为55.6%;未发生药物不良反应的患者治疗成功率为66.7%(12/18);两者差异无统计学意义(χ2=0.61,P=0.433)。方案二组30例发生药物不良反应的患者中治愈18例,完成治疗0例,治疗成功共计18例,治疗成功率为60.0%;未发生药物不良反应的患者治疗成功率为72.2%(13/18);两者差异无统计学意义(χ2=0.74,P=0.391)。
讨 论
MDR-TB治疗时间长,治疗难度大,已成为全球结核病控制一大难题[3]。为规范化MDR-TB的治疗,并尽可能提高MDR-TB患者治疗成功率,世界卫生组织制定了耐多药肺结核的标准化治疗方案[4-5]。但对于MDR-TB治疗方案的探索仍在继续。一方面,耐多药结核分枝杆菌对化疗药物敏感度不高、反应慢,需多种药物长期联合化疗,才能达到最佳的治疗效果;另一方面,因长期多种药物联合使用使耐多药结核分枝杆菌产生耐受,同时药物不良反应增多[6]。故选择有效的抗结核药物组成合理的治疗方案是提高MDR-TB治疗成功率的关键。国内外相关规范与指南均以新一代氟喹诺酮类药物作为治疗MDR-TB的核心药物[5]。同时,也有研究显示,Lfx和Mfx在MDR-TB的治疗上作用相当[7],且两者在MDR-TB患者治疗过程中药物不良反应发生率不存在差异[8]。另外,Clr能以与结核分枝杆菌蛋白体SOS亚基结合的方式来干扰其蛋白质合成,与利福喷丁共同发挥作用,抑制结核分枝杆菌作用显著[9]。也有研究发现,Clr能通过免疫调节的方式,帮助抗结核药物进入结核分枝杆菌细胞内联合发挥协同作用,提高药效[10]。
本研究方案一组(含Clr和Mfx)与方案二组(不含Clr和Mfx)治疗成功率分别为59.3%和64.6%,且差异无统计学意义,均高于世界卫生组织报道的全球MDR-TB治疗成功率(54%)[1],一定程度上肯定了两种治疗方案的可行性。但因本次研究对象数量有限,为明确疗效仍需进一步研究。另外,两种治疗方案药物不良反应发生率分别为66.7%和62.5%,与张红伟等[11]采用个体化治疗方案报道的62.1%和孔雯等[12]采用标准化治疗方案报道的61.7%接近,但高于徐彩红等[13]报道的48.1%和Yang等[14]报道的37.1%。本研究两种方案中胃肠道反应均发生率最高,与徐彩红等[13]及弭凤玲等[15]报道的药物不良反应以胃肠道反应为主一致;其次最常见的药物不良反应为单纯性尿酸升高,与张红伟等[11]报道的结果一致;排在第3位的药物不良反应分别是血液系统影响和肝功能损伤,这种差异可能与Clr和Mfx合用有关,两种药物合用增加了对患者血液系统的影响。
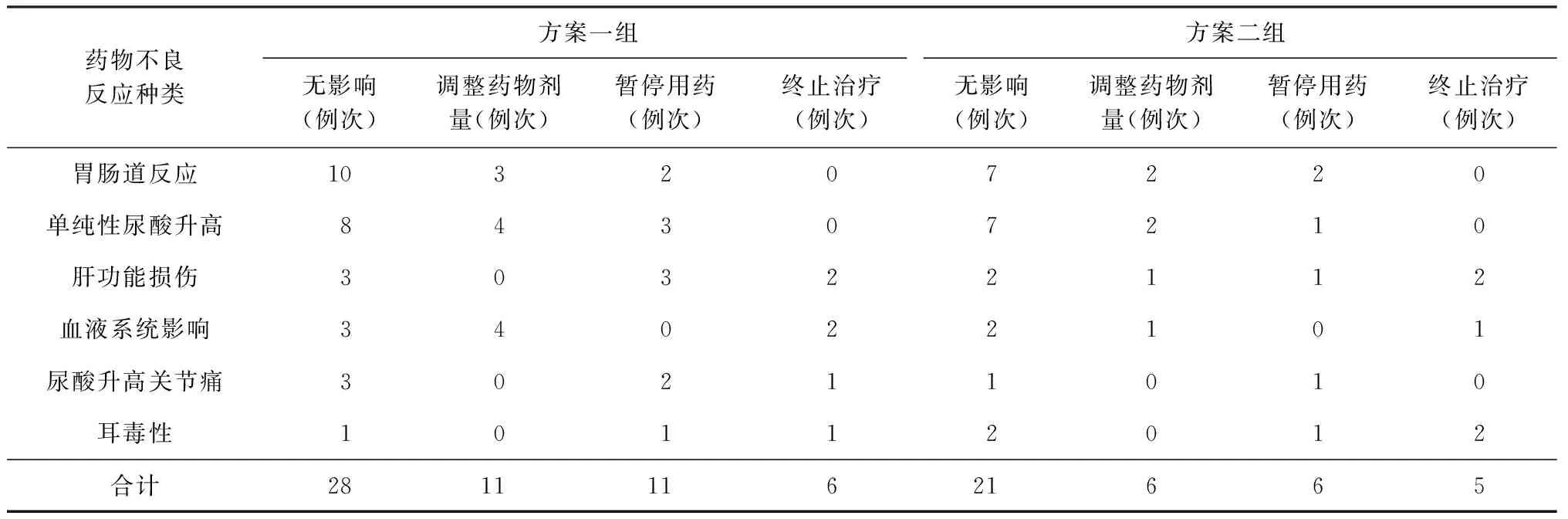
表2 不同种类药物不良反应对耐多药结核病患者治疗情况的影响
本次研究方案中的大环内酯类抗生素(Clr)和氟喹诺酮类抗生素(Mfx和Lfx)在应用过程中均会出现一类特殊的药物不良反应,即心脏毒性。Clr常见的心脏毒性主要表现为QT间期延长和尖端扭转型室性心动过速[16-17]。Mfx和Lfx常见的心脏毒性主要表现为QT间期延长[18-19]。本次研究结果显示,方案一组(含Clr和Mfx)QT间期延长的发生率明显高于方案二组。由此可见,Clr与Mfx合用确实在一定程度上增加了患者出现QT间期延长的风险,故在应用含Clr和Mfx方案治疗MDR-TB患者时,需加强对患者心电图的监测,一旦发生心脏毒性应采取积极治疗措施。
本次研究两种治疗方案药物不良反应发生与否均未对患者治疗依从性产生影响,该结论与部分研究结果相悖[20-21],这可能与本研究对参与的医生及纳入项目的患者进行了充分的培训有一定关系。本次研究对参与的医务人员进行了集中培训,并设立专门的随访门诊,对患者进行全程督导,让患者了解治疗过程中可能出现的药物不良反应,并在出现药物不良反应时及时就医。同时,两种治疗方案中发生与不发生药物不良反应的患者治疗成功率均无差异,说明出现药物不良反应并不可怕,只要与患者充分沟通,及时进行处理,避免药物不良反应产生严重影响,大多数患者都能很好地完成整个疗程并取得良好的治疗效果。

