桂花浸膏酶法制备工艺优化
张雪松裴建军赵林果汤 锋房仙颖
(1. 江苏农林职业技术学院,江苏 句容 212400;2. 南京林业大学,江苏 南京 210037;3. 国际竹藤中心,北京 100714)
桂花是一种重要的经济观赏植物,广泛分布于中国、日本、泰国等东南亚国家,尤其在中国分布最广,应用最多,品种资源极其丰富,在中国有2 500多年的栽培历史[1-2]。桂花的芳香和其生物学功能使得桂花备受关注。除了作为功能性食品添加剂外[3],桂花还有巨大的药用价值[4-6]。桂花浸膏的香味优雅,可广泛用于化妆品、香精香料生产中,已远销海外。传统的桂花浸膏制备工艺所得桂花产品产率及质量较低,存在利用不充分等缺点[7]。目前,国内外对桂花产品的研究主要为两大类:① 采用超临界CO2技术提取桂花浸膏、精油的工艺方法[8];② 桂花精油产品成分的分析检测技术[9-10]。其中,超临界流体萃取为获得高品质的桂花香料提供了技术保证[11]。该技术具有安全、环保和提取针对性强等优点,但因前期设备投资大,后期设备运行和维护成本高,目前还很难实现工业化生产[12-13]。
随着现代生物技术的发展,外源生物酶在植物提取和加工技术中的使用越来越广泛。目前,国际上香料生产中采用生物技术成为总体发展趋势。糖苷类香气前体是香料植物潜在的香气源[14],利用酶水解技术以提高香料产品得率和产品质量是当前国内外学者的主要研究方向[15]。杨志萍等[16]曾利用葡萄糖苷酶处理新鲜桂花,提高了顺、反-氧化芳樟醇,L-芳樟醇,萜烯二醇,L-α-萜品醇等香气成分的含量。
当前,桂花香料产品的市场价格持续走高,改进桂花香料产品的提取加工技术,提高产品得率和质量是桂花行业深加工过程中急需解决的问题。本试验通过筛选一些常用风味水解酶后,选择纤维素酶和果胶酶复配对桂花进行酶处理,基于单因素试验的最优条件,利用响应面优化复配酶提取工艺条件,以提高桂花浸膏的得率及主要香气物质含量。
1 材料与方法
1.1 材料与仪器
桂花:金桂,产地为浙江,50 ℃干燥后粉碎,过40目筛;
柠檬酸氢二钠、乙醚、石油醚、柠檬酸:分析纯,国药集团化学试剂有限公司;
正己烷:色谱纯,国药集团化学试剂有限公司;
β-葡萄糖苷酶1(110 IU/mL)、β-葡萄糖苷酶3(90 IU/mL)、鼠李糖苷酶(120 IU/mL):实验室制备;
脂肪酶(20 000 IU/g)、木聚糖酶(50 000 IU/g)、β-葡聚糖酶(20 000 IU/g):江苏锐阳生物科技有限公司;
β-葡萄糖苷酶(100 IU/g)、果胶酶(200 000 IU/g):南京奥多福尼生物科技有限公司;
GC-MS联用仪:Trace DSQ型,美国Thermo Electro-Finnigan公司;
旋转蒸发器:RE-5220型,上海亚荣生化仪器厂;
真空干燥箱:DZF-6021型,上海精密仪器仪表公司;
粉碎机:FW177型,天津市泰斯特仪器有限公司;
电子数显不锈钢恒温水浴锅:HHS112-B型,上海宜昌仪器厂;
酸度计:HS-25型,上海雷磁仪器厂。
1.2 试验方法
1.2.1 酶处理 称取15 g粉碎后的桂花,以50 IU/g干桂花,分别选用果胶酶、木聚糖酶、β-葡萄糖苷酶、β-葡聚糖酶、鼠李糖苷酶、脂肪酶、β-葡萄糖苷酶1以及β-葡萄糖苷酶3在其最适宜条件下,按液料比15∶1 (mL/g)酶解2 h。减压过滤后,将酶处理后的桂花在40 ℃下真空干燥2 h。
1.2.2 桂花浸膏制备
(1) 样品A:15 g粉碎后的桂花经过酶液处理所得桂花样品。
(2) 样品B:15 g粉碎后的桂花不加酶处理所得空白对照样品。
(3) 样品C:15 g粉碎后的干桂花样品。
(4) 桂花浸膏制备:分别将A、B、C 3种样品,按液料比15∶1 (mL/g),用石油醚40 ℃回流提取1 h。将提取液过滤,滤液经旋转蒸发浓缩去除石油醚,经40 ℃真空干燥获得桂花浸膏。桂花浸膏经正己烷溶解后,采用GC-MS对其成分进行检测。按式(1)计算浸膏得率。
(1)
式中:
c——浸膏得率,%;
m1——干燥后浸膏质量,g;
m2——原料质量,g。
1.3 GC-MS检测
检测条件参照文献[17]。
1.4 单因素试验
(1) pH对桂花浸膏得率的影响:设定50 IU/g·原料加入β-葡萄糖苷酶-果胶酶复配酶处理桂花,复合酶中β-葡萄糖苷酶与果胶酶酶活之比为1∶1、温度45 ℃、液料比15∶1 (mL/g),分别控制pH为3.5,4.0,4.5,5.0,5.5处理桂花2 h,考察pH对桂花浸膏得率的影响。
(2) 温度对桂花浸膏得率的影响:设定50 IU/g·原料加入β-葡萄糖苷酶-果胶酶复配酶处理桂花,复合酶中β-葡萄糖苷酶与果胶酶酶活之比为1∶1、液料比15∶1 (mL/g)、pH 4.5,分别控制温度为35,40,45,50,55 ℃处理桂花2 h,考察温度对桂花浸膏得率的影响。
(3) 酶解时间对桂花浸膏得率的影响:设定50 IU/g·原料加入β-葡萄糖苷酶-果胶酶复配酶处理桂花,复合酶中β-葡萄糖苷酶与果胶酶酶活之比为1∶1、液料比15∶1 (mL/g)、pH 4.5、温度45 ℃,分别控制酶解时间为0.5,1.0,1.5,2.0,2.5,3.0 h,考察酶解时间对桂花浸膏得率的影响。
(4) 液料比对桂花浸膏得率的影响:设定50 IU/g·原料加入β-葡萄糖苷酶-果胶酶复配酶处理桂花,复合酶中β-葡萄糖苷酶与果胶酶酶活之比为1∶1、pH 4.5、温度45 ℃,分别控制液料比为5∶1, 10∶1,15∶1,20∶1,25∶1 (mL/g)处理桂花2.5 h,考察液料比对桂花浸膏得率的影响。
(5) 加酶量对桂花浸膏得率的影响:设定复合酶中β-葡萄糖苷酶与果胶酶酶活之比为1∶1、pH 4.5、温度45 ℃、液料比20∶1 (mL/g),分别控制加入β-葡萄糖苷酶-果胶酶复配酶的量为20,30,40,50,60,70 IU/g·原料处理桂花2.5 h,考察加酶量对桂花浸膏得率的影响。
(6)β-葡萄糖苷酶比例对桂花浸膏得率的影响:设定50 IU/g·原料加入β-葡萄糖苷酶-果胶酶复配酶处理桂花,pH 4.5、温度45 ℃、液料比20∶1 (mL/g),分别控制β-葡萄糖苷酶比例为0%,30%,40%,50%,60%,70%,100%处理桂花2.5 h,考察β-葡萄糖苷酶比例对桂花浸膏得率的影响。
1.5 响应面试验
以桂花浸膏得率为衡量指标,采用响应面软件Design-Expert V8.0进行试验设计。
1.6 数据处理
显著性差异分析采用统计分析软件SPSS19。
2 结果与讨论
2.1 多种酶处理对桂花浸膏得率的影响
试验分别采用果胶酶、葡萄糖苷酶等不同水解酶对桂花进行水解,桂花浸膏得率见图1。
由图1可以得出,经各种酶处理后所得桂花浸膏的得率差异显著(P<0.05)。其中,β-葡萄糖苷酶和果胶酶处理桂花所得桂花浸膏得率均高于直接提取,且β-葡萄糖苷酶处理后桂花浸膏得率与直接提取相比提高20.10%,果胶酶处理高于直接提取2.45%。β-葡萄糖苷酶与果胶酶均有助于提高桂花浸膏得率,且最适条件比较接近,本试验选择β-葡萄糖苷酶和果胶酶复配对桂花进行酶处理。
2.2 β-葡萄糖苷酶和果胶酶复配处理对桂花浸膏得率的影响
2.2.1 单因素试验结果 从图2可以看出,随着pH、温度、酶解时间、液料比、加酶量以及复配酶中β-葡萄糖苷酶的比例逐渐增加,桂花浸膏的得率均出现先增大后减小的趋势。当复合酶总加酶量为50 IU/g,其中β-葡萄糖苷酶比例为50%,液料比20∶1 (mL/g),在pH 4.5、45 ℃条件下水解桂花2.5 h,桂花浸膏得率可由直接提取的2.04%提高到3.27%,提高了60.29%,远高于单一使用β-葡萄糖苷酶以及果胶酶。pH和温度是影响酶活的2个重要因素,通过单因素试验发现复配酶在pH 4.5时所得桂花浸膏得率最高,该pH值与β-葡萄糖苷酶最适pH一致,但略低于果胶酶的最适pH,可能是复配酶处理过程中β-葡萄糖苷酶起主导作用。同时研究还发现复配酶在40~50 ℃时所得桂花浸膏得率均保持较高水平,可能与所使用的工业酶制剂工作温度较为宽泛有关。此外,由于果胶酶可以增加植物细胞壁的通透性,所以复配酶中果胶酶的比例较小时会影响复配酶破坏桂花细胞壁的效果,从而降低浸膏物质的提取。
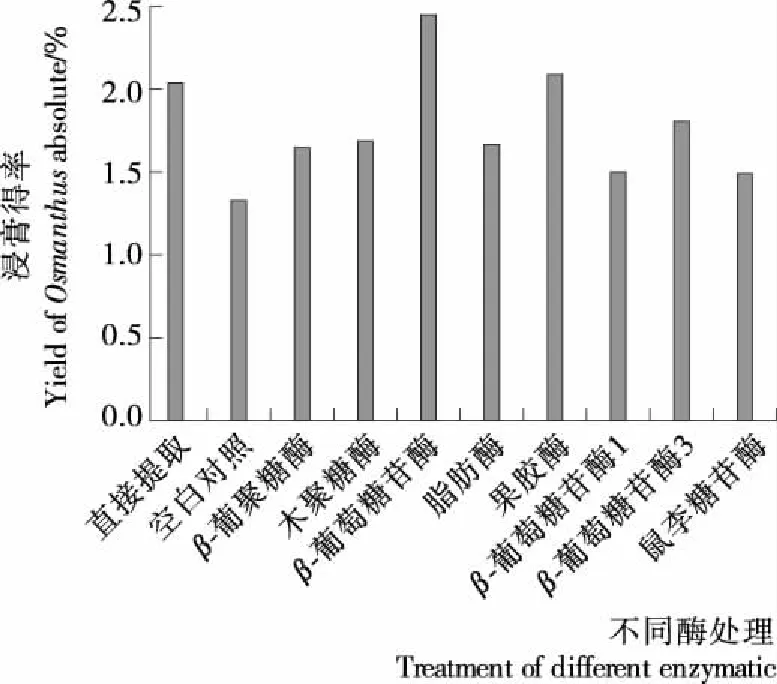
图1 多种酶处理对桂花浸膏得率的影响
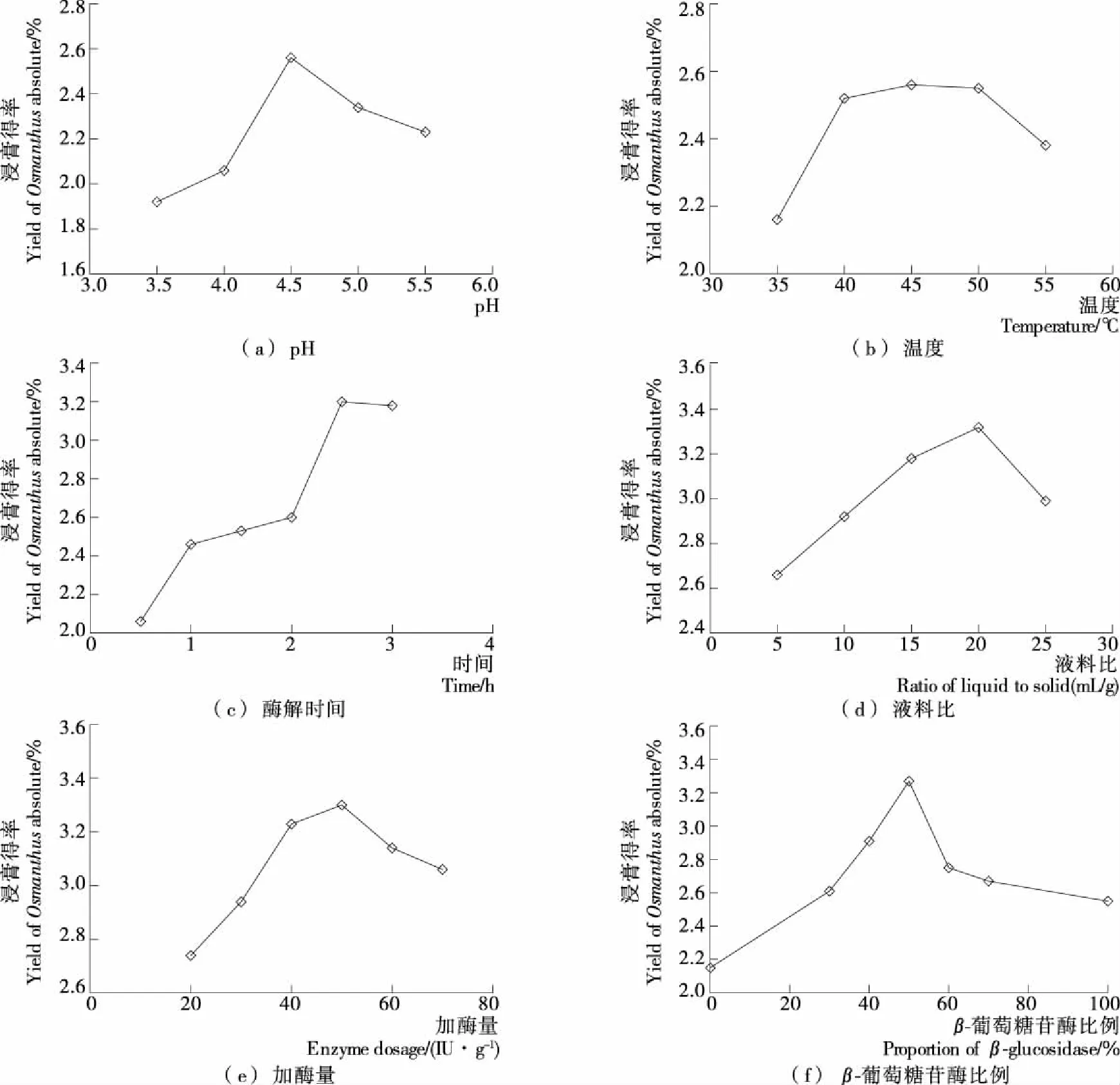
图2 各因素对桂花浸膏得率的影响
2.2.2 响应面试验优化复配酶水解提取桂花浸膏工艺条件
响应面试验设计的六因素三水平的试验条件见表1。响应面试验设计结果见表2。
运用Design-Expert V 8.0软件对表2的试验数据进行方差分析,结果分别见表3、4。由表3可以得出,模型P值<0.000 1,失拟项P值为0.158 2>0.1,所选模型显著,失拟项不显著,因此所选模型可靠。在试验考察的6个因素中,液料比、pH、处理时间、酶添加量以及复配酶中β-葡萄糖苷酶比例5个因素的P值<0.000 1,其对桂花浸膏得率影响均显著。而温度的P值为0.686 5>0.05,说明温度对桂花浸膏得率影响不显著,可能是与所使用的果胶酶以及β-葡萄糖苷酶的作用温度较为宽泛有关。
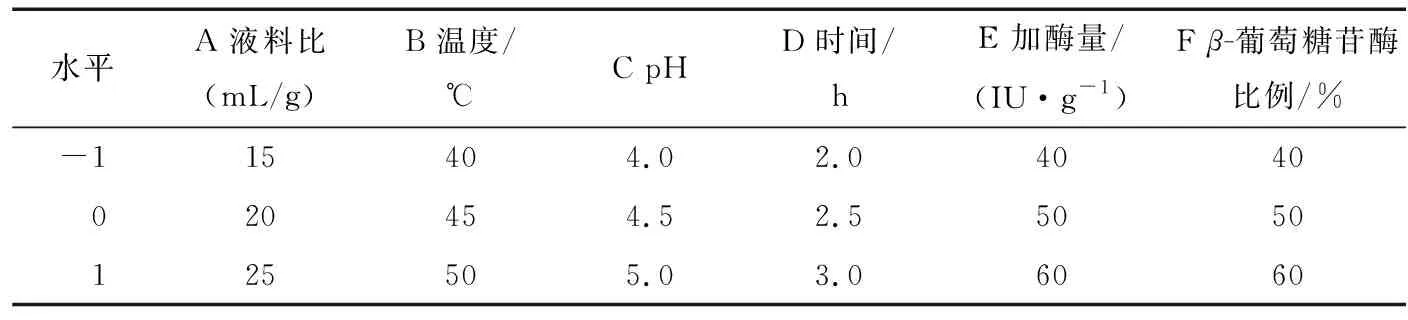
表1 响应面试验因素水平表
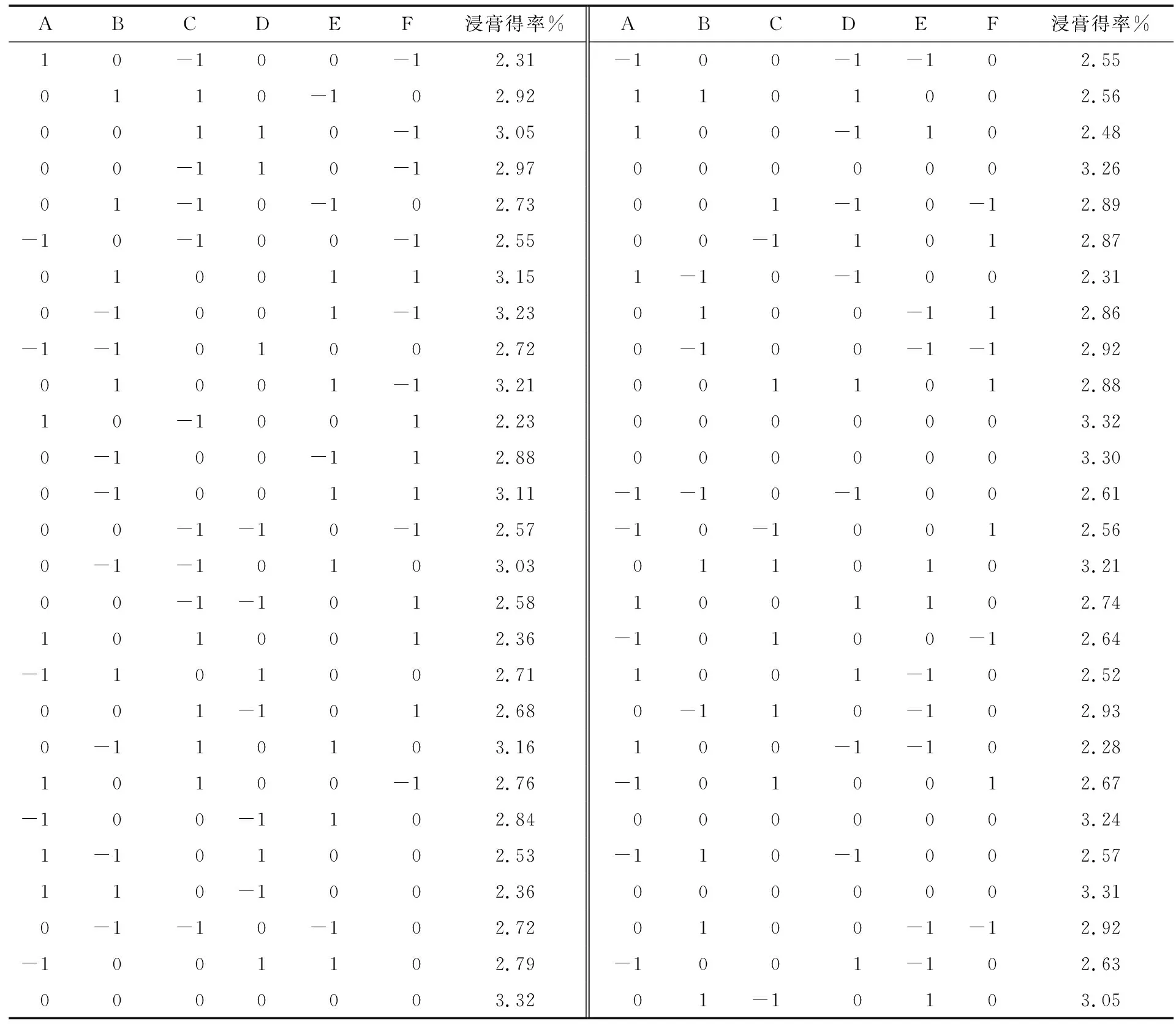
表2 响应面试验设计结果
由表4可以得出,模型的R2为0.986 7,R2校正为0.972 9,两个值较为接近,且信躁比为30.246>4,可知回归方程拟合度和可信度均较高,试验误差较小,故可用此模型对复配酶处理制备桂花浸膏的工艺条件进行优化与预测。
表2中的试验数据用Design-Expert V8.0软件进行多元回归拟合分析,忽略影响不显著因素,得复配酶法处理桂花所得桂花浸膏得率(Y)的多元二次回归方程为:
Y=3.29-0.10A+0.083C+0.094D+0.13E-0.050F+0.047AC+0.040AD-0.065AF-0.041CD-0.037CF-0.47A2-0.097B2-0.19C2-0.17D2-0.039E2-0.12F2。
(2)
根据回归方程,获得响应曲面图,选择交互影响显著的液料比-pH、液料比-时间、液料比-β-葡萄糖苷酶比例、pH-时间以及pH-β-葡萄糖苷酶比例对桂花浸膏得率的影响,见图3。
从图3可以看出,当液料比较小时,由于酶液对样品的浸润不足从而影响酶解的效果,所以在试验范围内改变pH、时间或β-葡萄糖苷酶比例,桂花浸膏得率的变化并不显著。而由于使用的复配酶中β-葡萄糖苷酶和果胶酶的最适pH存在一定的差异,所以pH-β-葡萄糖苷酶比例的交互影响就显得更为显著。随着复配酶中β-葡萄糖苷酶比例的增加,pH值越趋于其最适pH。但是过高的β-葡萄糖苷酶比例也降低了复配酶中果胶酶的比例,不利于浸膏物质的浸出。而较高的pH值虽然可以有效提高果胶酶的活性,但是会降低β-葡萄糖苷酶活性,从而减少了糖苷类前体物质的释放,降低浸膏得率。
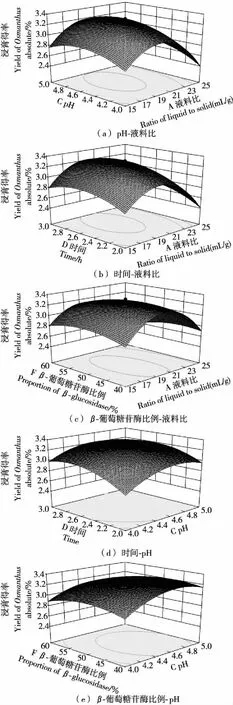
图3 pH-液料比、时间-液料比、β-葡萄糖苷酶比例-液料比、时间-pH、β-葡萄糖苷酶比例-pH交互影响响应曲面图
Figure 3 Response surface chart of reciprocal effect
利用软件对试验数据进行分析,可得模型最佳条件为:pH 4.7、酶解时间2.6 h、酶解温度46 ℃、液料比19.8∶1 (mL/g)、复配酶添加量54.4 IU/g、β-葡萄糖苷酶比例48.1%,桂花浸膏理论得率可达3.38%。实验按此最佳条件进行验证,经过3次平行实验所得桂花浸膏得率为3.32%,相对误差为-1.78%,实验值与模型预测值比较接近,可得出此模型可靠。
2.3 复配酶处理所得桂花浸膏香气物质含量变化
通过GC-MS对复合酶处理所得桂花浸膏及未经酶处理直接提取所得桂花浸膏进行了检测。GC-MS检测结果表明,鉴定出的化合物主要为醇类、脂肪酸及其酯类、烷烃类、烯烃类以及醛酮类。复合酶处理所得桂花浸膏共鉴定出有效成分60种,略高于直接提取的58种。且采用复配酶处理桂花与直接提取相比,浸膏中的组分发生明显的变化,其中脂肪酸及其酯类以及醇类化合物的数量均有所增加。陶清等[18]认为决定桂花香气品质的主要成分是醇类、脂肪酸及其酯类。采用β-葡萄糖苷酶和果胶酶复配处理桂花,有效提高桂花浸膏得率的同时也提高了桂花浸膏中醇类和脂肪酸及其酯类物质的数量,总体提升了浸膏的品质。
复配酶处理对桂花浸膏中主要香气物质含量的影响见图4。桂花浸膏中二氢芳樟醇、β-紫罗兰酮、γ-癸内酯、二氢-β-紫罗兰酮、β-紫罗兰醇等以游离态或无味的糖苷形式存在于植物组织中,具有浓郁的香气,是桂花主要呈香物质[19]。由图4可知,复配酶处理对桂花浸膏中的主要香气物质含量影响较大。桂花浸膏中二氢芳樟醇的含量由未经酶处理的0.55%提高到0.70%,增加了27.27%。β-紫罗兰醇、橙花叔醇未在对照试验中检出,但复配酶处理所得桂花浸膏中β-紫罗兰醇含量为0.87%,而橙花叔醇含量为0.22%。复配酶处理后桂花浸膏中γ-癸内酯、二氢-β-紫罗兰酮和β-紫罗兰酮的含量显著提高,与未经酶处理直接提取相比分别提高了116.36%,247.06%,100.00%。复配酶处理能显著提高浸膏中香叶醇的含量(P<0.05),与对照相比提高了72.84%,并将柠檬烯含量从0.28%提高到0.32%。由此可以得出,β-葡萄糖苷酶可以作用于结合态的糖苷前体物质,使之生成为游离的芳香物质,从而增加浸膏中主要香气物质的含量。而构成植物细胞壁胞间层、次生壁以及初生壁的主要成分是果胶质。将β-葡萄糖苷酶和果胶酶进行复配使用,β-葡萄糖苷酶水解释放桂花香气物质前体,果胶酶水解果胶质,增加了细胞壁的通透性,二者共同作用可以有效地浸出更多的呈香物质。
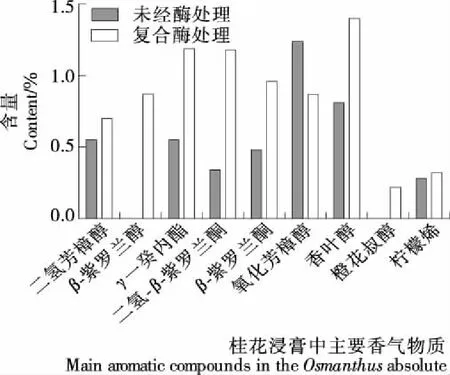
图4 复合酶处理对桂花浸膏主要香气物质含量的影响
3 结论
本研究在多种风味水解酶中优选,确定采用β-葡萄糖苷酶和果胶酶复配对桂花进行酶处理,获得桂花浸膏。在利用响应面试验建立六因素相互作用的数学模型,优化复合酶处理条件提高浸膏得率的同时,通过GC-MS联用仪检测分析了所得桂花浸膏主要香气物质的变化。试验结果表明,β-葡萄糖苷酶和果胶酶复配处理桂花制备桂花浸膏得率远高于单一酶处理和不经酶处理。复合酶处理所得桂花浸膏得率比直接提取提高了62.75%,提升幅度远高于汪海波等[7]使用单一酶处理制备桂花浸膏的。
此外,目前较多的工艺研究主要集中在工艺条件优化,提升产量方面,而对于所得桂花浸膏的品质较少涉及。本研究采用β-葡萄糖苷酶和果胶酶复配处理桂花制备桂花浸膏,在有效提高产量的同时还有效提升了桂花浸膏的品质。与直接提取相比,复合酶处理所得浸膏中呈香物质的数量显著提升,二氢-β-紫罗兰酮、γ-癸内酯、二氢芳樟醇、β-紫罗兰酮、柠檬烯以及香叶醇等主要香气物质的含量提升显著,分别提高了247.06%,116.36%,27.27%,100.00%,14.29%,72.84%。 本研究充分显示了β-葡萄糖苷酶和果胶酶复配在桂花浸膏制备中的应用潜力,值得进行进一步的中试放大研究,探索桂花浸膏制备新工艺。

