不同方法降解绿茶渣制备水溶性还原糖
孔莹莹刘 安许 伟张 拓龚志华肖文军,3
(1. 湖南农业大学茶学教育部重点实验室,湖南 长沙 410128;2. 湖南农业大学国家植物功能成分利用工程技术研究中心,湖南 长沙 410128;3. 湖南省植物功能成分利用协同创新中心,湖南 长沙 410128)
茶叶是中国主要经济作物之一,在浙江、云南、安徽、湖南等地多有种植。中国每年茶叶深加工消耗茶叶1.0×105~1.5×105t,占茶叶总产量的7%~9%[1],而日本、美国茶叶深加工占比已达到40%以上[2],说明中国茶叶深加工产业发展空间巨大,且深加工后的茶渣并未得到妥善处理。研究发现,深加工后的茶渣仍残留17%~19%的粗蛋白、16%~18%的粗纤维[3],可做肥料、饲料和吸附剂,可从中提取利用蛋白、茶多糖[4]。其中,将茶渣纤维素转化为燃料乙醇不仅能减少环境污染,还可缓解能源危机[5]。近期研究[6]发现Co60辐照可使油菜秸秆的纤维素发生链剪切和交联反应,降解纤维素;碱处理玉米秸秆,可使纤维素的氢键断裂[7];孙万里等[8]发现酸处理水稻秸秆能脱除木质素、半纤维素,使糖得率提高;彭资等[9]发现酸能促进辐照芒草纤维素降解糖化。然而,目前相关研究主要是以农作物秸秆为原料,鲜有对茶渣降解糖化的研究。已有研究[10]表明茶渣可用纤维素酶解,提取蛋白和还原性糖,但还原糖得率较低。以上研究拟主要使用单一技术降解,而非多种方法综合降解。因此本研究拟以茶渣为原料,分别采用Co60辐照、氢氧化钠、硝酸处理,并通过3,5-二硝基水杨酸法测定水溶性还原糖的得率,探讨不同降解方法的效果,以期为茶叶深加工中茶渣的开发利用提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
茶渣:为中小种绿茶在茶水比1∶15 (g/mL)、95 ℃下提制30 min后的水提残渣,于70 ℃烘箱中烘干,粉碎,过40目筛。经检测,茶渣中有15.05%纤维素、4.21%果胶、1.76% 水溶性还原糖,含水量为4.73%;
乙二胺四乙酸二钠、硼酸钠、十二烷基硫酸钠、乙二醇乙醚、无水磷酸氢二钠、浓硫酸、十六烷三甲基溴化铵、无水亚硫酸钠、氰化萘、丙酮、无水草酸氨、氨水、乙醇、盐酸、氢氧化钠、冰乙酸、无水氯化钙、葡萄糖标准物质、3,5-二硝基水杨酸、苯酚、酒石酸钾钠、浓硝酸:分析纯,国药集团化学试剂有限公司。
1.1.2 仪器
电子天平:FA2104S型,上海精科天美仪器有限公司;
循环水式真空泵:SHZ-D(Ⅲ)型,浙江黄岩求精真空泵厂;
电热鼓风干燥箱:101A-2型,上海实验仪器总厂;
恒温水浴锅:HH数显型,金坛市金城国胜实验仪器厂;
可见光光度计:722E型,上海光谱仪器有限公司。
1.2 降解方法
1.2.1 辐照降解 选择Co60为辐照源,将烘干后的茶渣以200,600,800,1 000,1 200 kGy的辐照剂量进行辐照降解,优选水溶性还原糖得率高的辐照剂量。
1.2.2 碱降解 以水溶性还原糖得率为指标,取1 g茶渣按1∶30 (g/mL)固液比降解。
(1) 分别用0.03,0.05,0.07,0.09,0.11 mol/L的氢氧化钠降解,降解温度均为80 ℃,降解时间均为90 min。
(2) 分别在60,70,80,90,100 ℃的温度下,均用0.05 mol/L 氢氧化钠降解,降解时间均为90 min。
(3) 分别降解1,2,3,4,5 h,均用0.05 mol/L氢氧化钠降解,降解温度均为80 ℃。
(4) 以氢氧化钠浓度、降解温度、降解时间为考察因子进行L9(33)正交试验。
1.2.3 酸降解 以水溶性还原糖得率为指标,取1 g茶渣按1∶30 (g/mL)固液比降解。
(1) 分别用5%,7%,9%,11%,13%的硝酸降解,降解温度均为85 ℃,降解时间均为90 min。
(2) 分别在60,70,80,90,100 ℃的温度下,均用5%的硝酸降解,降解时间均为90 min。
(3) 分别降解0.5,1.0,1.5,2.0 h,均用5%的硝酸降解,降解温度均为85 ℃。
(4) 将硝酸浓度、降解温度、降解时间为考察因子进行L9(33)正交试验。
1.2.4 辐照预处理+碱降解+酸降解 分别取1 g各剂量辐照后的茶渣,先按最佳碱降解工艺组合进行降解,再采用最佳酸降解工艺组合进行降解,检测水溶性还原糖得率,获得最优辐照降解+碱降解+酸降解绿茶水提茶渣制备水溶性还原糖的工艺技术组合。
1.3 理化指标测定方法
1.3.1 茶渣纤维素测定 参照文献[11]。
1.3.2 茶渣果胶测定 按GB/T 10742—2008的重量法执行。
1.3.3 茶渣水溶性还原糖测定 参照文献[12]。
1.3.4 茶渣中水分测定 按GB/T 8304—2013的120 ℃茶叶烘干法执行。
1.3.5 水溶性还原糖得率计算 根据式(1)计算水溶性还原糖得率。
(1)
式中:
R——水溶性还原糖得率,%;
m——茶渣降解后滤液中的水溶性还原糖量,g;
M——茶渣的样重,g;
W——试样含水量,%。
2 结果与分析
2.1 辐照处理对茶渣水溶性还原糖的影响
由图1可知,辐照吸收量高于200 kGy时,辐照可降解茶渣生成水溶性糖,并且辐照吸收量越大,生成水溶性糖越多。辐照吸收量为1 000 kGy时,纤维素降解为水溶性糖后,发生分子内脱水生成呋喃类物质,因此水溶性糖得率偏低。辐照吸收量为1 200 kGy时,纤维素最大程度裂变降解,水溶性糖得率最高,为4.13%。由此可知在一定辐照剂量范围内,辐照剂量越大,得率越高,说明高能辐照能降低纤维素聚合度[13],使大分子的纤维素降解为小分子物质。
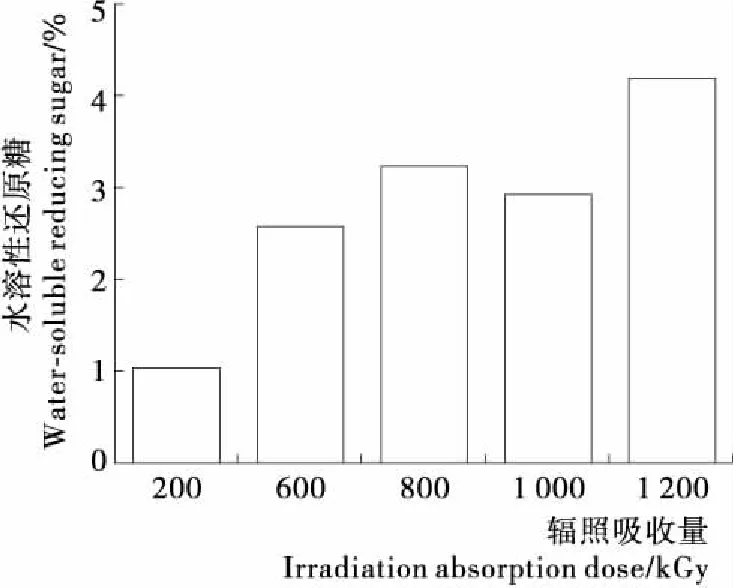
图1 辐照后茶渣中水溶性还原糖得率
Figure 1 The yield of water-soluble reducing sugar in tea residue with irradiation absorption
2.2 碱降解绿茶渣制备水溶性还原糖的效果
2.2.1 氢氧化钠浓度对水溶性还原糖得率的影响 纤维素与氢氧化钠形成Na-cellulose复合结构,在碱的水合离子作用下溶解[14]。由图2可知,在氢氧化钠浓度为0.05 mol/L时,水溶性糖得率最高。随浓度的增加,碱纤维吸附多余的氢氧化钠,水溶性糖得率降低。当浓度为0.03 mol/L时,降解前与降解后的还原糖含量相同,说明浓度过低的氢氧化钠无法达到降解茶渣效果,因此选用0.05,0.07,0.09 mol/L的氢氧化钠溶液进行正交试验。
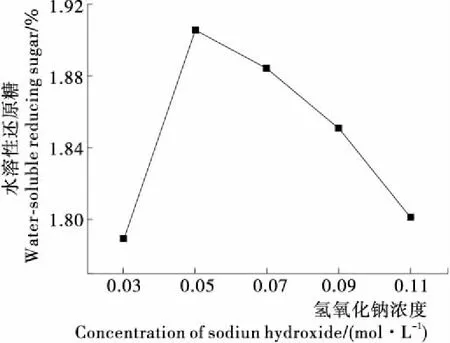
图2 氢氧化钠浓度对水溶性还原糖得率的影响
Figure 2 The effect of concentration of sodiun hydroxide on the yield of water-soluble reducing sugar
2.2.2 氢氧化钠降解温度对水溶性还原糖得率的影响 由图3发现,温度低于90 ℃,水溶性还原糖得率随温度的增高而增加;降解温度高于90 ℃,产物糖与蛋白质水解产生的氨基酸发生美拉德反应,水溶性还原糖得率随温度的升高而降低。
2.2.3 氢氧化钠降解时间对水溶性还原糖得率的影响 在图4中,降解时间在1 h内,随降解时间的延长,水溶性还原糖得率增加。降低时间长于1 h,由于蛋白质大部分溶于溶液[15],与产物糖发生反应的机率增大,使水溶性糖减少。为减小蛋白质水解产生的氨基酸对水溶性还原糖得率的影响,选用0.5,1.0,1.5 h进行正交试验。降解时间超过2 h后,随降解时间的延长,水溶性糖得率稍有增加。
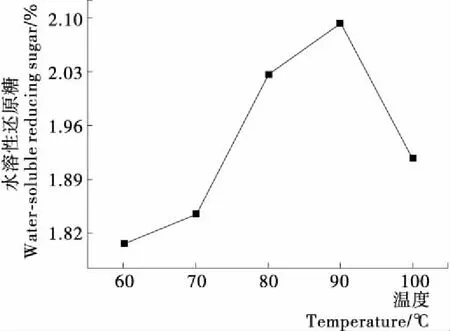
图3 氢氧化钠降解温度对水溶性还原糖得率的影响
Figure 3 The effect of sodiun hydroxide degradation temperature on the yield of water-soluble reducing sugar
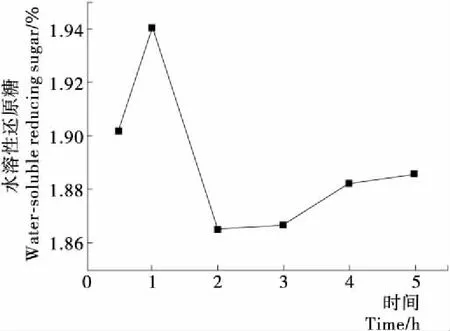
图4 氢氧化钠降解时间对水溶性还原糖得率的影响
Figure 4 The effect of sodiun hydroxide degradation time on the yield of water-soluble reducing sugar
2.2.4 氢氧化钠降解的正交试验 在单因素试验基础上,进行L9(33)正交试验。正交试验因素及水平见表1,正交试验结果见表2。
由表2可知,各因子对水溶性还原糖影响的主次顺序为氢氧化钠浓度>降解时间>降解温度,在最优工艺技术组合下,即用0.05 mol/L的氢氧化钠溶液于90 ℃降解1 h后,水溶性糖得率最高,为2.08%,说明碱可使纤维素分子发生润涨降解[16]。
表1 氢氧化钠降解的各因素正交试验水平
Table 1 Factors and levels of orthogonal experiment of sodium hydroxide degradation
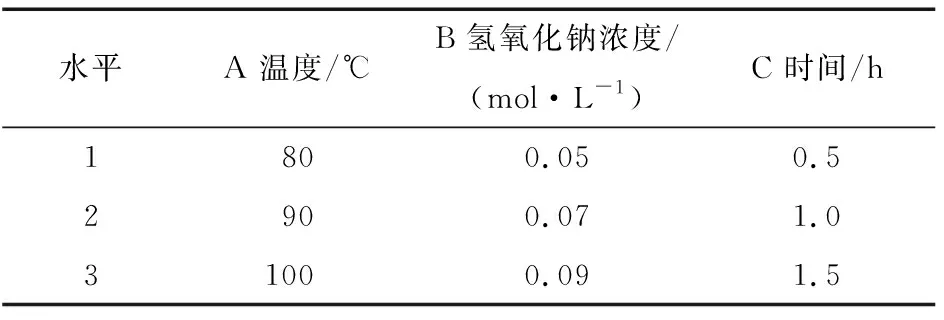
水平A 温度/℃B 氢氧化钠浓度/(mol·L-1)C 时间/h1800.050.52900.071.031000.091.5
表2 氢氧化钠溶液降解的正交结果
Table 2 The result of orthogonal experiment of sodiun hydroxide degradation

试验号ABC含量/%11111.9121221.8431331.8742122.0852231.8062312.0273131.9383211.8593322.01K11.871.981.93K21.971.831.98K31.931.971.87R0.100.150.11
2.3 酸降解绿茶渣制备水溶性还原糖的效果
2.3.1 硝酸浓度对水溶性还原糖得率的影响 由图5可知,硝酸降解浓度为9%时,水溶性还原糖得率最高。因为硝酸浓度低于9%时,硝酸浓度越高,则氢离子浓度越高,对纤维素结构的破坏力更强,水溶性还原糖得率增加;当浓度高于9%时,水溶性还原糖在硝酸作用下生成糠醛、有机酸等副产物,得率降低,且硝酸浓度太高,受热分解产生的NO2增多,污染环境。

图5 硝酸浓度对水溶性还原糖得率的影响
Figure 5 The effect of the concentration of nitric acid on the yield of water-soluble reducing sugar
2.3.2 硝酸降解温度对水溶性还原糖得率的影响 由图6可知,温度高于80 ℃的得率较高,当降解温度低于80 ℃时,缺少足够的能量使纤维素的氢键断裂,水溶性还原糖得率明显偏低。
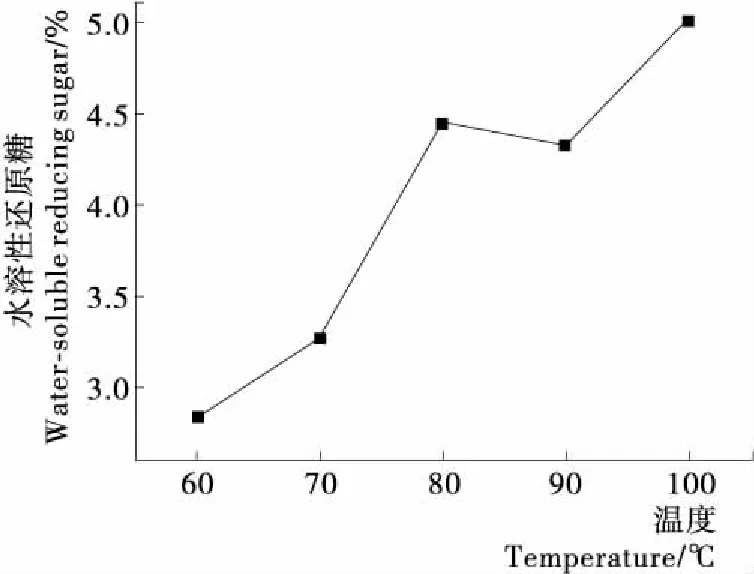
图6 硝酸降解温度对水溶性还原糖得率的影响
Figure 6 The effect of nitric acid degradation temperature on the yield of water-soluble reducing sugar
2.3.3 硝酸降解时间对水溶性还原糖得率的影响 由图7发现,随降解时间的延长,纤维素降解率越高,还原糖得率越高。但纤维素降解的同时,伴随着水溶性还原糖的降解,因此随时间的延长,糖的增长速率减小。
2.3.4 硝酸降解的正交试验 在单因素试验基础上,进行L9(33)正交试验。正交试验因素及水平见表3,正交试验结果见表4。
由表4可知,各因子影响水溶性还原糖的主次顺序为处理温度>处理时间>硝酸浓度。最优的工艺技术组合为9%硝酸在100 ℃下降解2 h,未出现在正交组合中,需进行验证实验。取茶渣按最优条件降解,水溶性还原糖得率为(10.57±0.24)%,高于正交表中任一组合,符合正交分析结果。
2.4 辐照预处理+碱降解+酸降解绿茶渣制备水溶性还原糖的效果
由图8可知,在不同方法组合降解中,辐照吸收量低于1 000 kGy 时,辐照吸收量越大,木质素和半纤维素的降解率越大,从而水溶性还原糖得率越高。辐照吸收量为1 200 kGy 时,部分纤维素已降解成呋喃类物质,剩余的纤维素经过碱降解+酸降解,生成的水溶性还原糖偏少。辐照吸收量1 000 kGy时纤维素结构被充分破坏,且二次降解少,因此降解效果最优。取辐照量为1 000 kGy的茶渣用最优碱降解工艺降解,再用最优酸降解工艺降解,进行3次平行试验得水溶性还原糖得率为(13.18±0.14)%,说明不同方法组合降解效果最优且方法稳定。组合降解中,辐照降解破坏纤维素与木质素、蛋白质构成聚合液晶结构[17],碱降解使纤维素分子发生润涨,增大酸与纤维素接触面。

图7 硝酸降解时间对水溶性还原糖得率的影响
Figure 7 The effect of nitric acid degradation time on the yield of water-soluble reducing sugar

表3 硝酸降解的各因素正交试验水平

表4 硝酸降解的正交试验结果
比较图1与图8可知,组合降解明显优于单一降解。辐照后的茶渣经过碱、酸降解后,水溶性还原糖得率明显增加,说明辐照降解的机理与酸碱降解机理不同。组合降解效果的大小不是单一降解效果的简单叠加,所以组合降解实际效果可能与理论效果不同。
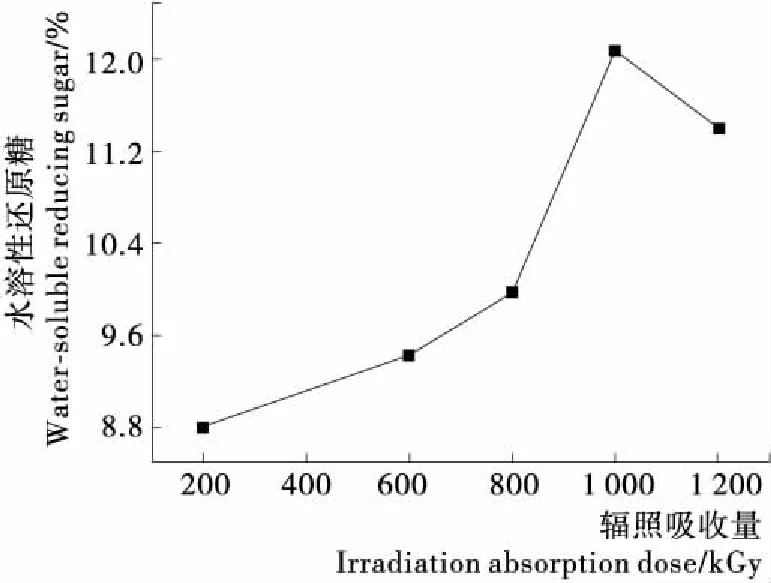
图8 辐照吸收量对不同方法组合降解水溶性
Figure 8 The effect of irradiation absorption dose on the yield of soluble reducing sugar with degradation of different method combination
3 结论
不同降解方法的水溶性还原糖得率由高到低依次为:不同方法组合降解>酸降解>辐照降解>碱降解。其中,辐照降解在辐照吸收量为1 200 kGy时降解效果最佳,为4.13%;碱降解的最佳工艺组合为用0.05 mol/L氢氧化钠于90 ℃降解1 h,水溶性还原糖得率为2.08%;酸降解的最佳工艺组合为用9%硝酸于100 ℃降解2 h,水溶性还原糖得率为10.57%。将绿茶茶渣先进行1 000 kGy的辐照预处理,然后用0.05 mol/L的氢氧化钠于90 ℃处理1 h,再用9%的硝酸于100 ℃处理2 h,水溶性还原糖得率可达13.18%,即采用1 000 kGy辐照预处理+最佳碱降解+最佳酸降解的组合工艺是利用绿茶茶渣制备水溶性还原糖的最优工艺技术。

