S.Heidelberg血清型特异性基因筛选及PCR检测方法的建立与应用
翟立公 郭元新 王俊颖 王蓓蓓
(安徽科技学院,安徽 滁州 233100)
沙门氏菌(Salmonella)属于肠杆菌科的革兰氏阴性菌,是公认的重要食源性致病菌之一[1]。近年来中国沙门氏菌在畜禽制品中检出率高达20%,相比欧美地区形势更为严峻[2-4]。虽然沙门氏菌的血清型较多,已经达到2 600多种,但污染食品并且造成食源性疾病的主要集中在肠炎沙门氏菌亚种的部分血清型当中。经研究[5-6]发现,食品中污染沙门氏菌的血清型根据地域、年份和食品种类不同而存在变化。据报道[1,7],深圳地区鸡肉中德比沙门氏菌和海德尔堡沙门氏菌(SH)检出率较高,分别达到37.9%和20.7%;广西地区水产品中海德尔堡沙门氏菌(SH)检出率为1.35%。因此,针对沙门氏菌优势血清型的检测具有更重要的意义。
针对沙门氏菌血清型的检测,目前主要采用传统培养的方法(GB/T 4789.4—2016),包括增菌培养、选择性增菌培养、显示培养、生化鉴定和血清型分型,需经过7 d左右才能获得检测报告,很难满足现今社会的需要,如果血清的特异性不强或凝集反应较为迟缓,将会对分型造成极大的影响[8]。利用分子检测技术(PCR)一般能在1~2 d内获得结果,而且具有操作过程简单、成本低、检测结果容易判断等优势[9-10]。对于食源性致病菌的分子检测技术来说目的靶点的特异性就成为检测效果的核心问题。Collette Fitzgerald等[11]利用沙门氏菌O抗原合成rfb基因簇的各基因为靶点,建立了沙门氏菌血清群和甲型副伤寒沙门氏菌的PCR的检测技术,经验证准确率达到94.3%。由于沙门氏菌的抗原结构呈现多样性,以此作为靶点对血清型的鉴定需要设计多对引物或多个PCR程序,将造成引物之间的干扰,影响整个体系的检测灵敏度。有研究[12]报道可以通过微生物基因组信息及比较基因组方法筛选目的菌株的特异性基因作为检测靶点。该种方法获得靶基因较为准确,而且在沙门氏菌其他血清型的检测过程中已经被应用。Yin Ngan等[13]利用该方法获得了甲型副伤寒沙门氏菌的血清型特异性基因,并以此为靶点设计多重PCR检测体系。随着生物信息学的不断发展,美国国立生物技术信息中心(NCBI)公布的沙门氏菌不同血清型的全基因组序列越来越多,更有利于沙门氏菌血清型特异性基因的筛选。
沙门氏菌是一类常见的食源性致病菌,随着近年来对沙门氏菌污染状况和血清型调查[3-4]发现,沙门氏菌污染事件大多均是一个或几个血清型的污染爆发为主,其中SH为禽蛋肉奶制品的优势血清型,而且该血清型的分子检测靶点尚未被报道。本研究拟以S.Heidelberg(SH)为研究对象,利用GenBank数据库中的SH菌株基因组信息及BLAST系统,筛选SH血清型特异性基因,并以此为检测靶点建立SH检测的PCR体系。为SH在食品中的快速检测和疫情爆发的追溯提供技术支持。
1 材料与方法
1.1 材料与仪器
营养肉汤、营养琼脂培养基等:北京陆桥技术股份有限公司;
Genview细菌基因组DNA提取试剂盒(GV-B-DNA-50):广州鼎国生物技术有限公司;
DNA标准分子量DS2000、Taq DNA聚合酶和2×Taq Master:广州东盛生物科技有限公司;
引物:上海生工生物工程有限公司;
牛奶及其制品:市售;
PCR扩增仪:Life Touch型,杭州博日科技有限公司;
数码凝胶成像分析仪:JS-1075型,上海培清科技有限公司;
二级生物安全柜:BSC-1100ⅡA2-X型,济南鑫贝西生物技术有限公司;
本试验共涉及55株菌株(包括44株不同血清型的沙门氏菌和11株非沙门氏菌):菌株来源及数量见表1。
1.2 试验方法
1.2.1 特异性基因筛选 从NCBI(National Center for Biotechnology Information)获取SH血清型SL476菌株(NC_011083.1)的全基因组序列数据。对SH的每个基因编码序列进行BLASTN核酸序列对比,与沙门氏菌目的血清型不同菌株的同源性完全一致,并且在其他生物中不具有同源性的基因编码序列为SH的准特异性基因。基因BLASTN比对过程中,当Query cover(覆盖率)值为100%,同时E值趋近于0(E值<10-200)时,作为SH的血清型准特异性基因。
1.2.2 DNA提取 按照细菌基因组DNA提取试剂盒(DP302)说明书操作和热裂解法[14]提取微生物基因组DNA,并将获取的基因组DNA置于-20 ℃ 冰箱保存备用。
1.2.3 SH血清型特异性引物设计及验证 以获得SH的准特异性基因作为模板,设计引物(Oligo 6.0和Primer 5.0等软件)。要求引物自身无发夹结构,引物之间不形成二聚体结构,引物扩增的目的产物长度在1 000 bp以下,上下游引物的退回温度接近且为60 ℃左右,BLASTN验证所选引物的特异性,作为SH血清型的特异性引物。
PCR反应体系(25 μL):2×Taq Master 12.5 μL、上下游引物(10-5mol)各1 μL、TaqDNA聚合酶(2.5 U/μL)0.5 μL、模板(表1中55株菌株)1 μL、ddH2O 9 μL;
PCR反应程序:95 ℃预变性5 min; 95 ℃ 30 s,60 ℃ 30 s,72 ℃ 45 s,30个循环; 72 ℃后延伸10 min。
1.2.4 SH血清型特异性引物灵敏度评价 提取SH的基因组DNA测定浓度,并进行10倍梯度稀释,达到10-8的稀释度。每个稀释度取1 μL作为模板,以上述引物进行PCR扩增,验证各个引物的灵敏度。
1.2.5 建立SH血清型PCR检测体系 将获得特异性和灵敏度均较好的SH血清型特异性引物与沙门氏菌属特异性引物139-141共同建立SH血清型PCR检测体系(优化过程略)。最终确定PCR的反应体系为:2×Taq Master 12.5 μL、TaqDNA聚合酶(2.5 U/μL)1 μL、模板3 μL、ddH2O 2.5 μL、引物139-141(10-5mol)各1.5 μL和引物pHAm8 (10-5mol)各1.5 μL。优化后的PCR反应条件:94 ℃ 预变性10 min; 94 ℃ 30 s,60 ℃ 30 s,72 ℃ 60 s,30个循环; 72 ℃后延伸10 min。PCR产物通过2.0%的琼脂糖凝胶进行电泳。
1.2.6 特异性和菌落灵敏度评价 提取沙门菌属内各血清型菌株和常见非沙门菌-食源性致病菌的全基因组DNA,并以此为模板,使用SH血清型检测PCR体系进行扩增,验证其特异性。
将SH接种到LB液体培养基上,37 ℃培养12 h,平板菌落计数获得菌液的初始浓度。通过无菌的生理盐水进行10倍梯度稀释,各稀释度取1 mL,利用热裂解法提取基因组DNA作为模板,验证PCR检测体系的灵敏度。
1.2.7 抗干扰性评价 选取与沙门菌同源性较高的属外大肠杆菌ATCC35150及SH血清型同一血清群的鼠伤寒沙门菌CMCC51005作为检测体系的干扰菌。过夜培养,通过平板菌落计数法获得2种菌液的初始浓度,浓度梯度稀释到N×105~N×101CFU/mL,并分别与浓度为N×102CFU/mL 的SH菌共同接种于LB培养基中,37 ℃培养10 h,提取基因组DNA进行PCR验证,电泳判断PCR检测体系抗杂菌的干扰能力。
1.2.8 人工污染样品检测 过夜培养SH(CICC21487),采用平板菌落计数法获得菌液的初始浓度,生理盐水进行10倍梯度稀释,将不同稀释度的菌液,各取1 mL转接入24 mL 牛奶样品(市售,无菌),混匀,再转入225 mL LB液体培养基中,37 ℃增菌分别培养6,8,10 h,分别提取基因组DNA,进行检测。
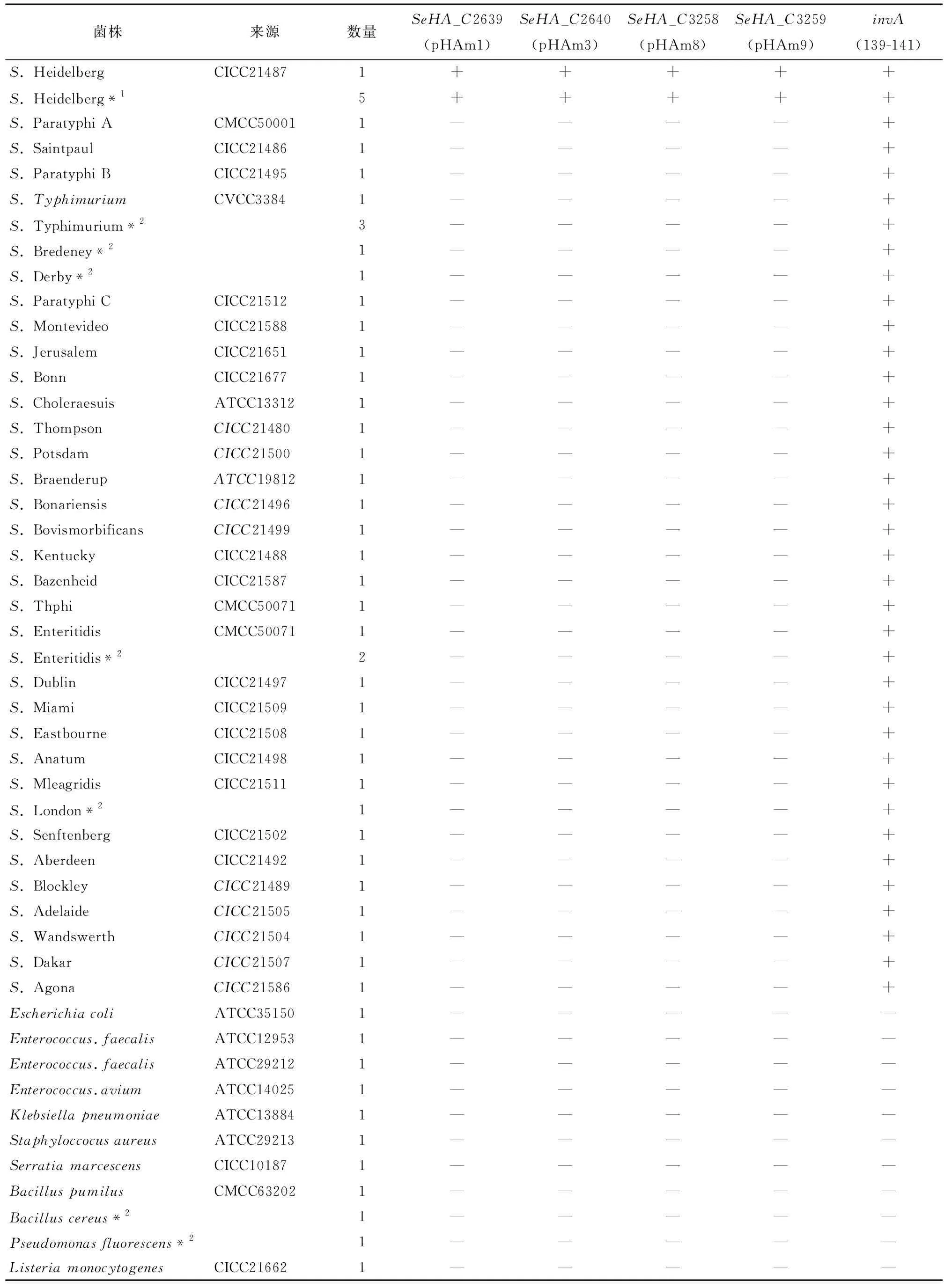
表1 试验菌株及引物特异性检测结果†
† *1实验室分离的S. Heidelberg ;*2实验室分离的非S. Heidelberg。
2 结果与分析
2.1 SH血清型特异性基因筛选及相关引物灵敏度评价
通过BLASTN系统对SH的全基因组序列数据进行分析,并通过PCR验证(表1),最终鉴定4个SH血清型特异性基因(表2)。通过分析以上基因的功能注释,发现4 个基因编码的蛋白均具有生物学活性,无编码假设蛋白。
以上述4个基因为模板分别设计SH血清型DNA检测引物,引物序列见表2。提取过夜培养的SH(CICC21487)基因组DNA,无菌水梯度稀释,各稀释度取1 μL,相同条件下进行PCR扩增,比较不同引物的模板灵敏度。图1表明,pHAm1和pHAm9引物的DNA灵敏度为14 pg/μL,pHAm3引物的为1.4 pg/μL;当模板浓度达到140 fg/μL 时,只有pHAm8引物能获得目的条带。因此,选取pHAm8引物作为SH血清型PCR检测特异性引物。

表2 引物序列及PCR产物大小
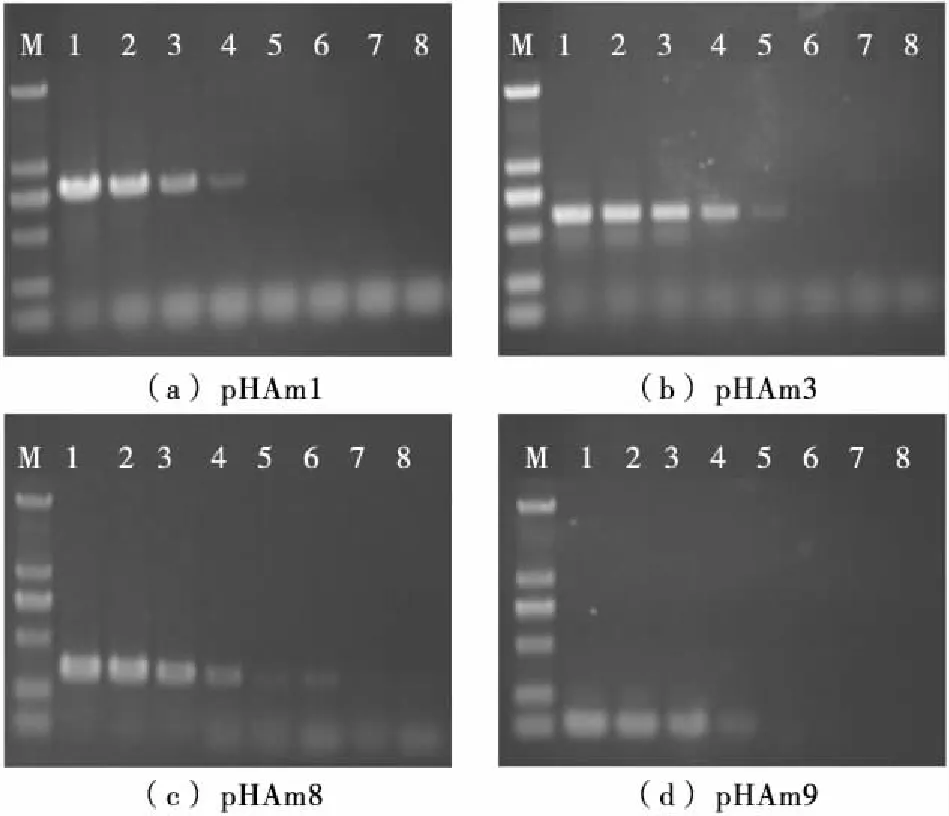
M. DS2000(100,250,500,750,1 000,2 000 bp) 1. 14 ng/μL 2. 1.4 ng/μL 3. 140.0 pg/μL 4. 14.0 pg/μL 5. 1.4 pg/μL 6. 140.0 fg/μL 7. 14.0 fg/μL 8. 1.4 fg/μL
图1 PCR检测海德尔堡沙门氏菌(DNA)灵敏度
Figure 1 Detection sensitivity (DNA) of PCR forS. Heidelberg
2.2 SH血清型PCR检测特异性评价
将实验室保存的44株沙门菌和11株非沙门菌提取全基因组DNA进行PCR检测,对该体系的特异性进行验证,结果见图2和表1。结果表明,当检测样品中有SH菌时,能同时获得2条扩增条带(284,350 bp);当检测非SH的沙门菌时,只能得到284 bp的扩增条带;当检测非沙门氏菌时,无任何PCR扩增条带产生。该结果与Park等[15]报道的结果一致,对SH均能表现较好的特异性,但检测体系中涉及的引物及检测靶点均不一样。

M. DS2000(100,250,500,750,1 000,2 000 bp) 1~34.S. Heidelberg、S. Choleraesuis、S. Typhimurium、S. Typhi、S. Enteritidis、S. Paratyphi A、S. Paratyphi B、S. Paratyphi C、S. Dublin、S. Thompson、S. Anatum、S.Senftenberg、S. Arizonae、S. Potsdam、S. Aberdeen、S. Bovismorbificans、S. Meleagridis、S. London、S. Braenderup、S. Bredeney、S. Saintpaul、S. Heidelberg、S. Kentucky、S. Blockley、S. Bonariensis、S. Wandsworth、S. Adelaide、S. Dakar、S. Eastboure、S. Miami、S. Agona、S. Bazenheid、S. Montevideo、S. Jerusalem、S. Bonn
图2 双重PCR检测特异性
Figure 2 Specificity of double PCR for detectingSalmonellastrains
2.3 SH血清型PCR检测灵敏度评价
将过夜培养的SH菌液,用无菌水进行梯度稀释得到浓度为6.1×106~61 CFU/mL的稀释液。各梯度取1 mL菌悬液,提取基因组DNA,在最优PCR体系下进行扩增(图3)。结果表明,该PCR反应体系中pHAm8引物对SH的检测为6.1×102CFU/mL,139-141引物对沙门菌的检测限能达到61 CFU/mL。
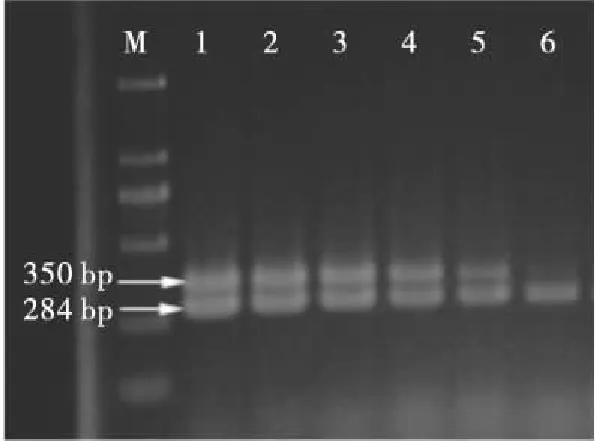
M. DS2000(100,250,500,750,1 000,2 000 bp) 1~6. SH菌液浓度分别为6.1×106,6.1×105,6.1×104,6.1×103,6.1×102,6.1×101CFU/mL
图3 双重PCR检测体系活菌灵敏度
Figure 3 Sensitivity of double PCR for detection of viable cells
2.4 SH血清型PCR检测抗干扰能力评价
为检测该双重PCR反应体系在干扰菌存在时的扩增效果,取不同浓度的鼠伤寒沙门氏菌(CMCC51005)和大肠杆菌(ATCC35150)作为干扰菌与SH共同培养,再提取基因组DNA进行PCR验证。将鼠伤寒沙门氏菌和大肠杆菌分别稀释为3.2×105~3.2×101CFU/mL和6.9×105~6.9×101CFU/mL,每个稀释度中分别接入浓度为7.4×102CFU/mL 的SH菌悬液,37 ℃培养8 h,提取混合菌液的DNA进行PCR检测,结果见图4。当鼠伤寒沙门菌和大肠杆菌的浓度在所取菌悬液浓度范围时,该反应体系的双重PCR结果的2对引物(139-141和pHAm8)均可获得清晰的目的条带产物,不会影响最终检测结果的判断。表明该双重PCR检测体系针对于大肠杆菌和鼠伤寒沙门菌具有一定的抗干扰能力。

1~5. 鼠伤寒沙门氏菌菌液浓度分别为3.2×105,3.2×104,3.2×103,3.2×102,32 CFU/mL 6~10. 大肠杆菌菌液浓度分别为6.9×105,6.9×104,6.9×103,6.9×102,69 CFU/mL
图4 双重PCR抗干扰性评价
Figure 4 Anti-interfence of double PCR for detection ofS. Heidelberg
2.5 SH血清型PCR检测人工污染评价
将过夜培养的SH菌悬液,梯度稀释为1.52×104~1.52 CFU/mL 等浓度,每个稀释度各取1 mL接入市售牛奶(24 mL),再转接到225 mL TSB液体培养基中分别进行6,8,10,12 h的增菌培养,试剂盒法提取基因组DNA,PCR扩增进行检测,结果见图5。当扩大培养6 h时,初始含菌量为1.52×102CFU/mL的牛奶样品中能够检测出SH;牛奶样品初始SH污染量为1.52 CFU/mL,需增加培养8 h以上才能获得阳性检测结果。该反应体系在牛奶样品中的检测限略低于Kim等[16]针对于沙门氏菌多个血清型建立的多重RT-PCR检测体系在食品样品中的检测限。
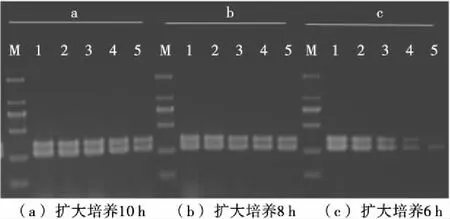
1~5. SH菌液浓度分别为1.52×104,1.52×103,1.52×102,15.2,1.52 CFU/mL
图5 人工污染牛奶样品SH双重PCR检测结果
Figure 5 Detection results of artificially contaminated milk ofS. Heidelberg
3 结论
本研究利用分子信息学和比较基因组技术,筛选到了4个SH的血清型特异性基因,分别是SeHA_C2639、SeHA_C2640、SeHA_C3259和SeHA_C3258。同时SeHA_C3258作为SH血清型特异性基因设计引物pHAm8(扩增350 bp)和沙门氏菌属特异性引物139-141(284 bp)共同建立SH检测的双重PCR检测方法。通过对该检测方法的特异性、灵敏度、抗干扰能力和人工污染评价,表明该方法具有较高的灵敏度和特异性,相较于传统培养方法能够节省大量的成本和时间,具有较好的应用价值。但随着现代食品工业的快速发展,对微生物检测的时效性和现场检测的要求越来越高,利用筛选的靶基因建立更快速的核酸恒温扩增检测技术将是未来的发展方向。

