WIF1在宫颈癌中的表达及其对宫颈癌细胞生物学行为的影响
郑小妹,林叶飞,张韶琼,陈曼玲
(海南医学院第一附属医院妇科,海口 570000)
宫颈癌是一种常见的妇科恶性肿瘤,近些年来发病率逐年上升,并呈现年轻化[1-2]。目前研究表明,人乳头瘤病毒(HPV)感染是宫颈癌发生的危险因素,但宫颈癌的发生机制尚不明确,其中基因表达异常引起的信号通路紊乱是宫颈癌发生、发展的重要原因[2-3]。Wnt是从乳头瘤病毒诱导的小鼠乳腺癌中发现的一种与胚胎发育密切相关的基因,其所介导的信号通路参与机体胚胎发育的全过程[4]。Wnt信号通路通过经典和非经典两条信号通路在细胞的生长、分化、凋亡等过程中发挥着重要作用,特别是在肿瘤组织中处于异常激活的状态[5-6]。而且越来越多研究显示Wnt信号通路的抑制因子沉默可能是引起Wnt信号激活的重要原因[7]。WIF1作为Wnt信号通路的分泌性拮抗因子,与信号通路蛋白Wg和XWnt8有较高的亲和力,因此在众多肿瘤组织或细胞系中低表达,并与肿瘤的发生、发展密切相关[7-9]。但是对于WIF1在宫颈癌中的表达及相关机制尚少见报道,因此本研究将对此展开探讨,以期进一步的阐明宫颈癌的发生机制,为宫颈癌的基因治疗提供理论依据。
1 资料与方法
1.1标本的来源 收集2012年3月至2016年12月本院外科手术切除的宫颈癌组织及癌旁正常组织各82例,所有标本经病理确诊均为宫颈鳞癌。其中高分化鳞癌(Ⅰ级)32例,中分化鳞癌(Ⅱ级也称为非角化性大细胞型)30例,低分化鳞癌(Ⅲ级也称为小细胞型)20例。术前所有患者未进行化疗、放疗及生物治疗,且都经过病理学、影像学确诊。
1.2方法
1.2.1主要试剂及仪器 宫颈癌Hela细胞购于中国科学院上海细胞库。兔抗人CyclinD1、C-myc、基质金属蛋白酶(MMP)-2、MMP-9及GAPDH单克隆抗体均购自美国Cell Signal Technology公司;四甲基偶氮唑盐(MTT),DMEM培养基均购自美国Gibco公司;辣根过氧化物酶标记山羊抗兔IgG(H+L),BCA蛋白浓度测定试剂盒均购自南通碧云天生物技术有限公司;Annexin V-FITC/PI流式双染试剂盒,细胞周期检测试剂盒购自南京凯基生物技术有限公司;Trizol试剂盒,一步法RT-PCR试剂盒,LipofectamineTM2000均购自美国Invitrogen公司;pcDNA3.1 WIF1 真核表达载体及空白质粒pcDNA3.1均购自广州锐博生物技术有限公司。MK3酶标仪购自美国Thermo公司;ChemiDocTMXRS凝胶成像系统购自美国伯乐公司;FACSCalibur流式细胞仪购自美国BD公司。
1.2.2RT-PCR法检测WIF1 mRNA含量 根据Trizol试剂盒提取细胞总的RNA,并检测总RNA纯度,通过一步法RT-PCR试剂盒将RNA逆转录成cDNA,并将cDNA进行扩增,最后用琼脂糖凝胶电泳检测扩增产物。
1.2.3真核表达载体的转染 当Hela细胞生长达到50%时候,利用LipofectamineTM2000脂质体将pcDNA3.1 WIF1 真核表达载体(过表达组)及空白质粒pcDNA3.1(对照组)转染到Hela细胞中,6 h后换液,采用Western blot 及RT-PCR法检测WIF1表达。
1.2.4MTT法检测细胞活力 将Hela细胞接种到96孔板,培养24 h后,按“1.2.3”转染培养48 h,加入MTT孵育4 h,舍弃上清液,再加入150 μL的二甲基亚砜,振荡使结晶物溶解,于酶标仪上测定A560 nm值。
1.2.5Annexin V-FITC/PI法检测细胞凋亡情况 将8×103个Hela细胞接种到6孔板,培养24 h后,按“1.2.3”转染48 h后,每组收集1×105/mL个细胞,加入结合缓冲液吹打混匀后,再依次加入5 μL的Annexin V-FITC及PI,继续吹打混匀,并于室温避光孵育10 min,于1 h内在流式细胞仪上进行细胞凋亡分析。
1.2.6流式细胞术检测细胞周期 将8×103个Hela细胞接种到6孔板,培养24 h后,按“1.2.3”转染48 h后,每组收集1×105/mL个细胞,加Rnase吹打混匀后,37 ℃孵育1 h,再加入PI染液避光孵育30 min,于1 h内在流式细胞仪进行细胞周期检测分析。
1.2.7Transwell法检测细胞侵袭能力 将Matrigel胶平铺于Transwell小室上,备用。将按“1.2.3”转染培养24 h的细胞制成单细胞悬浮液接种于Transwell上室,而下室不接种细胞(仅含有相应培养基),培养48 h后,将小室取出来,多聚甲醛下室细胞,并用结晶紫染色,最后在倒置显微镜下观察并取5个视野中的细胞进行计数,取平均值,即为细胞的侵袭数目。
1.2.8Western blot检测细胞中蛋白表达 将8×103个Hela细胞接种到6孔板,培养24 h后,按“1.2.3”转染48 h后,收集细胞并裂解得到总蛋白,BCA试剂盒检测蛋白浓度。蛋白煮沸变性后,制作浓缩胶及分离胶并于室温水封30 min。样品上样后进行十二烷基苯磺酸钠凝胶电泳,湿法转膜。2%的BSA室温下孵育1 h,一抗溶液(兔抗人CyclinD1、C-myc、MMP-2、MMP-9及GAPDH单克隆抗体) 4 ℃过夜孵育,第2天在室温条件下,于二抗溶液孵育1~2 h,在凝胶成像系统中曝光。
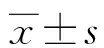
2 结 果
2.1WIF1在宫颈癌组织及癌旁组织中的表达 采用Western blot及RT-PCR法检测82例宫颈癌组织及癌旁组织中WIF1的表达,见图1;与癌旁组织比较,宫颈癌组织中WIF1蛋白[(0.89±0.09)vs.(0.13±0.01)]及mRNA[(1.12±0.11)vs.(0.14±0.01)]表达量均显著降低(P<0.01)。

图1 WIF1在宫颈癌组织及癌旁正常组织中的表达
2.2WIF1真核表达载体转染的检测 与对照组比较,过表达组中WIF1蛋白[(0.13±0.01)vs.(0.95±0.09)]及mRNA[(0.18±0.01)vs.(0.97±0.07)]表达量均显著提高(P<0.01),见图2。

图2 WIF1真核表达载体转染的检测
2.3WIF1过表达对宫颈癌Hela细胞活力的影响 与对照组(0.68±0.06)比较,过表达组(0.37±0.03)细胞活力显著降低(P<0.01)。
2.4WIF1过表达对宫颈癌Hela细胞凋亡、细胞周期的影响 与对照组比较,过表达组细胞早期凋亡率及晚期凋亡率显著提高(P<0.01),并使细胞周期阻滞于G1期(P<0.01),见表1。
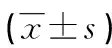
表1 WIF1过表达对宫颈癌Hela细胞凋亡、细胞周期的影响
a:P<0.01,与对照组比较
2.5WIF1过表达对宫颈癌Heal细胞侵袭能力的影响 与对照组(189.43±15.39)比较,过表达组(49.51±5.12)侵袭数目显著降低(P<0.01),见图3。
2.6WIF1过表达对宫颈癌Hela细胞中C-myc、CyclinD1、MMP-2及MMP-9蛋白表达量的影响 与对照组比较,过表达组中C-myc、CyclinD1、MMP-2及MMP-9表达量显著下调(P<0.01),见图4、表2。
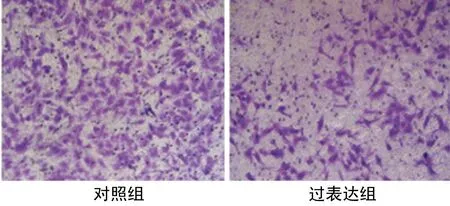
图3WIF1过表达对宫颈癌Heal细胞侵袭能力的影响(×200)
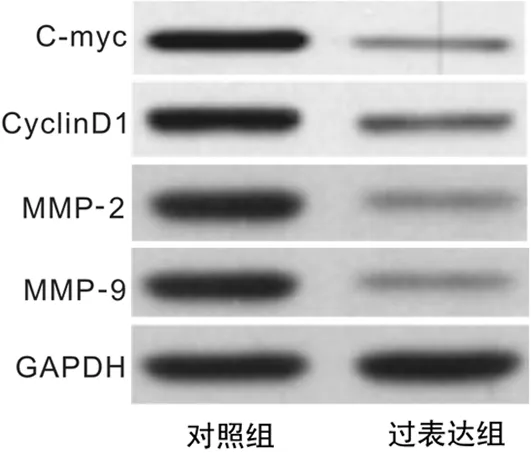
图4WIF1过表达对宫颈癌Hela细胞中C-myc、CyclinD1、MMP-2及MMP-9蛋白表达量的影响
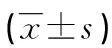
表2 WIF1过表达对宫颈癌Hela细胞中C-myc、CyclinD1、MMP-2及MMP-9蛋白表达量的影响
a:P<0.01,与对照组比较
3 讨 论
Wnt信号通路是一种真核生物中高度保守的与胚胎发育密切相关的信号转导通路,通过Wnt配体与Frizzled受体结合,将信号传递给GSK-3β-Axin-APC复合体,进而导致β-catenin蛋白在细胞质中的积聚,并进入细胞核,引起与LEF/TCF相关转录因子(CyclinD1、C-myc等)的表达[4-6]。WIF1作为Wnt信号通路的分泌性拮抗因子,最初于人视网膜组织中被发现,后在大鼠、蟾蜍和斑马体内中也被证实存在着。WIF1能够与Wnt配体竞争与Frizzled受体的结合,阻断Wnt信号通路,进而抑制肿瘤的发生。研究显示Wnt信号通路在包括宫颈癌在内的多种肿瘤组织中被激活,高度表达,原因可能是Wnt信号通路拮抗因子失活或者沉默所导致的[4-6]。而WIF1作为Wnt分泌性拮抗因子,在宫颈癌中的表达及相关机制尚少见报道,因此本研究将对此展开探讨。
本研究首先采用Western blot及RT-PCR法检测经本院手术的82例宫颈癌组织及癌旁组织中WIF1的表达,结果表明癌组织中WIF1蛋白及mRNA表达量均显著低于癌旁正常组织,与WIF1在其他肿瘤组织中的表达趋势一致[7-8],说明WIF1在宫颈癌的发生过程中起着抑癌作用。且目前研究显示WIF1在多数肿瘤组织及细胞株中低表达,并与癌细胞的增殖、凋亡、细胞周期、迁移侵袭等多种生物学行为密切相关[8-10]。提示WIF的低表达对宫颈癌细胞的生物学行为可能产生显著影响,本研究将对此展开探讨。
本研究利用脂质体转染WIF1真核表达载体,并通过Western blot及RT-PCR法证实了转染的成功。进一步采用MTT,Annexin V-FITC/PI流式双染技术检测WIF1过表达对宫颈癌Hela细胞活力及凋亡的影响,结果表明WIF1过表达能显著的降低Hela细胞活力,并提高细胞凋亡率,与WIF1在其他肿瘤细胞中的作用一致[11-12],说明WIF1过表达能显著的抑制Hela细胞增殖,并诱导细胞凋亡。
宫颈癌细胞的凋亡受限制源自于细胞周期的不可控制,因此细胞周期调控点G1、S、G2成为多种抗肿瘤药物的作用靶点[13]。因此本研究利用流式细胞术检测WIF1过表达对Hela细胞周期的影响,结果表明WIF1过表达能使细胞周期阻滞于G1期,提示WIF1过表达可能通过阻断DNA的复制进而抑制Hela细胞的增殖。CyclinD1是与G1期密切相关的细胞周期蛋白,先于G1表达,并与细胞周期依赖性蛋白4(CDK4)/CDK6结合形成复合物,促使Rb磷酸化及核转录因子E2F进入细胞核,推动与细胞增殖相关基因的转录。C-myc是原癌基因Myc的成员之一,定位于8号染色体,在肿瘤组织中持续性表达进而加速G1期向S期的转换,促使肿瘤细胞的恶性转换[14]。因此本研究进一步的探讨WIF1过表达对Hela细胞中CyclinD1、C-myc蛋白表达的影响,结果表明WIF1过表达能显著下调CyclinD1、C-myc表达,进而使Hela细胞周期阻滞于G1期。
肿瘤细胞的侵袭转移是肿瘤切除手术失败的重要原因之一[15]。细胞外基质降解是癌细胞进行远处扩散的先决条件,这一降解过程主要由MMPs所介导。MMPs是一类依赖于Zn2+的蛋白水解酶,其中明胶酶MMP-2和MMP-9不仅能够降解基膜主要成分Ⅳ胶原,层连蛋白等,还能够诱导血管新生,促进癌细胞浸润扩散。目前研究证实高表达的MMP-2、MMP-9与宫颈癌的高侵袭性正相关[15]。因此本研究通过Transwell法、Western blot法分别检测WIF1过表达对Hela细胞侵袭能力及MMP-2、MMP-9蛋白表达的影响,结果表明WIF1过表达能显著的下调MMP-2及MMP-9表达,进而抑制Hela细胞侵袭。
综上所述,WIF1在宫颈癌组织中低表达,WIF1过表达能显著的降低Hela细胞活力,诱导细胞凋亡,使细胞周期阻滞于G1期,并抑制细胞侵袭能力,此过程可能与下调CyclinD1、C-myc、MMP-2及MMP-9表达有关。

