煤矸石制备聚合氯化铝工艺
吴海滨,薛芳斌,郭彦霞,程芳琴,杨凤玲
(1.山西瑞恩泽科技有限公司,山西 太原 030006;2.山西大学 资源与环境工程研究所 国家环境保护煤炭废弃物资源化高效利用技术重点实验室,山西 太原 030006)
0 引 言
煤矸石是在煤炭开采、分选等过程中产生的固体废弃物,其大量堆存不仅占用了大量的土地,而且对生态环境造成了严重危害。煤矸石含有一定量的Al2O3,可达15%~35%,煤矸石中铝资源的利用受到广泛关注[1-3]。聚合氯化铝(PAC)是一种水溶性无机高分子聚合物,是高效的无机水处理剂,常用于饮用水、城市给水等的净化,PAC通常由铝土矿制备,从煤矸石中提取Al2O3制备PAC絮凝剂可有效缓解我国铝土矿资源的不足[4-6],且煤矸石原料来源广泛、价格低廉,更具有市场竞争力,还能实现废物的减量化和资源化。
以煤矸石为原料制备PAC在20世纪60年代就已经开展了相关的研究工作[7-8]。目前最主要的制备方法是酸溶法,即将煤矸石破碎、焙烧,与盐酸在一定条件下反应,经过若干小时的固液分离,向浓缩后的母液添加一定量的碱化剂(NaOH、Na2CO3、石灰等),并进一步调节产品的盐基度,得到合格的PAC产品[9-11]。Al2O3含量是影响PAC产品质量的关键因素[12],在制备过程中Al2O3的溶出率受工艺条件制约,如盐酸浓度、反应温度、反应时间等。刘臻[13]对唐山市矸石(<0.25 mm)进行煅烧、酸溶及聚合等制备PAC,试验过程中对煅烧温度、盐酸用量、酸溶温度、酸溶时间等因素利用正交实验进行分析,优化了酸溶条件,得到了合格的絮凝剂产品。徐新阳等[14]将葫芦岛煤矸石破碎至2 mm,进行酸溶浸取,以NaOH为碱化剂聚合,对聚合温度、聚合时间、酸浸液初始pH值等条件进行分析,优化聚合条件,得到了符合国标的PAC产品。盐基度是影响PAC产品质量的另一个关键指标[12],由聚合过程中添加的碱化剂进行调整,常用碱化剂主要有NaOH溶液、Na2CO3溶液、CaCO3以及石灰水等。聚合过程会产生副产品NaCl、CaCl2等,这些物质难以与PAC有效分离,不仅降低了产品的有效成分,还会增加固体产品的吸湿性[15]。铝酸钙粉是一种有效的碱化剂,已经在制备絮凝剂的应用上逐渐取代了传统的碱化剂[16-17],能够调节产品的盐基度,还能提升PAC产品中有效铝的含量,且成本低、操作方便,得到了广泛应用,但目前主要用于铝土矿生产絮凝剂。煤矸石中Al2O3含量低于铝土矿,且Al2O3主要存在于高岭石等矿物中,比铝土矿难提取。
本文以煤矸石为原料、以铝酸钙粉为碱化剂制备PAC,研究盐酸浓度、聚合条件和碱化剂用量等对PAC产品的影响,为煤矸石的资源化利用提供新方法。
1 试 验
1.1 原料和设备
煤矸石取自朔州升泰源,铝酸钙粉购自郑州润丰环保,成分见表1,EDTA、硫酸铜、盐酸、氨水、氢氧化钠及氟化钾等均为分析纯。
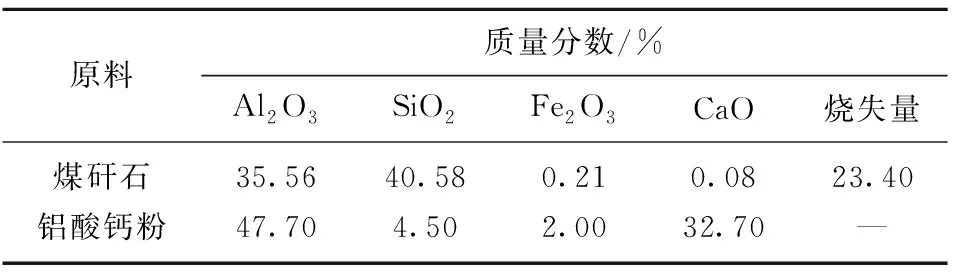
表1 煤矸石和铝酸钙粉的化学成分Table 1 Chemical composition of coal gangue andcalcium aluminate powder
设备包括:HH-2数显恒温水浴锅、DZTW电子调温电热套、JB90-D电动搅拌器、PHS-3C pH计、SHZ-D(III)循环水式多用真空泵、SL-500A高速多功能粉碎机、BSA224S-CW分析天平及CS101-2EB电热恒温鼓风干燥箱。
1.2 试验过程及方法
1.2.1 PAC的制备
以煤矸石为原料,铝酸钙粉为碱化剂制备PAC。煤矸石破碎至粒径<0.18 mm,在750 ℃下煅烧2 h,与20%盐酸在一定条件下酸浸,将得到的酸浸液加入500 mL四口烧瓶,置于恒温水浴锅中,待温度恒定后在电动搅拌器快速搅拌下,缓慢加入一定量的铝酸钙粉,反应一段时间后,静置熟化24 h,并测定其中Al2O3含量和盐基度,工艺流程如图1所示。
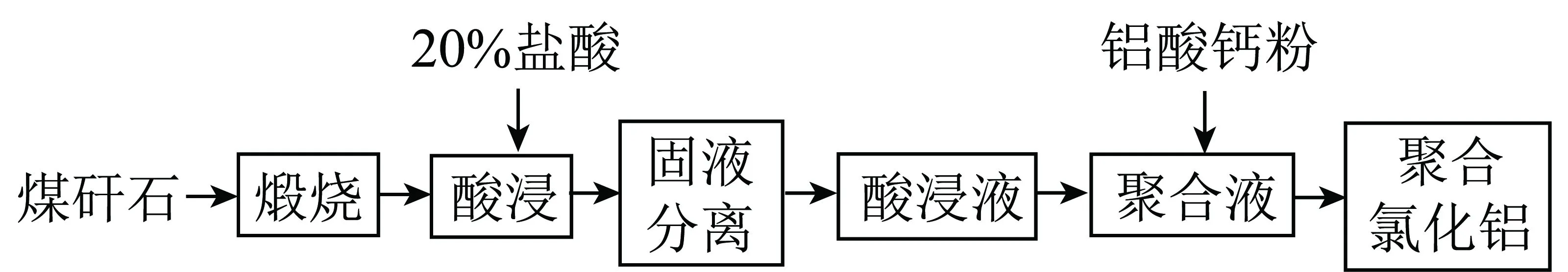
图1 煤矸石制备PAC工艺流程Fig.1 Process for preparing polyaluminum chloride from coal gangue
1.2.2 Al2O3及盐基度测定
将得到的液体产品静置一段时间后取8.0 g液体,精确至0.2 mg,用无CO2的水溶解并移至250 mL容量瓶定容。
氧化铝测定:移取10 mL试液于250 mL锥形瓶中,加2 mL盐酸煮沸3 min,加水约60 mL,调节pH=1.5~2.0,加一滴磺基水杨酸并加热至60~70 ℃,以低浓度EDTA标准溶液滴定其中的铁;准确加入30 mL高浓度EDTA标准溶液,用氨水调节pH=4.5~5.0,加入10 mL乙酸-乙酸钠缓冲溶液,加热煮沸3 min,加5~6滴PAN指示剂,趁热以CuSO4标准溶液滴定至紫红色。
Al2O3的质量分数w为
ω=[CEDTAVEDTA-C(CuSO4)V(CuSO4)]×102×
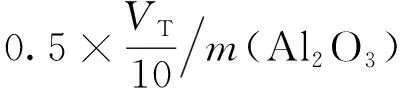
(1)
式中,m(Al2O3)为煤矸石原样中Al2O3的质量,g;CEDTA为高浓度EDTA的浓度,mol/L;VEDTA为高浓度EDTA的体积,mL;C(CuSO4)为CuSO4的浓度,mol/L;V(CuSO4)为CuSO4的体积,mL;VT为定容后的总体积,mL。
盐基度测定:移取25 mL试液于250 mL磨口烧杯中,加入20 mL盐酸标准溶液,在加热套上煮沸回流2 min,冷却至室温并转移到聚乙烯烧杯中,加入20 mL氟化钾溶液摇匀。加入5滴酚酞指示剂,立即用NaOH标准溶液滴定至出现微红色。同时用无CO2的水进行空白试验。
盐基度w1的计算公式为
w1=[(V0-V(Na))/1 000]c(Na)m(w(Al2O3)/
100)×(25/250)×(0.529 3/M)×100
(2)
式中,V0为空白试验消耗NaOH标准滴定溶液的体积,mL;V(Na)为滴定消耗NaOH标准滴定溶液的体积,mL;C(Na)为NaOH标准溶液浓度,mol/L;m为试样的质量,g;w(Al2O3)为测定Al2O3的质量分数,%;M为1/3 Al的摩尔质量,g/mol(M=8.994);0.529 3为Al2O3折算成Al的系数。
2 试验结果与讨论
2.1 盐酸用量对煤矸石中Al2O3溶出率的影响
通过计算,若将100 g煤矸石中的Al2O3、氧化铁等全部提取出来,需要20%盐酸约350 mL,盐酸量过低会导致Al2O3提取率过低,盐酸量过高则会造成酸的浪费,因此选取的固液体积比为1∶4、1∶3.5、1∶3.3和1∶3。粒度<0.18 mm的100 g煤矸石在750 ℃煅烧2 h,分别与20%盐酸在106 ℃按上述固液比酸浸2 h,固液分离后分析得到的液体,比较Al2O3溶出率,结果如图2所示。

图2 Al2O3溶出率随固液比的变化Fig.2 Changes of the dissolution rate of alumina with the ratio of solid to liquid
通过Al2O3在强酸介质中与溶液中的H+反应,提取煤矸石中的有效铝,反应方程式为

(3)
加酸量对煤矸石中有效铝的溶出有较大影响。由图2可知,随着固液比的增加,Al2O3的提取率增加,固液比为1∶3时,Al2O3的溶出率约57%;固液比为1∶3.5时,Al2O3溶出率达到78%;随固液比进一步增加,Al2O3溶出率增加不大,固液比1∶4时Al2O3溶出率为80%,固液比1∶4.5时Al2O3溶出率为83%。综合考虑Al2O3溶出率与耗酸量,选择固液比1∶3.5。
2.2 聚合条件的影响
2.2.1 聚合温度
在固液比1∶3.5条件下,将Al3+浓度1.5 mol/L的酸浸液100 mL与150 g/L的铝酸钙粉,在20、40、60、80、100 ℃下分别聚合120 min,冷却静置24 h后测定产品中Al2O3含量和盐基度,结果如图3所示。

图3 Al2O3含量及盐基度随聚合温度的变化Fig.3 Changes of alumina content and basicity with polymerization temperature
反应溶液温度的升高有利于反应向聚合方向进行。由图3可知,相同条件下,反应温度升高可使制备PAC产品中Al2O3含量和盐基度增加。聚合温度20 ℃时,PAC产品中Al2O3含量仅为8.9%,盐基度为34.4%;反应温度升至80 ℃时,PAC产品中Al2O3含量为10.3%,盐基度达到65.6%;聚合温度增至100 ℃时,产品中Al2O3含量和盐基度分别达10.6%和71.8%。因此,聚合温度为80 ℃时,2项指标均符合HG/T 2677—2009标准,确定聚合温度为80 ℃。
2.2.2 聚合时间
Al3+浓度1.5 mol/L酸浸液100 mL,150 g/L的铝酸钙粉,在80 ℃分别聚合30、60、90、120、150 min,冷却静置24 h后测定产品中Al2O3含量和盐基度,结果如图4所示。
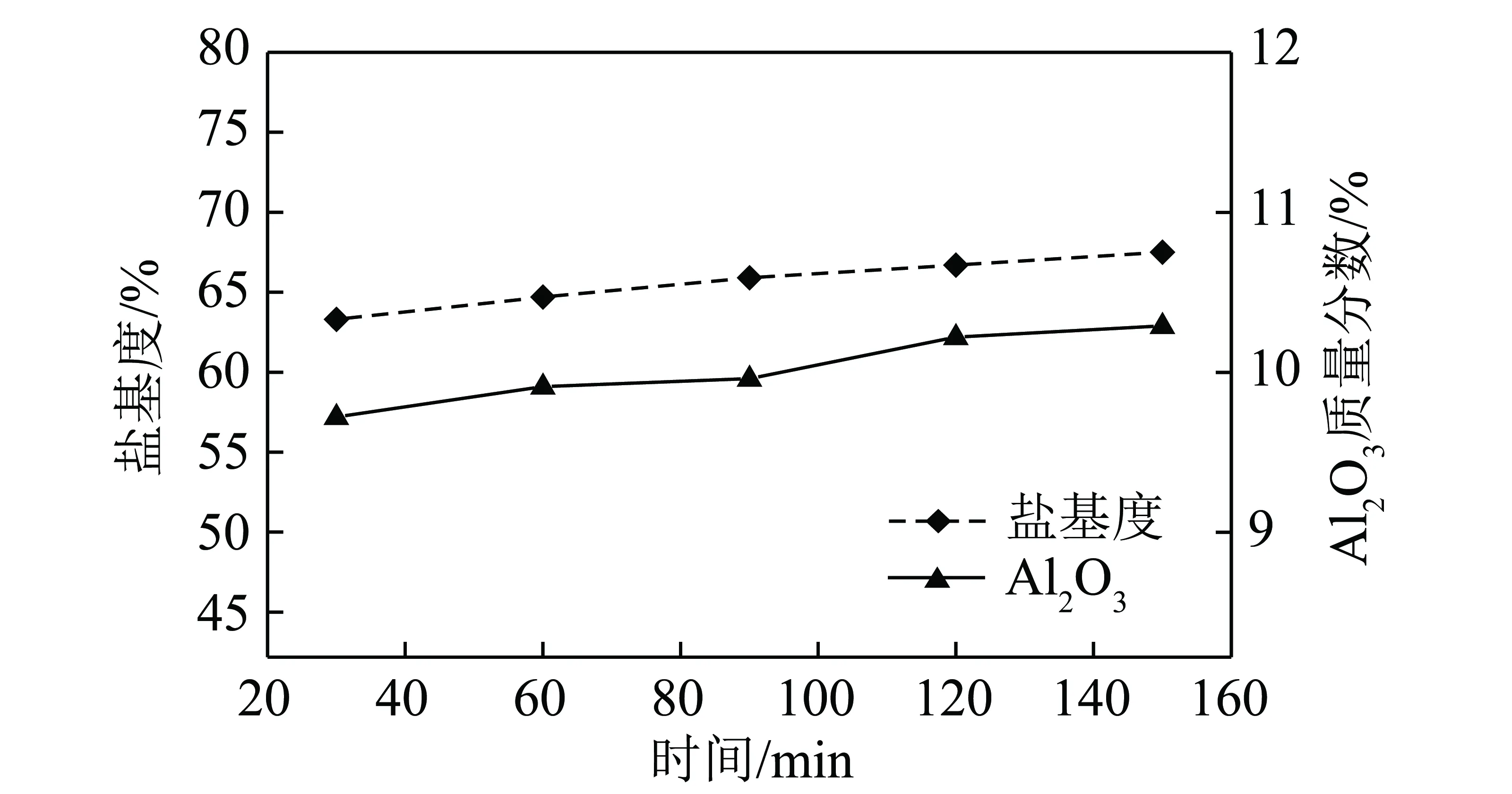
图4 Al2O3含量和盐基度随聚合时间的变化Fig.4 Changes of alumina content and base degree with polymerization time
由图4可知,当反应时间为30 min时,Al2O3含量为9.7%,盐基度为63.3%;随着聚合时间的增加,Al2O3含量以及盐基度增加缓慢,基本维持稳定;当聚合时间达到120 min时,Al2O3含量为10.3%,盐基度为66.7%。表明当达到一定时间后(>30 min),聚合时间对聚合反应影响不大,Al2O3含量和盐基度趋于稳定。聚合时间为120 min时,Al2O3含量和盐基度符合HG/T 2677—2009标准。因此,聚合时间选择120 min。
2.2.3 Al3+浓度
Al3+浓度分别为0.5、1.0、1.5、2.0、2.5 mol/L的酸浸液100 mL,铝酸钙粉的添加量按浓度质量比1∶10,在80 ℃聚合120 min,冷却静置24 h后测定产品中Al2O3含量和盐基度,结果如图5所示。

图5 Al2O3含量和盐基度随铝离子浓度的变化Fig.5 Changes of alumina content and base degree varied with aluminum ion concentration
酸浸液中Al3+浓度是影响PAC产品中有效铝含量的最主要因素。随着酸浸液中Al3+浓度的增加,酸浸液中有效铝的含量增加。由图5可知,PAC产品中Al2O3含量和盐基度均随酸浸液中Al3+浓度的增加而增加;酸浸液中Al3+浓度为0.5 mol/L时,产品中Al2O3含量为4.5%,盐基度为44.9%;Al3+浓度增至1.0 mol/L时,Al2O3含量和盐基度分别增加至7.1%和56.8%;Al3+浓度为1.5 mol/L时,氧化铝含量达到10.3%,盐基度达到65.5%,符合HG/T 2677—2009标准。因此,选择酸浸液Al3+浓度为1.5 mol/L。
2.2.4 铝酸钙粉加入量
Al3+浓度为1.5 mol/L的酸浸液100 mL,分别加入5、10、15、20、25 g的铝酸钙粉,在80℃聚合120 min,冷却静置24 h后测定产品中Al2O3含量和盐基度,结果如图6所示。
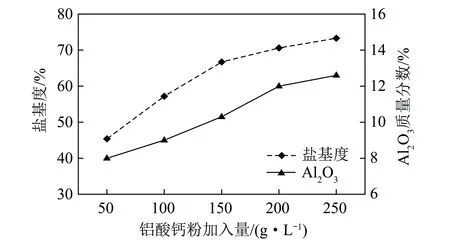
图6 Al2O3含量和盐基度随铝酸钙粉加入量的变化Fig.6 Alumina content and base degree at the various addition of calcium aluminate
煤矸石中铝含量较低,不能满足溶出液中铝含量的要求,必须通过投加铝酸钙粉来提高PAC产品中的铝含量,同时还能够调节溶液的pH值,并能够提高产品的盐基度。由图6可知,产品中的Al2O3含量及盐基度均随铝酸钙粉加入量的增加而增大,当铝酸钙粉加入量为50 g/L时,产品中Al2O3含量为8%,盐基度为45.4%;当铝酸钙粉加入量为150 g/L时,产品中Al2O3含量可达到10.3%,盐基度为66.7%;当铝酸钙粉用量≥200 g/L时,产品易黏稠且产生沉淀,可能是铝酸钙粉难溶解导致的。但铝酸钙粉的投加量过低,会导致产品中的有效铝以及盐基度降低,达不到较好的絮凝效果,当铝酸钙粉的添加量为150 g/L时产品符合HG/T 2677—2009标准。
以煤矸石为原料、铝酸钙粉为碱化剂制备PAC的优化条件为:煤矸石与盐酸固液比为1∶3.5,Al3+浓度为1.5 mol/L,铝酸钙粉用量为150 g/L,在80 ℃聚合120 min。得到的PAC产品指标:Al2O3含量10.3%,盐基度65.6%,符合HG/T 2677—2009中的Ⅰ类产品指标。
3 结 论
1)盐酸用量影响煤矸石中Al2O3的溶出,随着煤矸石固体质量与盐酸溶液体积之比的增加,Al2O3的提取率增加,当固液比达到1∶3.5时Al2O3的提取率接近80%。
2)PAC产品中的Al2O3含量和盐基度均随聚合温度、聚合时间、Al3+浓度和铝酸钙粉用量的增加而增加,当聚合温度为80 ℃、聚合时间为120 min、Al3+浓度为1.5 mol/L和铝酸钙粉加入量为150 g/L时,得到的PAC产品中Al2O3含量为10.3%,盐基度为65.6%,符合HG/T 2677—2009中的Ⅰ类产品指标。

