镉胁迫对茶园绿肥槐叶决明“茶肥1号”的生长及吸收积累的影响
向 芬,李 维,刘红艳,周凌云,丁 玎,曾 振
(湖南省农业科学院茶叶研究所,湖南 长沙 410125)
镉(Cd)是植物生长发育的非必需元素,较低浓度即可对作物产生较大危害[1]。Cd在环境和植物中的迁移性和生物毒性较强,由于其稳定、积累和不易清除等特性,进入土壤中易被植物吸收,并通过食物链进入人体,可在人体内不断富集,严重威胁人们身体健康与生命安全,与其相关的致病、致畸、致癌等报道日益增多[2-4]。研究表明,排到环境中的Cd有82%~94%进入土壤,其中包括农作物的耕地土壤[5]。在我国,因Cd含量超标大面积的耕地被迫弃耕与转型[6]。茶叶作为我国的一种重要的经济作物,因具有较强的保健功能而深受广大人民喜爱。但近年来,随着生活水平的不断提高,包括茶叶在内的食品安全问题越来越受到人们关注,因此,茶园中的重金属污染问题目前已受到高度重视。前人研究表明,随着时间的推移和社会经济的发展,茶叶中Cd含量增加了近一倍,Cd含量超标问题呈显著升高趋势[7-8]。因而,研究茶园土壤Cd污染的修复与治理具有重要的理论和实践意义。
在众多植物中,豆科植物如花生(Arachishypogaea)[9]、大豆(Glycinemax)[10]等对重金属Cd具有较强的耐受性和较高的富集能力,而且不同品种间的耐受性和富集能力差异明显。槐叶决明(Cassiasophera)“茶肥1号”为湖南省茶叶研究所自主选育的一种旱地夏季绿肥植物,为豆科决明属一年生亚灌木草本植物,耐酸性,适合在茶园中种植,由于其氮含量,产草量较决明属绿肥圆叶决明高等特点[11],已在我国茶区广泛种植。“茶肥1号”对矿质元素P、K的吸收能力较强[12]。决明属绿肥圆叶决明(Chamaecristarotundifolia)能忍耐2 mg·kg-1以下的Cd胁迫,可作为南方红壤地区矿山Cd污染土壤的生态修复植物类型[13]。因此决明属的“茶肥1号”可能对镉离子等重金属具有富集作用,该植物能否降低重金属污染的土壤或者茶园中Cd的含量,目前研究较少。为此,本研究拟通过高浓度Cd处理盆栽“茶肥1号”植株,通过“茶肥1号”生长及Cd含量的积累情况来探讨“茶肥1号”Cd累积特性,为Cd污染茶园及其他农作物种植地区土壤治理与修复提供参考。
1 材料与方法
1.1 试验材料
以“茶肥1号”为供试材料,于2016年4月在湖南省茶叶研究所长沙市马坡岭试验基地布置盆栽试验。盆钵直径40 cm,高度35 cm,土壤取自长沙市马坡岭茶叶试验基地(113°07.476′ E,28°20.511′ N),砂质红壤,有机质9.65 mg·kg-1,pH 5.46,碱解氮64.73 mg·kg-1,速效磷4.6 mg·kg-1,速效钾109.1 mg·kg-1,总Cd含量0.46 mg·kg-1。土壤经风干、去杂质、压碎后过2 mm孔径筛,每盆按14.5 kg 称重装盆。采用田间常规管理“茶肥1号”,2016年11月结束试验,历时8个月。
1.2 试验设计
“茶肥1号”于4月20日播种,选取长势一致的5叶龄幼苗于5月27日移栽于盆钵中,每盆栽种3株,6月7日按 0(CK)、5、10、20、40、80、120、160 mg·kg-1进行Cd处理,分别记为 CK、Cd1、Cd2、Cd3、Cd4、Cd5、Cd6、Cd7,共8个处理,每处理4盆。以硝酸镉[Cd(NO3)2·4H2O]溶于水作为Cd供源,CK、Cd1、Cd2、Cd3、Cd4、Cd5、Cd6、Cd7分别补充尿素0.45、0.44、0.42、0.39、0.34、0.23、0.11和0 g平衡氮元素含量。
1.3 取样及测定方法
取样:在Cd胁迫50 d(2016年7月27日)时,取出植株清洗后,按根、茎、叶片分别取样。各样品经蒸汽杀青固定后,置于烘箱中80 ℃干燥后称重,测定各处理的生长量,再粉碎过筛备测。在Cd胁迫163 d(2016年11月17日)时,收获果荚,取出植株的根清洗后,分别经蒸汽杀青固定后,于80 ℃烘箱中干燥后,分选出种子,再把种子、根粉碎过筛备测。同时取各处理土壤样品风干碾碎后过筛备用。
测定:“茶肥1号”各器官及土壤中有效态Cd含量的测定参照GB/5009.15-2014,将各样品经硝酸、高氯酸消解后用原子吸收光谱仪(岛津 AA-6300C)测定。然后计算吸收系数[14-15](absorbtion coefficient,AC)和富集系数[16]。
AC= 某器官中Cd元素含量/根系Cd元素含量。
富集系数=植物体或某器官中Cd元素的含量/Cd元素在土壤中的含量。
1.4 数据分析
利用DPS14.5软件对所测数据进行统计与分析,用平均值和标准误表示测定结果,对各处理测定结果采用Duncan新复极差法进行多重比较分析。采用线性回归对“茶肥1号”各器官的Cd累积量与Cd处理浓度间、土壤有效Cd含量的相关性进行分析,利用Excel 2010软件进行制图。
2 结果
2.1 Cd胁迫对“茶肥1号”生物量的影响
研究结果表明,在处理后2个月内,随着处理浓度的增加,“茶肥1号”逐渐出现植株矮小、分枝减少的中毒症状。随着胁迫时间的延长,120和160 mg·kg-1Cd处理出现死苗现象,其他处理生长基本正常,但生长势明显弱于对照。Cd胁迫对“茶肥1号”的叶、根影响较茎大,20 mg·kg-1(Cd3)处理时,根系、叶片生长量显著(P<0.05)低于对照组;40 mg·kg-1(Cd4)处理时,茎的生长量较对照组显著降低(P<0.05),表明“茶肥1号”生长已受到明显的抑制(表1)。“茶肥1号”对外源Cd较敏感,随Cd胁迫浓度的增加,“茶肥1号”各器官生长量均受抑制,160 mg·kg-1(Cd7)处理组受到的抑制作用最强,与对照组比较,其根、茎和叶片的生长量分别下降了69.42%、45.47%和47.96%。
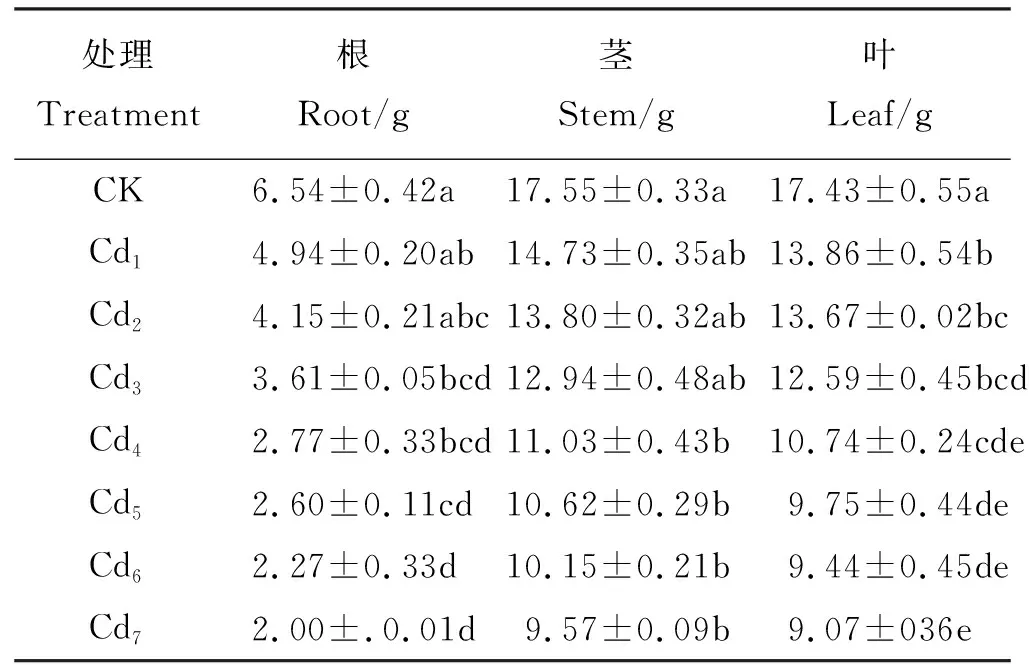
表1 不同浓度Cd胁迫对“茶肥1号”生物量的影响Table 1 Effects of different levels of Cd treatments on Chafei 1# biomass
数值为平均值±标准差(n=3),同列不同小写字母表示处理间差异显著(P<0.05)。CK,control; Cd1,5 mg·kg-1; Cd2, 10 mg·kg-1; Cd3, 20 mg·kg-1; Cd4, 40 mg·kg-1; Cd5, 80 mg·kg-1;Cd6, 120 mg·kg-1;Cd7, 160 mg·kg-1;下同。
Values are mean±standard deviation (n=3). Different lowercase letters within the same column indicate significant differences among diffferent Cd treatments at the 0.05 level.similarly for the following tables.
2.2 “茶肥1号”各部位对Cd的吸收积累特性
“茶肥1号”根、茎、叶的Cd积累量均随Cd处理浓度的增加呈现升高趋势(表2)。Cd处理浓度达160 mg·kg-1时,根、茎和叶片的Cd含量分别是对照的91.08、36.63、14.00倍。各器官Cd积累量高低顺序为根>茎>叶。根对Cd的吸收积累量为茎的2~6倍、叶片的3~16倍,与根系的积累量相比,Cd向地上部分迁移的量相对较少。
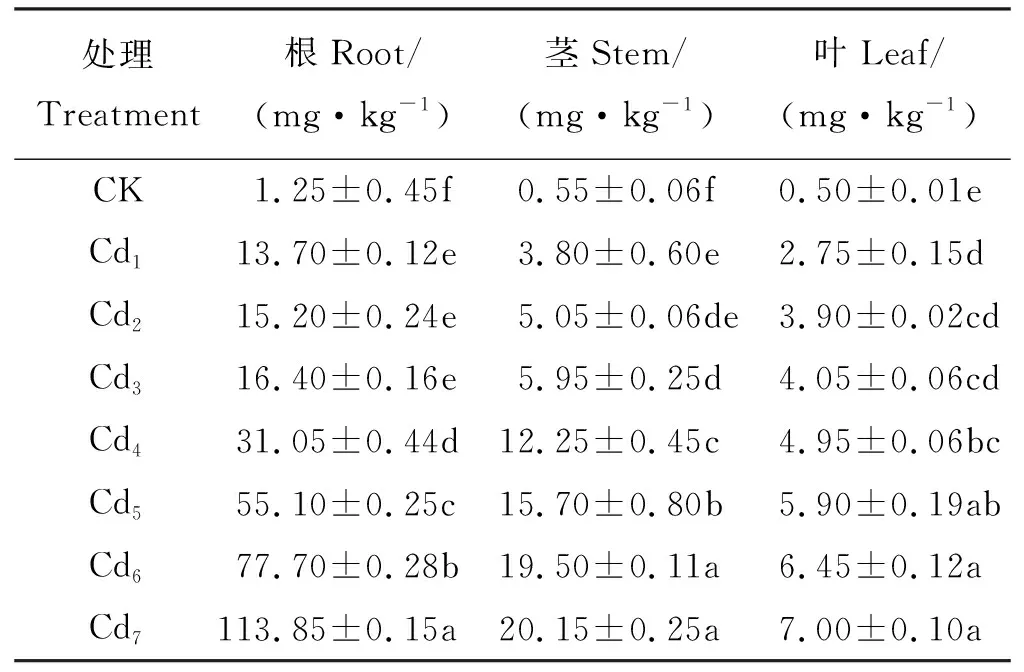
表2 Cd处理对“茶肥1号”各器官Cd含量的影响Table 2 Accumulation and distribution of Cd in Chafei 1#
吸收系数AC反映了“茶肥1号”各器官对Cd的相对吸收程度。以根为参比器官,AC值呈先升高再下降趋势,Cd浓度按梯度逐渐升高至10 mg·kg-1,叶的AC值逐渐升高,20~160 mg·kg-1时,叶的AC值又逐渐降低(表3);当Cd质量浓度按梯度逐渐升高至40 mg·kg-1时,茎的AC值逐渐升高,80~160 mg·kg-1时,茎的AC值又逐渐降低。表明Cd胁迫浓度达到一定值后,随着浓度的进一步加大,“茶肥1号”各器官对Cd的相对吸收能力明显变弱。
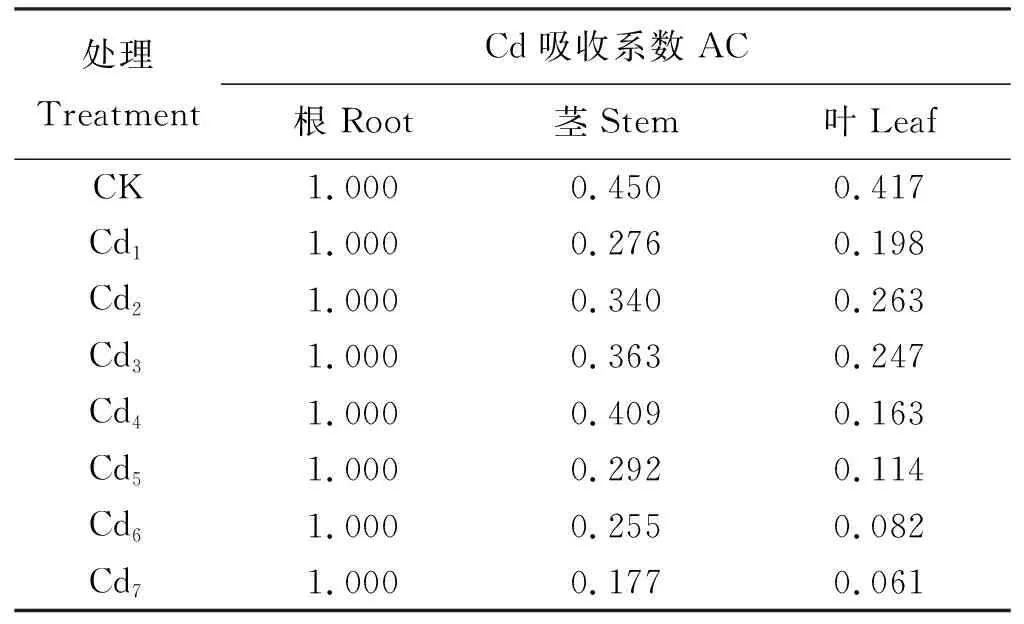
表3 “茶肥1号”各器官的Cd吸收系数ACTable 3 Coefficient AC of Cd absorption in different organs of Chafei 1#
AC, absorbtion coefficient.
2.3 Cd处理茶肥1号后土壤Cd含量的变化
随着Cd胁迫处理浓度增加,土壤中有效Cd含量显著增加(图1)。“茶肥1号”不同器官对Cd的吸收存在明显差异,各器官的生物富集系数表现为根>茎>叶,“茶肥1号”根、茎、叶分别在处理浓度为Cd4(40 mg·kg-1)、Cd2(10 mg·kg-1)、Cd1(5 mg·kg-1)时,富集系数分别为0.835、0.868和0.967,表明向地上部分输送的Cd多(表4)。
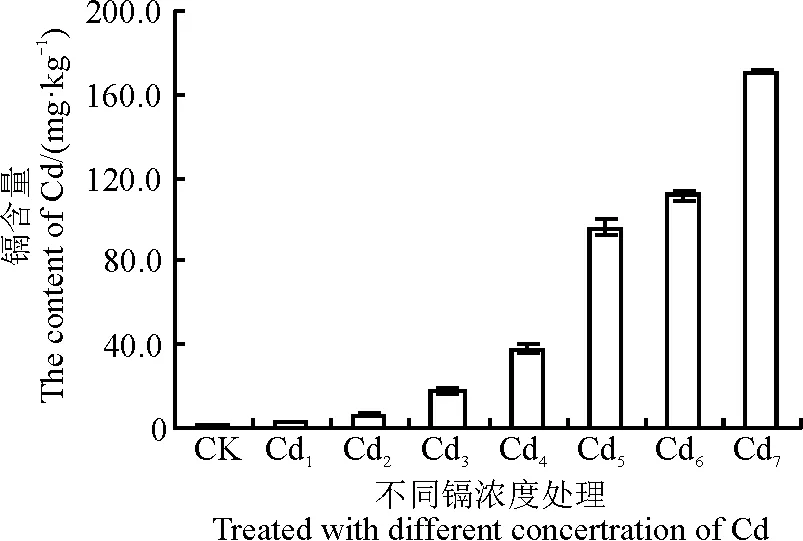
图1 不同Cd浓度处理后土壤Cd含量的变化Fig. 1 Changes in Cd content in soil treated with Cd
*代表Cd胁迫处理与对照在0.05水平显著性差异。表5同。
* indicate the difference between untreated and cadmium treated at 0.05 level.
“茶肥1号”各器官Cd含量(y)与Cd胁迫浓度(x1)、土壤有效态Cd含量(x2)均呈显著正相关(P<0.05),表明土壤中有效态Cd向“茶肥1号”迁移是各器官所积累Cd的主要来源(表5)。拟合曲线的斜率反映了“茶肥1号”对土壤中Cd吸收程度的大小,各器官Cd含量与Cd胁迫浓度和土壤有效态Cd含量的浓缩系数均为根>茎>叶。综合可知,“茶肥1号”根对Cd的吸收能力最强,且其增强趋势稳定。
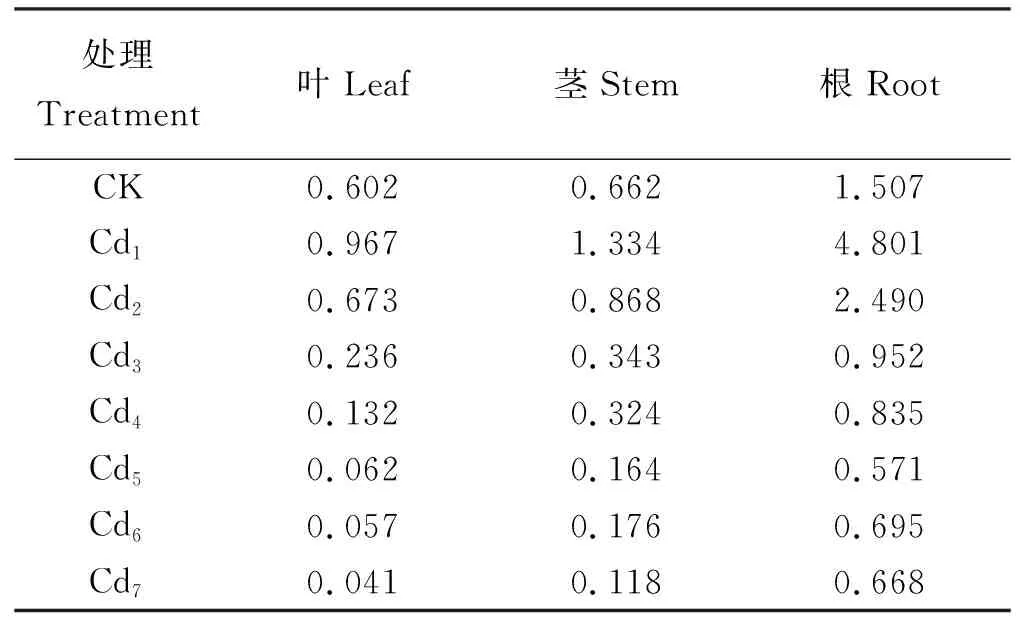
表4 不同Cd浓度处理的“茶肥1号”不同器官的生物富集系数比较Table 4 Comparison of bioconcentration factors in differentorgans of Chafei 1# treated with Cd
2.4 收获后不同Cd浓度处理茶肥1号根、种子中的Cd含量累积特性
为了研究“茶肥1号”种子对Cd是否具有积累效应,能否在Cd污染地进行“茶肥1号”种子繁育,对收获后“茶肥1号”的种子Cd含量进行了测定。当处理浓度达到Cd2(10 mg·kg-1) 时,收获后“茶肥1号”根、种子中的Cd含量较对照显著增加,但种子中的Cd含量在处理浓度Cd5(80 mg·kg-1)以上后累积量增加减缓,处理浓度达160 mg·kg-1时,种子的Cd含量增加了30.3%,而根部Cd含量增加了2.49倍,同一浓度处理,“茶肥1号”根中Cd含量是种子的2.7~35.9倍(P<0.05)(见表6)。

表5 “茶肥1号”各器官Cd含量(y)与Cd胁迫浓度(x1)、土壤有效态Cd含量(x2)的相关性分析Table 5 Correlations between the Cd content in different parts of Chafei 1#(y) and Cd concentrations (x1),soil (x2)
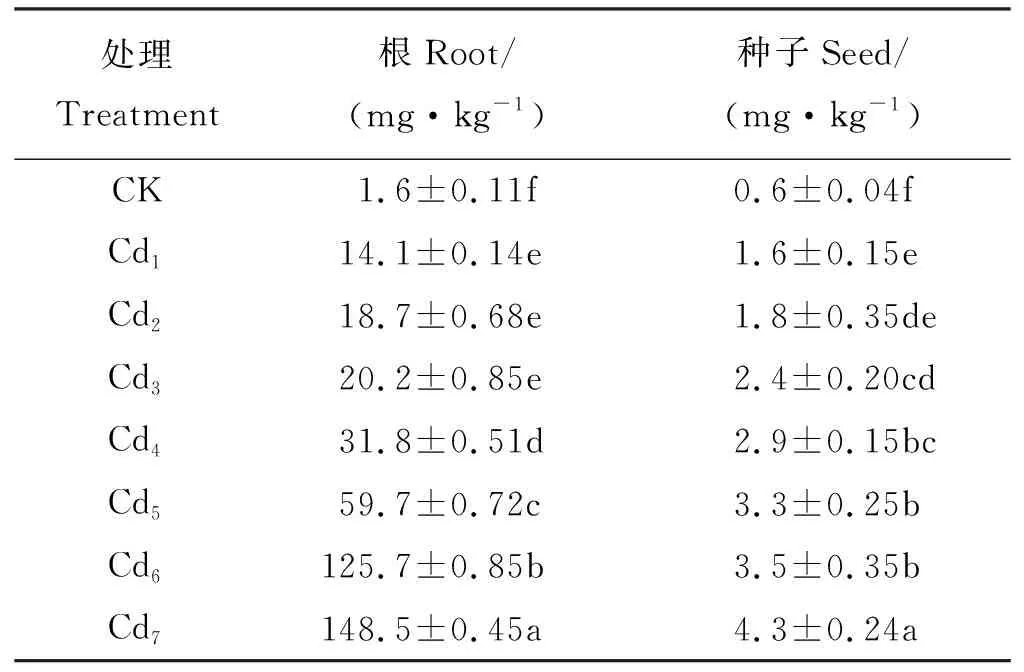
表6 收获后不同浓度处理“茶肥1号”根、种子中的Cd含量Table 6 Cd content in roots and seeds treated with Cd after harvest of Chafei 1#
3 讨论与结论
Cd是重金属污染中较危险的元素之一,易于被植物吸收、富集,过量的Cd严重影响植物的生长发育[17-18]。研究表明,Cd胁迫会对植物的株高、生物量等性状指标产生一定的抑制作用[19-21]。本研究结果表明,与对照比较,土壤中施入5~160 mg·kg-1的外源Cd,当Cd浓度为5~80 mg·kg-1时,“茶肥1号”无明显的Cd过量症状出现,120 mg·kg-1浓度以上处理“茶肥1号”出现死苗,可能由于少部分“茶肥1号”幼苗在移栽时根部受损,浓度过高导致其死苗。植物根系是重金属富集最高的部位[22],本研究发现Cd处理后各器官生长量显著下降,其中对根的影响最大(表1),当Cd浓度达到160 mg·kg-1时,根的生物量下降了69.42%。
本研究结果表明,在较高的Cd胁迫浓度条件下,“茶肥1号”在较短的时期内对Cd具有明显的富集作用。“茶肥1号”各器官Cd含量与Cd胁迫浓度、土壤有效态Cd含量均呈显著正相关关系(P<0.05)。各器官Cd积累量高低顺序为根>茎>叶(表2);吸收系数与生物富集系数亦表现为根>茎>叶(表4)。这主要是由于根系对Cd的富集作用较强,Cd在植物根部的大量积累且大部分被固定,向地上部分运输比例较低,可减轻Cd对整个植株的毒害,这是植物对Cd胁迫的一种耐受方式[22]。因此茎、叶中Cd含量与吸收系数显著低于根部,同时也导致其受到Cd胁迫的影响也最大。这与王春梅等[15]、赵鲁等[16]对茶树(Camelliasinensis)进行的研究结果一致。随着生育期的延长,各处理组根的Cd累积量稳定增加,Cd6(120 mg·kg-1)浓度处理组在收获时根的Cd积累量较生物量测量时增加最多,达61.78%,而Cd7(160 mg·kg-1)浓度处理组只增加了30.52%。该结果一方面可能是Cd6处理浓度较Cd7浓度低,Cd6处理组的生长势较Cd7组好(表1),并且Cd6处理组的富集系数较Cd7大(表4),使得Cd6处理组生长后期能够吸收的Cd较多;另一方面可能是由于Cd7处理组的浓度较高,“茶肥1号”在生长前期根积累Cd较多,更接近其本身潜在的Cd富集饱和量,其吸收速率下降从而使得后续吸收减慢。
本研究中各处理种子的Cd累积量较叶片低,Cd浓度处理160 mg·kg-1时,其累积量仅为4.3 mg·kg-1(表6),对于Cd污染较严重的地区,“茶肥1号”能正常生长,其繁育的种子可用于污染地的连年种植以修复土壤。对于Cd污染较轻的荒地,可以通过连续几年种植“茶肥1号”改善土壤后再种植茶树或者其它作物。“茶肥1号”产草量高,是决明属绿肥圆叶决明的5倍,本研究经Cd处理之后,其产草量仍然可观。因此,“茶肥1号”可像Shit和Cai[9]的研究结果一样,在Cd污染地区种植,一方面可用来改良土壤地力,另一方面可用于对污染地区土壤修复与环境治理。

