血清骨代谢水平在原发性胆汁性肝硬化合并骨质疏松病情监测中的潜在临床价值
林燕 付慧颖 郑葳 吴思凡 谭立明 陈娟娟 李华 曹莉萍
1江西省赣州市人民医院检验科(赣州341000);2南昌大学公共卫生学院(南昌330031);3江西省检验医学重点实验室,南昌大学第二附属医院检验科(南昌330006)
原发性胆汁性肝硬化(primary biliary cirrhosis,PBC)是一种病因未明的肝脏特异性自身免疫性疾病[1],病理表现为肝内细小胆管进行性非化脓性破坏、汇管区周围炎症及纤维化,导致胆汁排泌障碍,最终可发展为肝纤维化、胆汁性肝硬化及肝细胞功能衰竭[2]。随着临床上对PBC的治疗以及研究的深入,骨质疏松(osteoporosis,OP)作为PBC在临床上常见的肝外并发症逐渐受到国内外学者的关注。许多研究证实[3⁃4],根据肝病的持续时间和严重程度,大约14%~52%的PBC患者在疾病发展过程中会并发OP,进而可发展为骨质疏松性骨折,是PBC患者致残致死的重要原因。但是由于PBC的临床分期特点以及并发OP的症状隐匿,但临床PBC患者的骨密度以及骨代谢水平监测容易被忽视,患者往往是通过全腹部增强CT检查时发现腰椎椎体压缩性骨折才发现,从而导致此类患者的生活质量及疾病预后受到严重影响。有研究显示[5],维生素D受体多态性与PBC的罹患风险具有较显著的相关性,可能是PBC早期筛选的指标,本文即通过检测PBC患者血清中25⁃羟维生素D(25 hydroxy vitamin D,25⁃(OH)D)、骨源性碱性磷酸酶(bone alkaline phosphatase,BALP)、骨钙素(osteocalcin,OC)和甲状旁腺激素(parathyroid hormone,PTH)的水平,探讨骨代谢水平在PBC合并OP以及PBC的病程进展和预后之间的相互关系,为临床患者的病情监测及预后提供参考,现报告如下。
1 资料与方法
1.1一般资料
1.1.1 研究对象 选取2014年10月至2017年7月期间江西省赣州市人民医院及南昌大学第二附属医院门诊及住院确诊为PBC患者和同期健康体检者。入组中PBC患者均符合2009年美国肝病学会(AASLD)发布的原发性胆汁性肝硬化诊疗指南[6],OP的诊断标准参照2014年美国骨质疏松基金会(National Osteoporosis Foundation,NOF)发布的骨质疏松症临床预防和治疗指南[7]。其中PBC患者112例,包括PBC并发OP(OP组)45例,其中男5例,女40例,年龄21~87岁,平均(59.35±13.42)岁。PBC未并发OP(NOP组)67例,其中男8例,女59例,年龄25~77岁,平均(52.66±11.47)岁;将未并发OP组按照患者的临床特征、相应体征以及检查结果的综合判断分为代偿期和失代偿期两组,其中代偿期37例,男5例,女32例,年龄25~76岁,平均(51.65±11.67)岁;失代偿期30例,男3例,女27例,年龄34~77岁,平均(53.48±11.27)岁。另选南昌大学第二附属医院同期健康体检者50例作为对照组,其中男21例,女29例,平均(46.37±10.20)岁。所有患者均符合相关指南诊断标准,并经相关科室医生确诊。组间性别、年龄差异无统计学意义(P>0.05),具有可比性。所有标本均在患者知情同意条件下获得,并获得南昌大学第二附属医院伦理委员会批准许可。
1.1.2 纳入标准 符合下列条件者予以纳入:(1)研究对象均签署知情协议书,并且自愿参与;(2)患者诊断明确,影像、临床学病历资料详实;(3)对入选患者的资料再次评估,排除合并其他自身免疫性疾病;(4)健康体检者各系统常规检查无异常;(5)入选患者均符合相应疾病指南要求。
1.1.3 排除标准 符合以下任一情况者予以排除:(1)血清肝炎病毒指标阳性;(2)合并严重心脑血管病、肾脏疾病、肺部疾病、甲状腺疾病、糖尿病、血液病以及肿瘤等;(3)其他原因造成急慢性肝功能损伤的病人,如寄生虫、药物、酒精、中毒等;(4)6个月内服用过影响骨代谢试剂,如钙制剂、维生素D、雌激素以及糖皮质激素等;(5)妊娠或哺乳期妇女;(6)不符合纳入标准者。
1.2 方法和试剂
1.2.1 标本的采集 所有入选患者于入院后24 h内采集空腹不抗凝静脉血3.00 mL,静置30 min后以1026×g离心15 min后备用。
1.2.2 检测方法
1.2.2.1 骨代谢指标的检测 血清25⁃(OH)D、OC及PTH检测采用电化学发光法(Electrochemilumi⁃nescence immunoassay,ECLIA),仪器及试剂采用罗氏诊断产品(上海)有限公司生产的全自动电化学发光分析仪cobase 601及配套试剂盒;BALP检测采用冷凝集亲合法,配套试剂盒采用北京中生金域诊断技术有限公司。以上操作均严格按照试剂说明书进行。
1.2.2.2 骨密度的检测 采用国际公认的骨密度检测方法,双能 X 线吸收法(dual⁃energy X⁃ray absorptiometry,DXA)检测第 2~4腰椎及股骨近端的骨密度(g/cm2),操作严格按照仪器说明书进行。
1.3 评价指标
1.3.1 骨代谢指标 比较各组25⁃(OH)D,按照国际标准[8]:≥30 ng/mL 为充足,20~29 ng/mL 为不足,25⁃(OH)D <20 ng/mL为缺乏。BALP孕妇≤150 U/L为正常,儿童≤200U/L为正常,其余人群≤100 U/L为正常;比较各组PTH,PTH 15~65 pg/mL为正常,其余为异常;OC11~48 ng/mL为正常,其余为异常。
1.3.2 骨质疏松 按照国际标准[9],通过DXA法测定的T值表示受检者的骨密度与正常同性别骨密度峰值的差别,为OP诊断的金标准:当T介于正常参考值1~2.5个标准差时定义为骨量减少,当T低于正常参考值2.5个标准差时定义为骨质疏松。
1.4 统计学方法 采用SPSS 22.0软件统计分析处理数据。计量资料均检验是否符合正态分布,若符合即为参数计量资料,采用±s表示,两组间比较行Levene's方差齐性检验,若方差相等,则进行独立样本t检验,多组间比较采用单因素方差分析法;计数资料以相对数构成比或率(%)表示,组间比较采用x及校正后x检验。采用二元logistic回归分析判断合并OP的预测因子。对计量资料作受试者特征曲线(receiver operating characteris⁃tic,ROC),计算 ROC曲线下面积(area under the curve,AUC),AUC在0.5~0.7为诊断价值较差,0.7~0.9为诊断价值中等,>0.9为诊断价值高。检验水准α=0.05,以P<0.05表示差异具有显著统计学意义,P<0.01表示差异有非常显著统计学意义。
2 结果
2.1 各组一般临床资料 PBC并发OP组、PBC未并发OP组、PBC代偿期组以及失代偿期组的年龄、性别与对照组差异均无显著统计学意义(P>0.05),具有可比性。见表1。

表1 各组一般临床资料比较Tab.1 Comparison of the general clinical data of each group
2.2 各组骨代谢指标结果 PBC合并OP组与PBC未合并OP组以及正常对照组之间25⁃(OH)D、BALP、OC以及PTH水平的差异均具有显著统计学意义(P<0.05)。见表2。
表2 各组25⁃(OH)D、BALP、OC、PTH检测结果比较Tab.2 Serum levels of 25⁃(OH)D、BALP、OC、PTH of each group ± s
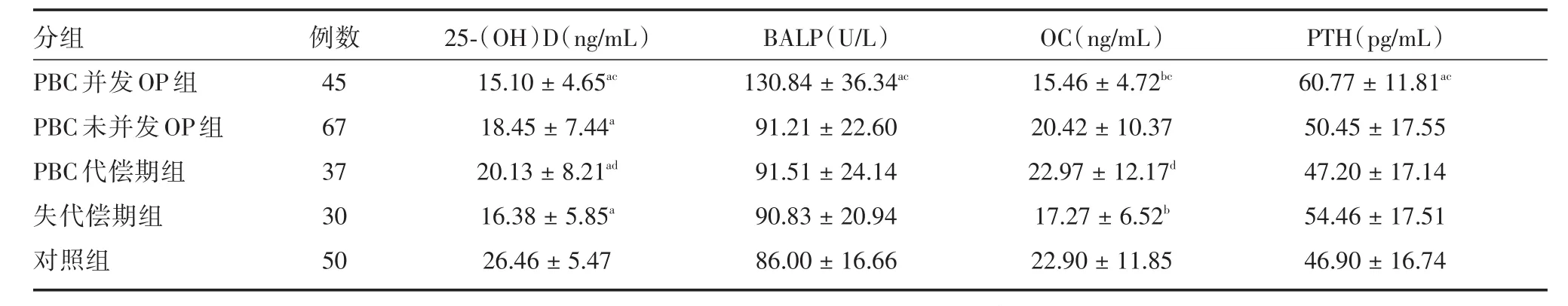
表2 各组25⁃(OH)D、BALP、OC、PTH检测结果比较Tab.2 Serum levels of 25⁃(OH)D、BALP、OC、PTH of each group ± s
注:与对照组比较,aP<0.01,bP<0.05;与PBC未并发OP组比较,cP<0.01,与失代偿期组比较,dP<0.05
分组PBC并发OP组PBC未并发OP组PBC代偿期组失代偿期组对照组例数45 67 37 30 50 25⁃(OH)D(ng/mL)15.10±4.65ac 18.45±7.44a 20.13±8.21ad 16.38±5.85a 26.46±5.47 BALP(U/L)130.84±36.34ac 91.21±22.60 91.51±24.14 90.83±20.94 86.00±16.66 OC(ng/mL)15.46±4.72bc 20.42±10.37 22.97±12.17d 17.27±6.52b 22.90±11.85 PTH(pg/mL)60.77±11.81ac 50.45±17.55 47.20±17.14 54.46±17.51 46.90±16.74
2.3 OP组骨代谢指标的二元Logistic回归分析根据单因素方差分析的结果,将25⁃(OH)D、BALP、OC、PTH对PBC合并OP患者进行二元Lo⁃gistic回归分析,结果显示,四项指标均与PBC合并OP的发生具有密切相关性。见表3。
2.4 血清骨代谢指标检测结果的ROC曲线分析 根据二元Logistic回归分析与OP组测得的各项指标的检测水平绘制ROC曲线。见图1。各指标曲线下面积AUC、95%置信区间(Confidence in⁃tervals,CI)及P值。见表4。
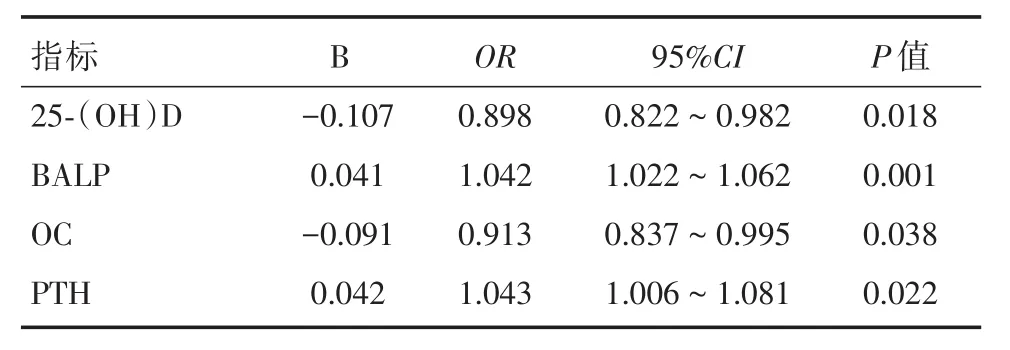
表3 OP组与NOP组骨代谢指标的二元Logistic回归分析Tab.3 The binary Logistic regression analysis of bone metabolic index between OP and NOP Groups
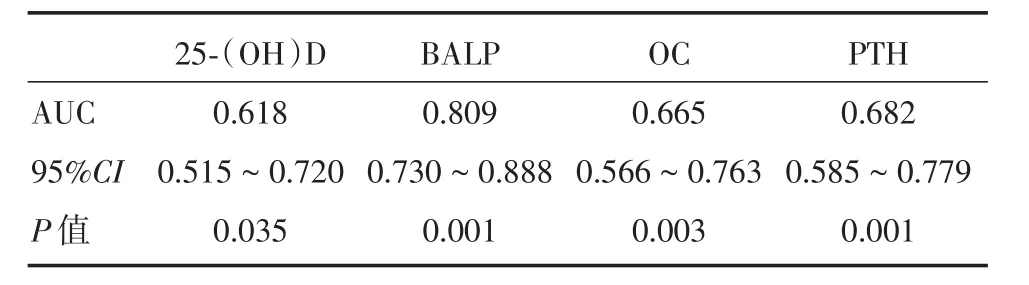
表4 各指标曲线下面积AUC、95%置信区间及P值Tab.4 AUC,95%confidence intervals and p of each idex
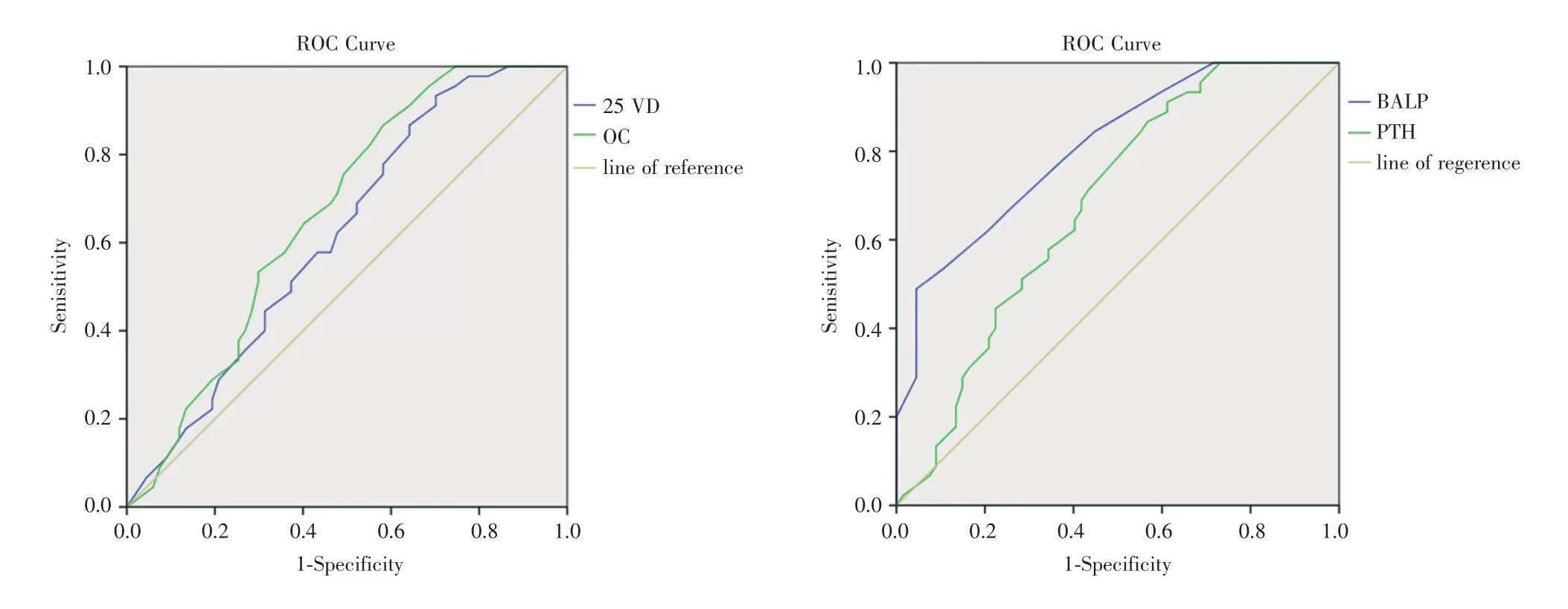
图1 血清25⁃(OH)D和OC(左)、BALP和PTH(右)ROC曲线图Fig.1 ROC curve of 25⁃(OH)D and OC(left),BALP and PTH(right)
3 讨论
PBC是一种以胆汁淤积为主要病理表现的慢性自身免疫性肝病[10],该病多发于中年女性,男女比例约为9:1,发病高峰为40~60岁。研究表明[11],PBC在欧美地区的白种人中发病率较高,而非洲和亚洲人较低。在我国,以往认为PBC是一种少见疾病,但近年来,随着临床医师对PBC疾病的了解和认识的提高,以及各种自身免疫性肝病抗体,尤其是抗线粒体抗体(antimitochondrial antibody,AMA)检测的开展,确诊为PBC的患者逐年增多。该病起病隐匿,经过缓慢,临床表现为乏力、食欲不振、腹痛腹胀、皮肤瘙痒、关节痛、黄疸、呕血或黑便等不适症状,常合并干燥综合征、硬皮病以及类风湿性关节炎等其他自身免疫性疾病。代谢性骨病发生在慢性肝病(chronic liver desease,CLD)被称为肝性骨病(hepatic osteodystrophy,HO)[12]。研究指出[13],由 CLD 引起的 HO 在肝硬化尤其是PBC中最为常见。临床上,HO的主要临床表现为OP和骨软化症,其中最常见的是OP。OP是多种原因引起的以单位体积内骨组织量减少,骨微结构破坏,骨脆性增加的一类代谢性骨病,易加重骨折的发病风险[14],严重影响患者的生活质量。骨密度检测虽然是临床上诊断骨质疏松的金标准,但是一方面,它无法反映出骨骼正在进行的代谢活动,在OP发病早期检测的灵敏度不高,且本身具有放射性;另一方面,PBC患者并发OP的早期往往容易被忽视,导致患者错过最佳治疗时机。因此,寻找有效的临床检测指标对于PBC患者合并OP早期的病情监测以及预后治疗尤其重要。
人体内正常的骨代谢是体内正常骨组织进行不断改建活动的复杂过程,主要由参与骨吸收的破骨细胞和参与骨形成的成骨细胞介导,因此人体内每天都会吸收与合成一定量的骨组织,并且二者保持动态平衡。在PBC的病情进展中,骨吸收增加或骨形成减少,骨转换失衡,则可发生骨量丢失和骨质疏松症。由于PBC并发OP的病理过程较为复杂,目前临床上尚无其明确的发生机制。考虑到OP的发生与PBC患者的骨吸收和骨形成有关,而这两者主要受钙⁃VitaminD3⁃PTH轴的控制,另据文献报道[15],PBC并发OP与维生素D受体(vitamin D receptor,VDR)基因多态性有关。OC和BALP作为血清中重要的骨转换标志,由成骨细胞合成和分泌,在骨转化和骨形成中起重要作用。因此,本文联合检测血清25⁃(OH)D、BALP、OC以及PTH,旨在探究骨代谢水平与PBC并发OP的关系以及其在PBC病情进展过程中的预测价值。
维生素D(vitamin D,VD)是一种维持体内钙磷和骨骼稳态的类固醇脂溶性激素[16],人体不能自主合成,主要通过日照和食物摄取。VD在体内有多种存在方式,其中最重要的就是VD2和VD3。肝脏作为VD储存和代谢的重要场所,人体经食物摄入的VD2和VD3在胆汁酸的作用下被吸收进入肠腔,皮肤合成的VD则储存于脂肪细胞并在肝内经25⁃羟基化后生产25⁃(OH)D,继而在肾脏进一步羟化成为活性最高的1,25⁃(OH)2D,它依赖于VDR发挥作用,但由于半衰期较短,临床主要通过检测25⁃(OH)D反映体内VD水平。本研究中,OP组和NOP组的血清25⁃(OH)D水平与正常对照组相比,差异均有非常显著统计学意义(P<0.01),且OP组与NOP组间25⁃(OH)D水平差异也存在非常显著统计学意义(P<0.01),提示25⁃(OH)D在PBC患者并发OP的早期有一定的检测价值。根据二元logistic回归分析结果,25⁃(OH)D与PBC合并OP呈负相关(OR=0.898,P=0.018),即25⁃(OH)D是PBC合并OP的保护因素,进一步说明25⁃(OH)D在此类患者的病情监测和临床预后治疗中存在一定价值。另外,在NOP组中,代偿组和失代偿组的血清25⁃(OH)D与对照组相比均存在非常显著统计学差异(P<0.01),组间的25⁃(OH)D差异也存在显著的统计学意义(P<0.05),这与文献报道的结果一致[8],提示25⁃(OH)D与单纯PBC患者的病程进展有关,临床上对于PBC患者可动态监测其血清25⁃(OH)D浓度,以便更好掌握病情。PTH作为体内调节钙磷稳定的另一重要激素,能减弱肾小管对于磷的重吸收,增加尿磷的排出,从而使肾小管对于钙的重吸收能力增强;另一方面,PTH还能增强肾羟化酶活性,促进1,25⁃(OH)2D的合成以及肠腔对于钙的吸收,提高血钙水平。PBC患者因进行性非化脓性胆管内炎症,导致胆汁分泌异常,VD3第一步羟化受阻;另一方面,由于PBC患者大量胆汁淤积,通过负反馈调节机制使得胆汁分泌进一步减少,加重VD吸收障碍。体内VD缺乏,加之低血钙水平,通过钙⁃Vita⁃minD3⁃PTH轴的反馈作用,继发性引起甲状旁腺功能亢进,PTH分泌增多,导致骨代谢和骨量丢失加速,促进骨质破坏,骨质疏松发生概率增大。本研究中OP组PTH水平与NOP、正常对照组间均具有非常显著差异(P<0.01),二元logistic回归分析结果显示,PTH是PBC患者合并OP的危险因素(OR=1.043,P=0.022)。
BALP是由成骨细胞合成后分泌到细胞外与骨基质结合的一种组织非特异性碱性磷酸酶的特殊形式,是反映骨形成和代谢的特异性指标[17]。当机体发生骨质疏松时,骨吸收亢进从而代偿性引起骨形成增加,静止的成骨细胞被激活,大量BALP被释放进入血液。本研究中OP组与NOP组、正常对照组之间血清BALP的水平都存在非常显著统计学差异(P<0.01),且二元logistic回归分析结果显示,PBC患者BALP水平与并发OP呈正相关且相关性明显(OR=1.042,P=0.001),说明PBC患者血清BALP升高是并发OP的危险因子,临床上对于此类患者应多加重视,尽早防治以避免OP的发生。
OC是由成骨细胞产生的能维持骨正常矿化速度的维生素K(vitamin K,VK)依赖性非胶原蛋白,大部分OC合成后沉积在骨基质中,小部分进入血循环,因此,血清OC浓度可反映成骨细胞活性。PBC患者由于胆汁分泌异常,肠道对于钙和VD的吸收减少,且由于肝硬化导致VK缺乏,二者共同作用使得成骨细胞合成分泌OC减少。本研究中,OP组与正常对照组血清OC水平存在显著差异(P<0.05),与NOP组血清OC水平存在非常显著统计学差异(P<0.01)。根据二元logistic回归分析结果显示,OC与PBC合并OP呈负相关(OR=0.913,P=0.038),但相关性低于25⁃(OH)D。
根据二元logistic回归分析结果对以上四个骨代谢指标绘制ROC曲线,结果显示:BALP对于PBC患者并发OP的诊断有一定的准确性(AUC=0.809,P=0.001),PTH(AUC=0.682,P=0.001)、OC(AUC=0.665,P=0.003)和 25⁃(OH)D(AUC=0.618,P=0.035)次之,但这三者单独检测的准确性还有待提高。
综上所述,由于临床PBC患者常伴有消化不良、食欲不振以及胆汁排泌障碍等,导致VD摄入不足,加之病情进展过程中肝功能损害,体内VD吸收障碍,血钙水平降低,继发性引起成骨细胞合成分泌OC减少,甲状旁腺功能亢进,PTH分泌增多,导致骨量丢失加速,引起OP。当OP发生时,由于骨吸收增多代偿性激活成骨细胞,大量BALP释放入血,导致血清BALP水平升高。因此,对于临床PBC患者除常规肝功能检测外,还应重视其骨代谢水平,联合检测25⁃(OH)D、BALP、OC、PTH和骨密度有助于PBC患者合并OP的早期预防以及PBC的病情监控和预后,对于有效临床治疗方案的制定具有重要的指导意义。

