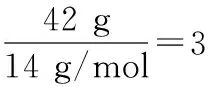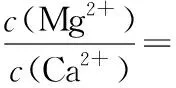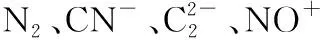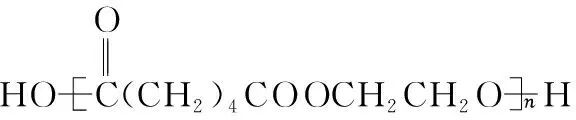“超级全能生”2018高考全国卷26省12月联考甲卷
可能用到的相对原子质量:H—1 C—12 O—16 Na—23
Fe—56 Co—59 Cu—64 Ba—137
一、选择题:本题共7小题,每小题6分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学与社会、生活密切相关,下列说法正确的是
( )
A.PM2.5是指空气中直径小于或等于2.5 μm的颗粒物,与肺癌等疾病的发生有关
B.医院中常用95%的酒精来消毒,是因为95%的酒精杀菌效果最佳
C.用米汤可以检验食盐中是否加碘
D.自来水厂可用Fe2(SO4)3或ClO2代替明矾的净水作用
8.设NA是阿伏加德罗常数的值,下列说法错误的是
( )
A.42 g C2H4和C3H6混合气体中的碳原子数为3NA
B.1 mol Fe与1 mol Cl2完全反应时转移电子数为2NA
C.1 L 1 mol·L-1H3PO4溶液中H+数目为3NA
D.78 g Na2O2中共价键数目为NA
( )
A.该反应属于取代反应
B.m、n、p均可以使酸性高锰酸钾溶液褪色
C.m、n、p中所有原子可能共面
D.m、n、p均属于不饱和烃
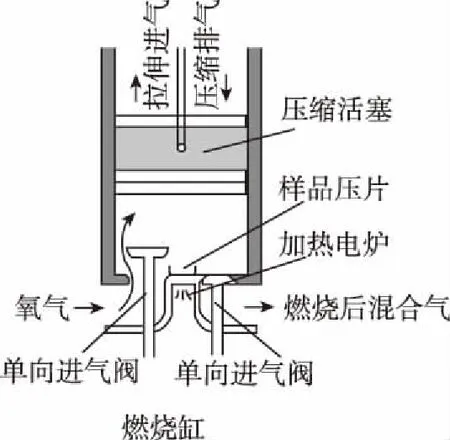
10.某学习小组设计下列实验检验草酸晶体受热分解的产物(可能含有CO2、CO、H2、H2O),装置如图所示(已知草酸晶体熔点较低,加热熔化且易汽化,草酸钙难溶于水)。下列说法不正确的是
( )

A.②中澄清石灰水变浑浊,不能证明分解产物中一定含有CO2
B.⑤硬质玻璃管中黑色粉末变红色,⑥中澄清石灰水变浑浊,证明分解产物中含有CO
C.①也可以用于实验室制备乙酸乙酯的发生装置
D.采用点燃法除尾气时,必须先检验气体纯度,再点燃
11.近年来研究表明高铁酸盐在能源、环保等方面有着广泛的用途。我国学者提出在浓NaOH溶液中用电解法制备高铁酸钠(Na2FeO4),电解装置如图所示,下列说法不正确的是
( )
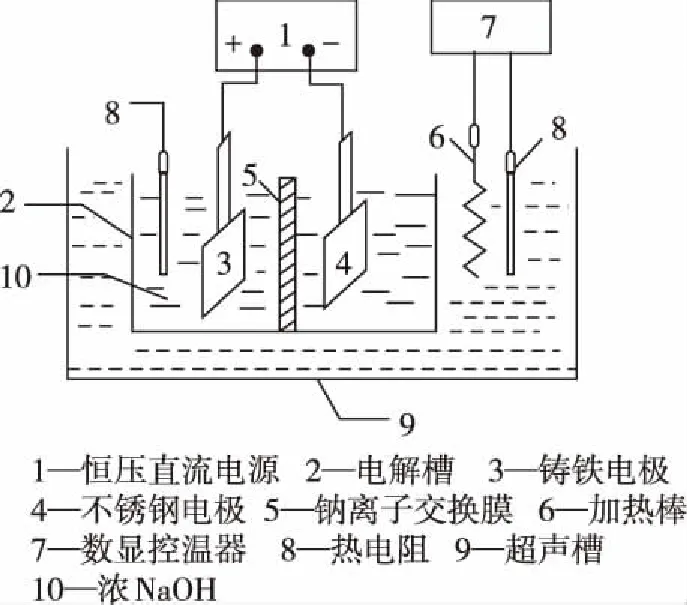
A.钠离子通过隔膜的方向:左→右

C.工作一段时间后,收集到3.36 L(标准状况下)的气体,同时获得0.05 mol的高铁酸钠
D.阳极区周围溶液的pH升高
12.短周期主族元素W、X、Y、Z的原子序数依次增大,W原子的最外层电子数是次外层的3倍,Z是所在周期中原子半径最小的。W、X和Y三种元素组成的盐溶液呈碱性,向其中逐滴加入稀硫酸,先产生白色沉淀,后沉淀消失。下列说法不正确的是
( )
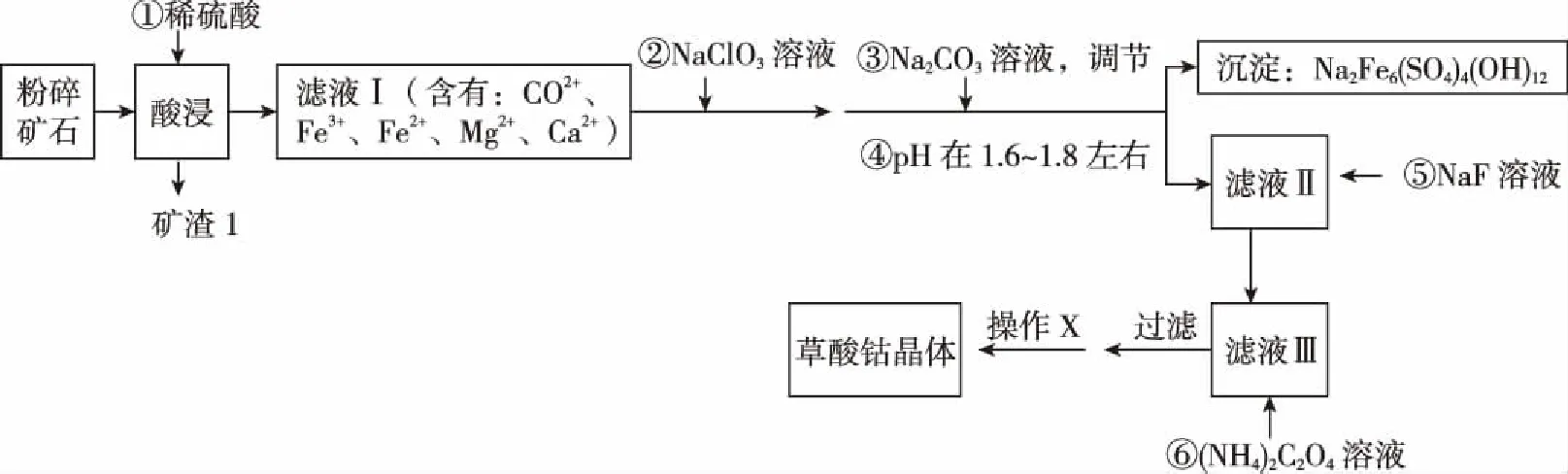
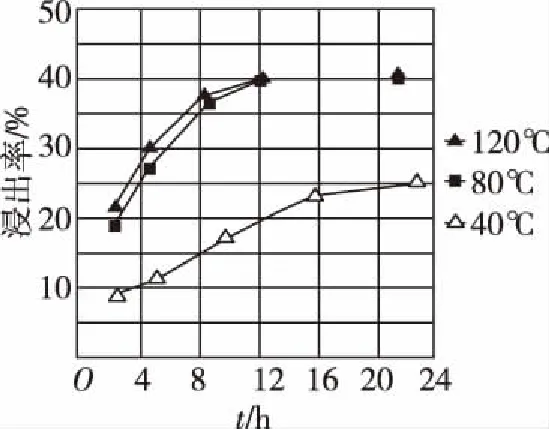
A.简单离子半径大小:r(W)>r(X)>r(Y)
B.X、Y和Z三者的氧化物对应的水化物两两之间能发生反应
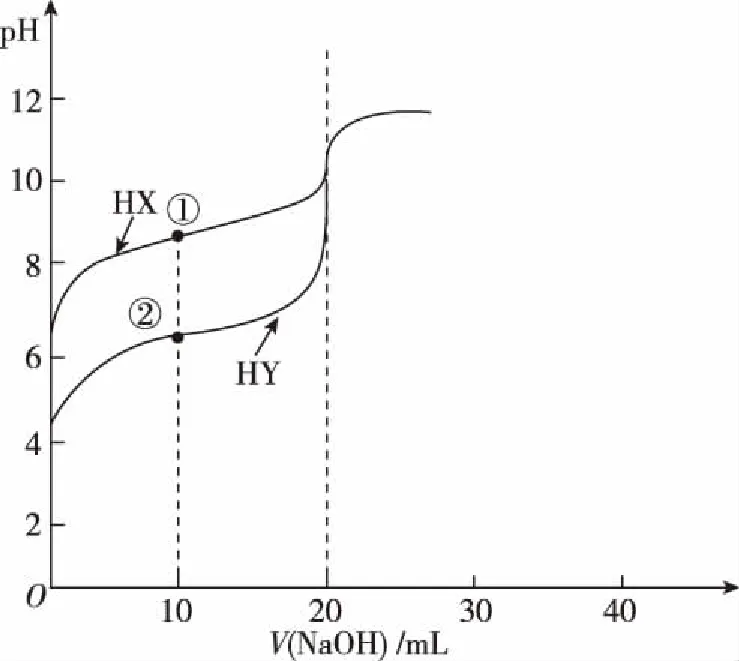
C.简单离子的氧化性:X D.Y与Z形成化合物的水溶液显酸性 13.用0.100 mol·L-1NaOH溶液分别滴定20.00 mL 0.100 mol·L-1的HX和HY两种酸溶液,滴定过程中溶液的pH与加入碱溶液的体积关系如图所示。下列说法正确的是 ( ) A.Ka(HX)>Ka(HY) B.滴定时均可使用酚酞作指示剂 C.常温下,物质的量浓度相同的NaX和NaY混合溶液中:c(HX)>c(HY)>c(OH-)>c(H+) D.点①和点②溶液中存在:c(Y-)-c(X-)=c(HX)-c(HY) 二、非选择题:共58分。第26~28题为必考题,每个试题考生都必须作答。第35~36题为选考题,选择一题作答。 26.(14分)燃烧法是测定有机物分子式的一种重要方法。 Ⅰ.实验原理:将一定量的有机物样品放入燃烧缸中,通入足量氧气使之完全燃烧,根据生成物的质量确定该有机物的分子式(查阅资料:青蒿素的相对分子质量为282)。 Ⅱ.实验装置如图: (注:各装置中反应或吸收均完全) Ⅲ.测定青蒿素(仅含有C、H、O元素)分子式的实验步骤:①样品压片→②装片→③压缩排气→④拉伸进气→⑤加热燃烧→⑥压缩排气→⑦燃烧后的混合气体依次通入装置f、g中。 回答下列问题: (1)仪器g的名称:____________。 (2)步骤③的操作目的是__________________。 (3)装置g中的碱石灰的作用__________________。 (4)装置f中溶液出现________,说明青蒿素含有碳元素。f中发生反应的化学方程式为_____________________。 (5)取青蒿素样品压片14.1 g,待充分燃烧后,经测定装置f的质量增加42.9 g,经过滤、洗涤、干燥得到147.75 g固体。 ①上述“洗涤”沉淀的具体操作是__________________。 ②青蒿素中碳元素的质量分数φ(C)=________%,青蒿素的分子式为____________。 27.(15分)钴是一种战略资源,在航空航天工业中应用广泛。从含钴的矿石(主要含CoO、少量铁的氧化物、MgO、CaO等)中提取钴的流程如下: (1)“酸浸”前,将矿石粉碎的目的是__________________。 (2)“酸浸”实验中,钴的浸出率结果如图所示。由图可知,选出最佳的浸出温度和时间:____________。 (3)步骤②中加入NaClO3的作用为__________________。 (4)在水法冶金中,广泛采用生成黄铁矾的办法除去杂质铁,请你配平该反应的化学方程式: [已知Ksp(MgF2)=6.4×10-9、Ksp(CaF2)=2.7×10-11] (6)操作X的名称为____________。 (7)5.49 g草酸钴晶体(CoC2O4·2H2O)在空气中高温加热反应,经测定产生的气体只有水蒸气和CO2,剩余固体的质量为2.41 g,写出反应的化学方程式:__________________。 28.(14分)SO2是一种大气污染物,我国治理大气污染物已列入《“十三五”规划纲要》中,以下是根据其性质处理SO2的两种方法,回答下列问题: Ⅰ.CO还原法 CO的燃烧热为ΔH2=-283.0 kJ·mol-1 (1)请写出SO2(g)与CO(g)反应生成S(g)和CO2(g)的热化学方程式:__________________。 (2)在温度为T℃,容积为10 L的恒容密闭容器中,充入1 mol CO和0.5 mol SO2发生上述反应,实验测得生成CO2的体积分数(φ)随着时间的变化曲线如图所示: ①达到平衡状态时,SO2的转化率为________,该温度时反应平衡常数为____________。 ②其他条件保持不变,再向上述平衡体系中充入SO2(g)、CO(g)、S(g)、CO2(g)各0.2 mol,此时v(正)________(填“>”“<”或“=”)v(逆)。 a.混合气体的压强不再变化 b.混合气体的密度不再变化 c.混合气体的物质的量不再变化 d.单位时间内有1 mol SO2消耗同时消耗2 mol CO2 Ⅱ.氨水吸收法 取20.00 mL起始浓度为xmol·L-1(NH4)2SO3的反应后溶液于锥形瓶中,用浓度ymol · L-1KMnO4标准溶液滴定,重复三次,平均消耗KMnO4的体积是VmL。 ①写出滴定过程中反应的离子方程式:__________________。 ②α=________×100%。(用相关的物理量表示) 35.[物质结构与性质](15分) 司母戊鼎是国家一级文物,世界上出土最大、最重的青铜(含铜84.77%、锡11.64%、铅2.79%)礼器,享有“镇国之宝”的美誉。 (1)铜原子基态电子排布式为__________________。 (2)[Cu(NH3)4]SO4是一种重要染料及合成农药的中间体。 ①[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从大到小的顺序为____________________,NH3中心原子的杂化方式为____________。 ②[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为____________。 (3)CuCl的盐酸溶液能吸收CO,形成氯化羰基铜[Cu(CO)Cl·H2O],通常形成二聚体,结构如图所示: ①写出与CO互为等电子体的分子或离子:____________ (任意两个即可),1 mol CO中含有的π键数目为________。 ②氯化羰基铜[Cu(CO)Cl·H2O]中,与Cu形成配位键的原子有__________________。 (4)SnCl4是一种无色液体,熔点为-33℃,沸点为114.1℃,在潮湿的空气中强烈水解同时产生大量白色烟雾。 ①推测SnCl4属于________(填“离子”或“共价”)化合物。 ②SnCl4遇到水反应的化学方程式:__________________。 (5)上述某金属的二元化合物是一种半导体材料,其晶胞结构如图所示,晶胞参数a=0.430 nm。 ①该化合物的化学式为____________(用含“X”“Y”符号表示)。 ②设化合物的摩尔质量为Mg·mol-1,其密度是________________g·cm-3。(只要求列算式,不必计算,阿伏加德罗常数为NA) 36.[有机化学基础](15分) 聚己二酸乙二醇酯是一种可降解的聚酯类高分子材料,广泛应用在制造双组分聚氨酯胶黏剂、聚氨酯弹性体等。合成聚己二酸乙二醇酯的路线如下: 已知:①烃A的相对分子质量为84,核磁共振氢谱显示只有一种化学环境的氢; ②经测定烃E在标准状况下的密度为1.25 g·L-1; ③核磁共振氢谱显示有机物F只有一种化学环境的氢; 回答下列问题: (1)A的名称:____________。 (3)F的结构简式:____________。 (4)写出由B生成C的化学方程式:__________________。 写出由D和H生成聚己二酸乙二醇酯的化学方程式:_______________。 (5)D的同分异构体中能同时满足下列条件的共有________种(不含立体异构)。 a.能与饱和NaHCO3溶液反应产生气体 b.既能发生银镜反应,又能发生水解反应 (6)请写出由乙二醇为原料制备聚丁二酸乙二醇酯(PES)的合成路线流程图(无机试剂可以任选)。 答案详解 7.答案:A 解析:PM2.5是指大气中直径≤2.5 μm的颗粒物,也叫可入肺颗粒物,其粒径小、面积大,易附带有毒、有害物质,与肺癌、哮喘等疾病的发生密切相关,故选项A正确;医院中常用75%(体积分数)的酒精消毒,过高浓度的酒精会在细菌表面形成一层保护膜,阻止其进入细菌体内,难以将细菌彻底杀死,故选项B错误;碘盐中的碘存在于碘酸钾中,不是碘单质,不能使米汤中的淀粉变蓝,故选项C错误;ClO2有强氧化性,具有杀菌消毒的功能,不具有净水作用,故选项D错误。 点评:本题考查化学与STSE,涉及PM2.5、酒精、淀粉、日常生活净水剂原理等相关知识。 8.答案:C 点评:本题考查有关NA的问题,涉及原子数、离子数、共价键数、电子转移数等知识。 9.答案:D 点评:本题考查有机化合物,涉及反应类型、烃的性质、不饱和烃、原子共面等问题。 10.答案:B 解析: ②中澄清石灰水变浑浊,可能是分解产物中的CO2与石灰水反应生成碳酸钙沉淀引起的,也可能是草酸蒸气与石灰水反应生成草酸钙沉淀引起的,故选项A正确;只有同时满足③中澄清石灰水不变浑浊、⑤中硬质玻璃管内的黑色粉末变红色、⑥中澄清石灰水变浑浊,才能证明分解产物中含有CO,故选项B错误;①可作为液液加热的发生装置,故也可用于实验室制备乙酸乙酯的发生装置,故选项C正确;点燃可燃性尾气时,必须先检验气体纯度,再点燃,故选项D正确。 点评:本题考查化学实验基本操作,涉及草酸受热分解部分产物的检验等知识。 11.答案:D 点评:本题考查电化学,涉及离子的移动方向、电极反应式的书写、pH的变化、电子转移的计算等知识。 12.答案:B 解析:由W原子的最外层电子数是次外层的3倍,可知W是O;Z是所在周期中原子半径最小的原子,可知Z是Cl;由W、X和Y三种元素组成的盐溶液呈碱性,向其中逐滴加入稀硫酸,先产生白色沉淀,后沉淀消失,可知该盐为NaAlO2;又W、X、Y、Z的原子序数依次增大,故W、X、Y、Z分别为O、Na、Al、Cl。O2-、Na+、Al3+电子层数相同,核电荷数依次增大,原子核对核外电子的吸引力增强,半径依次减小,即半径大小:O2->Na+>Al3+,故选项A正确;X、Y的氧化物对应的水化物分别为NaOH、Al(OH)3,而Z的氧化物对应的水化物有多种(如HClO、HClO2、HClO3、HClO4),若是HClO则与NaOH、Al(OH)3无法满足两两之间皆能发生反应,故选项B错误;单质的还原性:Na>Al,离子的氧化性:Na+ 点评:本题考查元素周期律,涉及重要元素的推断、离子半径大小比较、最高价氧化物对应水化物的酸碱性、简单阳离子的氧化性强弱、盐溶液酸碱性判断等知识。 13.答案:D 点评:本题考查水溶液中的离子平衡。以强碱滴定弱酸反应为例,考查弱酸电离常数的比较、指示剂的选择、离子浓度大小关系的判断等知识。 26.(14分) (1)球形干燥管 (1分) (2)排除燃烧缸中的空气,减小实验误差 (2分) (3)吸收空气中的CO2和水蒸气,防止对f造成干扰 (2分) (5)①向漏斗中注入蒸馏水直至没过沉淀,待液体流尽后重复操作2~3次 (2分) ②63.8 (2分) C15H22O5(2分) 点评:本题属于化学实验及设计题。以燃烧法确定青蒿素的分子式为载体,考查仪器的认识、实验操作的目的、试剂的选择、实验现象的描述、化学方程式的书写、实验基本操作及有关计算等知识。 27.(15分) (1)增大固体表面积,加快酸浸的反应速率 (2分) (2)80℃、12 h (2分) (3)使Fe2+转化为Fe3+(2分) (4)3、6、6、1、5、6 (共2分) (5)237 (2分) (6)洗涤、干燥 (2分) 点评:本题属于无机化学工业流程分析题。以Co元素重要化合物的工业生产制备为载体,考查影响反应速率的因素、Ksp计算、物质分离提纯的方法、化学反应方程式的书写及配平等知识。 28.(14分) (2)①60% (2分) 3.375 (2分) ②> (2分) ③ad (2分) c(始)/(mol·L-1) 0.05 0.1 0 0 c(转)/(mol·L-1)x2xx2x c(平)/(mol·L-1)0.05-x0.1-2xx2x 点评:本题属于化学概念与原理题。以大气污染物SO2的处理为载体,考查盖斯定律应用、化学图象的分析、可逆反应平衡标志的判断、离子反应的书写及相关计算等知识。 35.(15分) (1)1s22s22p63s23p63d104s1或[Ar]3d104s1(1分) (2)N>O>S (1分) sp3(1分) 平面正方形(或平面四边形) (1分) ②C(碳原子)、O(氧原子)、Cl(氯原子)(都对得2分,不全得1分,写错不得分) (2分) 点评:本题属于选修“物质结构与性质”题。考查核外电子排布、杂化类型、电离能,离子空间构型、共价键类型、等电子体、配位原子、化合物类型判断、反应方程式书写、晶胞中利用均摊法确定晶体的化学式、晶胞密度的计算等知识。 36.(15分) (1)环己烷 (1分) (2)消去反应 (1分) 取代反应(或水解反应) (1分) (5)12 (3分)