慢性淋巴细胞性甲状腺炎对分化型甲状腺癌放射性碘清甲治疗效果的影响
张 腾,胡厚洋,柏庆花,宋丽萍,林岩松
1.锦州医科大学附属第一医院核医学科,辽宁 锦州121001;2.中国医科院学院北京协和医学院核医学科,北京100730
慢性淋巴细胞性甲状腺炎(c h r o n i c lymphocytic thyroiditis,CLT)又称桥本甲状腺炎(Hashimoto’s thyroiditis,HT),是一种临床十分常见的内分泌疾病。近年来,CLT的发病率也呈现明显上升的趋势,从1988年的1.3%上升至2007年的8.8%[1]。分化型甲状腺癌(differentiated thyroid cancer,DTC)作为常见的内分泌恶性肿瘤,其发病率也呈逐年上升的趋势,且全球发病率以每年4%的增幅上涨[2-3]。随着DTC和CLT的发病率明显增加,DTC合并CLT的患者也愈来愈多,根据文献报道,DTC合并CLT患者占全部DTC的比例差别较大,为12.0%~43.8%[4-5]。自1955年Dailey等[6]首次提出DTC与CLT之间存在关联之后,各国学者开始关注两者之间的关系,但结果仍存在争议[7-12]。中国2014版《131I治疗分化型甲状腺癌指南》及2015版《美国甲状腺学会(American Thyroid Association,ATA)指南》中并未提及CLT对DTC的影响,但本课题组前期研究[13]显示,CLT能影响DTC患者原发灶的生长方式,如肿瘤大小、多灶性等,甚至与局部及远处侵袭性相关。为探究CLT对DTC患者疗效的影响,本研究从CLT对DTC患者术后病理特征及131I治疗的疗效反应的影响等方面进行分析。
1 资料和方法
1.1 一般资料
回顾性收集了2014年1月—2016年1月就诊于北京协和医院核医学科的DTC患者1 070例,经筛查纳入满足以下全部标准者122例:① 经过甲状腺全切或次全切术,并根据术前评估行中央区淋巴结清扫和(或)选择性颈侧区淋巴结清扫;②接受131I清甲治疗并进行131I治疗后疗效评估;③具备详细病理描述资料,如病理提示DTC周围组织为淋巴细胞性甲状腺炎或正常甲状腺组织;④ 具备治疗前、后的血清学及影像学详尽随访数据。
上述患者术后评估为中、低危患者,均在北京协和医院核医学科行131I治疗。治疗前采取停服甲状腺激素方式升高促甲状腺激素(thyroid stimulating hormone,TSH)至30 U/L,131I清甲治疗剂量为30 GBq,治疗后5~7 d行全身显像[9]。治疗后3个月行首次治疗后随访,6个月停用甲状腺激素,全面进行血清学(甲状腺球蛋白及相应甲状腺球蛋白抗体水平)及影像学动态评估,并根据动态评估后的实时动态复发危险分层对甲状腺激素剂量及后续治疗进行调整[10]。以门诊复查的方式对患者进行随访,随访时间为24个月。本研究内容已经协和医院科研伦理委员审核批注并备案。
1.2 分组及碘清甲治疗、疗效评估标准
CLT1组:DTC病灶周围组织经病理证实为淋巴细胞性甲状腺炎。CLT0组:DTC病灶周围组织经病理证实为正常甲状腺组织。依据2015年ATA指南评估患者对131I治疗的疗效反应见表1。
1.3 统计学处理
采用SPSS 22.0统计软件,计量资料以x±s表示,计数资料以率表示,采用两样本t检验、单因素方差分析及χ2检验分析数据,CLT与疗效反应的关系采用相关性分析。P<0.05为差异有统计学意义。
2 结 果
2.1 CLT1组与CLT0组一般病理特征对比
本研究纳入的128例非远处转移DTC患者中,伴随CLT者55例(CLT1组,43%),伴随正常甲状腺组织者73例(CLT0组,57%)。CLT1组在男性患者比率(P=0.011)、原发灶大小(P=0.028)方面明显低于CLT0组。两组患者在年龄、多灶性、淋巴结分期、被膜及被膜外侵犯、TNM分期等方面差异无统计学意义(表2)。
2.2 CLT1与CLT0组患者甲状腺球蛋白抗体水平的变化
CLT1组患者经治疗后,其甲状腺球蛋白抗体(thyroglobulin antibody,TgAb)水平较治疗前显著下降[(134.33±58.39)IU/mL vs(328.99±128.18 IU/mL)],降幅达59.17%;CLT0组患者治疗后甲状腺球蛋白抗体水平也呈下降趋势[(51.88±234.34)IU/mL vs(68.95±168.48)IU/mL],降幅达24.76%。

表 1 DTC患者131I治疗后的疗效反应评价标准Tab. 1 Criteria of response to 131I therapy stratification system in DTC patients
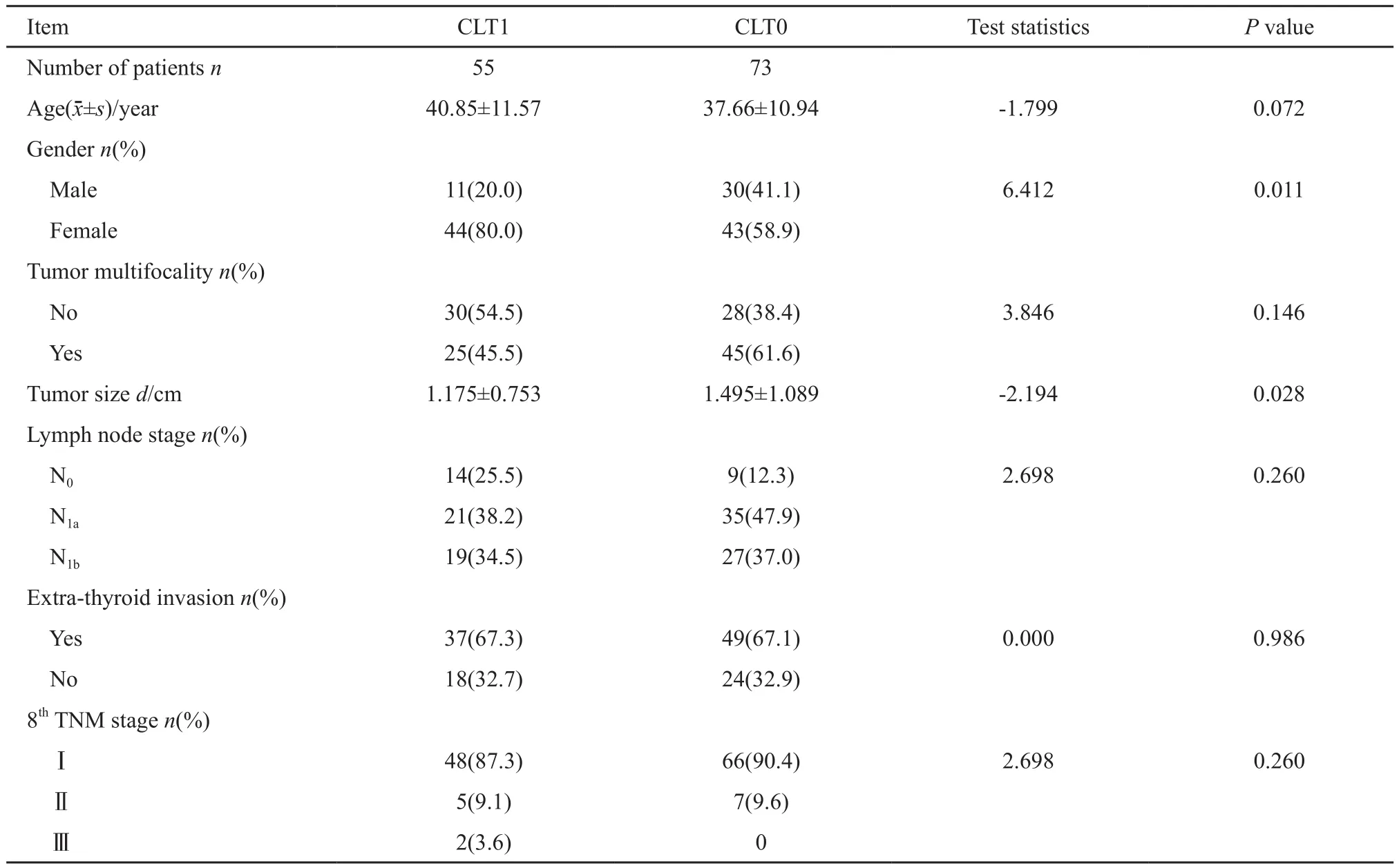
表 2 两组患者临床病理特征Tab. 2 Clinicopathologic features of the patients in two groups
2.3 CLT1与CLT0组患者疗效反应对比
CLT1组患者治疗后ER、IR、BIR、SIR率分别为72.7%(40/55)、14.5%(8/55)、3.6%(2/55)和9.1%(5/55),CLT0组患者治疗后ER、IR、BIR、SIR(L)率分别为68.5%(50/73)、13.7%(10/73)、6.8%(5/73)和10.9%(8/73),两组患者疗效对比差异无统计学意义(P=0.500,图1)。
2.4 CLT与疗效反应的相关性分析
进一步相关性分析显示,CLT与疗效反应并无相关性(r=-0.058, P=0.519)。提示CLT对DTC的后期发展并未起到一定保护作用(表3)。

图 1 CLT1组与CLT0组患者131I治疗的疗效反应Fig 1 Comparison of the response after 131I therapy in two groups
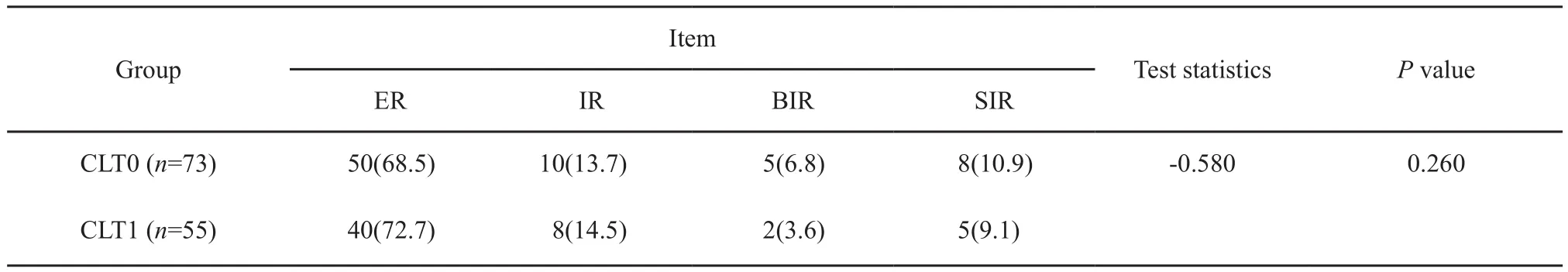
表 3 CLT与疗效反应的相关性分析Tab. 3 Correlation between response and CLT[n(%)]
3 讨 论
近年来,DTC合并CLT的发病率呈逐年上升的趋势[14]。DTC合并CLT患者发病率为12.0%~43.8%[4-5]。本研究结果提示,CLT合并DTC组TgAb水平较单纯DTC组高,约为单纯DTC组5倍,但治疗后TgAb水平均下降趋势更为显著,降幅接近60%。这提示合并CLT的DTC患者给予合适剂量的131I治疗对降低TgAb滴度作用明显,针对这类TgAb滴度较高的患者更应积极进行选择性131I治疗以便于治疗后的长期随访。另外,CLT合并DTC组患者男性患者比率(P=0.011)及原发灶大小(P=0.028)均低于单纯DTC组患者。有文献报道,在病理特征方面,CLT伴发DTC患者,以女性多见,病灶较小,常单发[15-17]。在CLT合并DTC患者中,女性患者所占比例较高可能与高雌激素水平及高雌激素受体表达有关[18-19],这是女性DTC多见的主要原因。另外,也有研究提示[15,20],合并CLT的DTC的患者肿瘤直径较小可能是由于淋巴细胞分泌细胞因子抑制了肿瘤的增长,病灶旁炎细胞浸润,血浆中淋巴细胞渗出,抑制或限制了肿瘤的增长。但在年龄、多灶性、淋巴结分期、被膜及被膜外侵犯、TNM分期等方面未见明显差异,这与梁军等[13]研究结果较一致,但也有相关研究与本研究结果相反[21]。因此,对CLT与侵袭性的关系目前尚难定论。
DTC合并CLT的患者预后要好于单纯DTC组患者,其术后效果、远处转移率、复发率及死亡率均较低[20]。其原因可能为,CTL合并DTC的患者中,其炎性微环境中的免疫细胞及其驱动分子,可对甲状腺癌的进展起到抑制作用,从而成为甲状腺癌的保护因素[22]。但合并CLT的DTC患者经外科手术和治疗后的确切疗效仍不得而知。因此,本研究从经外科手术及131I治疗后疗效反应评价体系方面对该部分患者进行了分析,结果显示,合并CLT组患者治疗后疗效满意率与单纯DTC组患者并无明显差异(72.7% vs 68.5%)。另外,进一步分析CLT与疗效反应的相关性,提示两者并无相关性(P=0.519)。因此,通过本研究结果可推测,伴发CLT的DTC患者并无更好的131I治疗反应。
最新提出的第8版TNM分期完全取消了Ⅲ期患者中甲状腺外微小侵犯对死亡风险的影响[23]。因此本研究首次以第8版TNM分期的标准对其进行分析。本研究结果表明,两组患者在TNM分期方面并未见明显差异(P=0.260)。这提示,甲状腺癌微小侵犯并不会对合并CLT的DTC患者的死亡率产生影响,因此在治疗决策方面也不需要做出调整。
综上,CLT似乎并未对DTC的发展起到保护作用,伴发CLT的DTC患者的131I疗效与单纯DTC患者的疗效大致相同。

