碱-低压复合法对大豆苷元转化的影响
李笑梅,陈知秋,向世新
(哈尔滨商业大学 黑龙江省高校食品科学与工程重点实验室,黑龙江 哈尔滨 150076)
大豆异黄酮中能被人体吸收、利用[1],发挥植物雌激素作用[2],具有抗肿瘤[3]、抗氧化[4]和抗菌消炎等作用[5]的生理和药理活性物质是游离型苷元,深入研究大豆异黄酮不同结合型组分转化为大豆苷元的技术,对更加充分合理利用大豆异黄酮资源,提高其使用价值具有一定的理论和实际意义。苷元转化可分为3 步[6]:第1步是乙酰基型异黄酮在弱碱或加热条件下可水解为丙二酰基型[7];第2步是丙二酰基型在弱碱或高温下水解为葡萄糖苷型,通常来说在适宜的碱性条件下前两步可同时进行[8];第3步是葡萄糖苷型异黄酮转化为苷元,此步是目前研究的热点,国内外研究成果主要集中在酸水解[9-12]、酶解[13-17]和微生物降解法[17-21]。碱-低压复合法首先通过碱水解原料中的乙酰基型、丙二酰基型实现葡萄糖苷型大豆异黄酮的积累,为后续进一步利用低压实现葡萄糖苷型向苷元的转化奠定物质基础,为大豆苷元转化制备技术的开发提供一条新的原料预处理途径和参考数据。
1 材料与方法
1.1 材料与试剂
大豆异黄酮粉(质量分数30%) 河南众信生物科技有限公司;大豆素、大豆黄素、染料木素、大豆苷、大豆黄苷、染料木苷(纯度均为99%) 西安市天园生物制药厂;甲醇(色谱纯) 美国天地公司;超纯水为实验室自制;其余均为国产分析纯。
1.2 仪器与设备
2695高效液相色谱(配有Waters2489紫外检测器和Empower 2色谱工作站) 美国沃特世科技有限公司;1200 LC C18色谱柱 美国安捷伦公司;80-2型离心机上海逸龙科技有限公司;XXXTD恒温水浴振荡器北京赛多利斯仪器系统有限公司;PHS-25 pH计 上海仪电科学仪器股份有限公司;TU-1901双光束紫外分光光度计 北京普析通用仪器有限公司;微孔滤膜 上海兴亚净化材料厂;AS3120A超声波仪 天津奥特赛恩斯仪器有限公司;GMSX-280温度压力表 上海宜川上岭仪表有限公司。
1.3 方法
1.3.1 6 种大豆异黄酮的定性定量检测1.3.1.1 大豆异黄酮混合标准液的配制
定量称取大豆苷、大豆黄苷、染料木苷、大豆素、大豆黄素、染料木素标准品,溶于80%甲醇溶液中,超声30 min后定容,配制成6 种单标液,质量浓度为400 μg/mL。再用上述6 种标液以相同比例分别配制48、96、144、192、240 μg/mL系列质量浓度大豆异黄酮混和标液[22]。
1.3.1.2 6 种大豆异黄酮定性定量检测
采用高效液相色谱法进行定性定量检测,流动相为甲醇和水,采用梯度洗脱:0~40 min:20%甲醇溶液~60%甲醇溶液;40~50 min:60%甲醇溶液。流速1.2 mL/min,柱温40 ℃,检测波长为259 nm。各单标于0.45 μm微孔滤膜过滤后依次进样,以6 种标准品的保留时间定性,以峰面积定量。各计算公式如式(1)~(9):

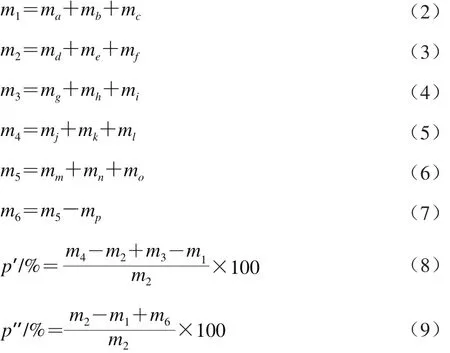
式中:m为每种大豆异黄酮绝对质量/mg;C为各类型大豆异黄酮回归方程得出其质量浓度/(μg/mL);V为定容体积/mL;m1、m5、m2、mp分别为原料中、碱水解后、低压后、低压对应高温处理后苷元绝对质量/mg;ma、mb、mc、mg、mh、mi分别为原料中大豆素、大豆黄素、染料木素、大豆苷、大豆黄苷、染料木苷的绝对质量/mg;md、me、mf分别为低压后大豆素、大豆黄素、染料木素的绝对质量/mg;m3、m4分别为原料中、碱水解后葡萄糖苷绝对质量/mg;mj、mk、ml、mm、mn、mo分别为碱水解后大豆苷、大豆黄苷、染料木苷、大豆素、大豆黄素、染料木素的绝对质量/mg;m6为高温下苷元损失的绝对质量/mg;p’和p”分别为葡萄糖苷增长率、低压处理后苷元转化率/%。
1.3.2 碱水解
将5 g大豆异黄酮粉溶于30 mL蒸馏水中,20 ℃超声30 min后加入稀碱溶液调pH值,于一定温度振荡一定时间,中和后定容至100 mL,3 000 r/min离心90 min,取上清液过0.45 μg微孔滤膜两次后上高效液相色谱进行检测[23]。
1.3.3 碱水解单因素试验
评价指标为葡萄糖苷增长率,采用高效液相色谱法检测,以碱水解pH 11、时间60 min、温度60 ℃为基本条件。在其他条件不变的情况下,分别考察碱水解时间(30、40、50、60、70 min)、碱水解pH(9、10、11、12、13)和温度(45、50、60、65、70 ℃)对葡萄糖苷型大豆异黄酮增长率的影响。对照组为未经碱化前处理的大豆异黄酮原料,各组试验重复3 次。1.3.4 响应面法确定最优碱水解条件
根据单因素试验结果,以水解时间、pH值和温度为影响葡萄糖苷型增长率的主要考察因素,设计3因素3水平响应面试验。因素及水平见表1。并采用多元回归分析,拟合二次多项式回归模型的Box-Behnken试验设计[24],进行结果分析,得最优碱水解工艺条件。

表1 碱水解Box-Behnken试验设计因素及水平Table1 Coded levels of independent variables used in Box-Behnken design for alkaline hydrolysis
1.3.5 碱水解最优条件的验证实验
在响应面试验得到的最优条件下重新进行碱水解,并进行葡萄糖苷增长率的计算,与响应面各组实验结果比较,验证最优条件。
1.3.6 低压转化
将大豆异黄酮粉在碱水解最优条件下处理后离心取上清液,配制成一定料液比,低压作用后进行高效液相色谱检测。120 ℃以上高温会破坏苷元结构[24],为排除高温对苷元的破坏作用,碱水解样品还需在常压下油浴,温度、作用时间和料液比与低压处理条件相对应,采用高效液相色谱测定。
1.3.7 低压处理的单因素试验
以苷元转化率为评价指标,采用高效液相色谱法检测,考察时间、料液比、压力3个因素,每组试验均设置常压下相同条件油浴对照组。以苷元转化率为评价指标,各组试验重复3 次。
单因素试验考虑高压处理中不同条件下对苷元转化率的影响时,同时因为高压产生的高温会对苷元造成一定影响,使其所得的量减少,为了弥补这一部分损失,本实验同时又根据温度压力线性表,得到不同压力下所对应的温度,并且对碱水解后的样品进行该温度下的油浴进行实验设计,以计算高温下苷元损失的绝对质量。其他条件不变的情况下,设计压力为0.1、0.15、0.20、0.25、0.30 MPa;另取碱水解后样品分别在120、128、134、139、144 ℃,料液比1∶100(g/mL)油浴10 min,以苷元转化率为指标探究压力的影响;其他条件不变的情况下,分别作用6、8、10、12、14 min;另取碱水解后样品在温度139 ℃、料液比1∶100(g/mL)分别油浴6、8、10、12、14 min,以苷元转化率为指标探究低压作用时间的影响;其他条件不变的情况下,分别选择料液比为1∶60、1∶80、1∶100、1∶120、1∶140(g/mL);另取碱水解后样品分别在温度139 ℃,料液比1∶60、1∶80、1∶100、1∶120、1∶140(g/mL)油浴10 min,以苷元转化率为指标探究料液比的影响。
1.3.8 响应面法确定最优低压条件
根据单因素试验结果,以压力、时间和料液比为影响苷元转化的主要因素,设计3因素3水平响应面试验。低压处理工艺响应面试验的因素及水平见表2。并采用多元回归分析,拟合二次多项式回归模型的Box-Behnken设计试验,进行结果分析,得到低压处理最优工艺条件。
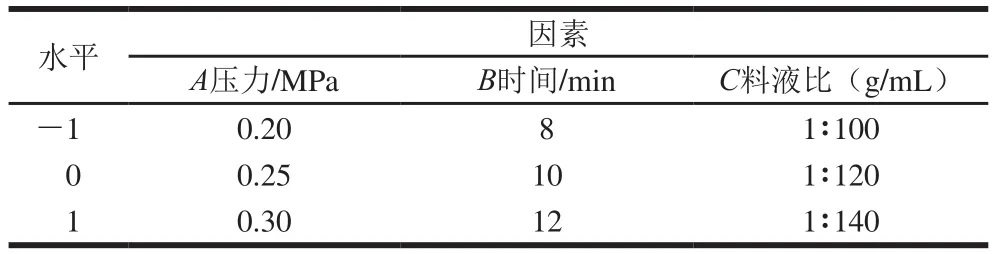
表2 低压处理的Box-Behnken试验设计因素与水平Table2 Coded levels of independent variables used in Box-Behnken design for low-pressure processing
1.3.9 低压最优条件的验证实验
通过响应面试验得到最优条件后进行低压处理,并计算苷元转化率,与之前各组的苷元转化率比较,验证最优条件。
1.4 数据处理
实验操作重复3 次,采用SPSS 19.0软件进行显著性分析,采用Design-Expert软件设计响应面试验方案、建立数学模型并进行多元回归分析。
2 结果与分析
2.1 6 种大豆异黄酮标样定性及定量结果
根据原料中大豆异黄酮各组分出峰时间与混标各组分的出峰时间大致相同,得到峰面积y对大豆异黄酮质量浓度x(μg/mL)进行回归分析,回归方程分别为:大豆素:y=129.55x-43.855,r=0.999 6;大豆黄素:y=61.151x-53.554,r=0.998;染料木素:y=105.85x-50.178,r=0.999 1;大豆苷:y=53.574x-34.498,r=0.998 7;大豆黄苷:y=60.494x-43.071,r=0.998 6;染料木苷:y=71.444x-27.151,r=0.999 0。线性范围为0~40 μg/mL。
根据相应标准曲线,计算出大豆苷、大豆黄苷、染料木苷、大豆素、大豆黄素、染料木素的绝对质量分别为10.03、6.45、0.8、1.59、0.87、0.58 mg。3 种结合型和3 种游离型异黄酮的总绝对质量分别为17.28、3.04 mg。
2.2 大豆异黄酮碱水解的单因素试验结果
2.2.1 碱水解时间对葡萄糖苷型大豆异黄酮增长率的影响
由图1可知,随着碱水解时间的延长,物料与溶剂接触越来越充分,物质溶解完全,葡萄糖苷型增长率升高,当水解时间为60 min时,增长率最大,随着水解时间继续延长,增长率开始降低,可能因为水解时间过长,对糖苷结构的破坏程度也相应增加,同时原料溶出的杂质过多,给分离和检测带来阻碍,故适宜碱水解时间为50~70 min。
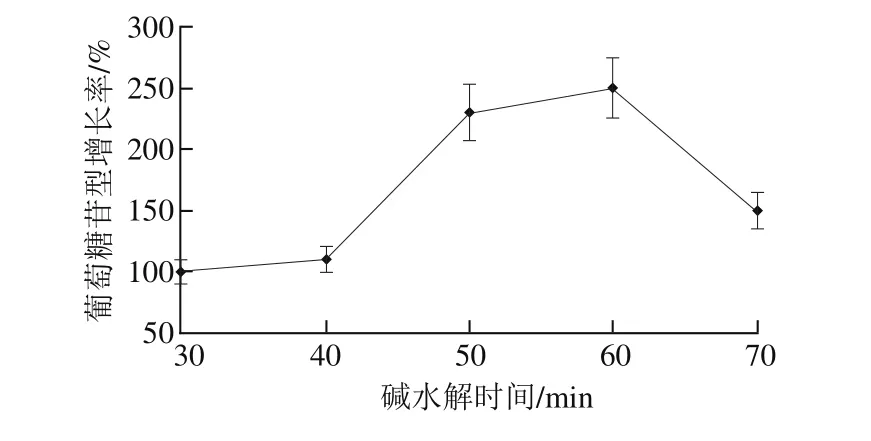
图1 碱水解时间对葡萄糖苷型大豆异黄酮增长率的影响Fig.1 Effect of hydrolysis time on the increase rate of glucoside isof l avones
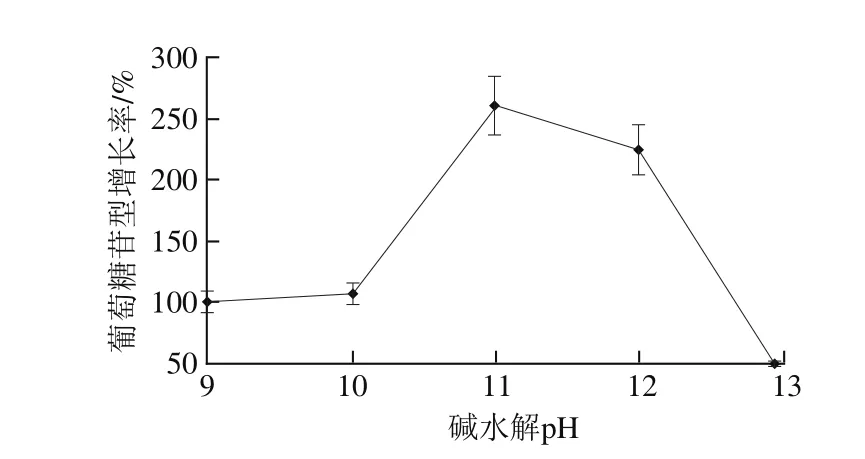
图2 碱水解pH值对葡萄糖苷型大豆异黄酮增长率的影响Fig.2 Effect of hydrolysis pH on the increase rate of glucoside isof l avones
2.2.2 碱水解pH值对葡萄糖苷型大豆异黄酮增长率的影响由图2可知,随着碱水解pH值的增加,丙二酰基水解,葡萄糖苷型增长率升高,当水解pH 11时,增长率最大,随着pH值继续增加,分子母核因不耐强碱环境而发生断裂失去活性[25],因而增长率开始降低,故适宜水解pH值在10~12之间。
2.2.3 碱水解温度对葡萄糖苷型大豆异黄酮增长率的影响
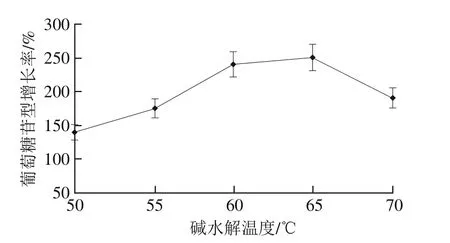
图3 碱水解温度对葡萄糖苷型大豆异黄酮增长率的影响Fig.3 Effect of hydrolysis temperature on the increase rate of glucoside isof l avones
由图3可知,随着碱水解温度的升高,葡萄糖苷增长率升高,可能因为一定温度有利于丙二酰基型的水解[26],温度的升高也促进了糖苷的溶解,从而得率不断增大,当水解温度为65 ℃时,增长率最大,随着温度继续增加,增长率开始降低,可能是过高的温度破坏了糖苷结构,但仍高于50、55 ℃时的增长率,故适宜水解温度在60~70 ℃之间。
2.3 碱水解条件优化的响应面试验结果
本实验利用Design-Expert软件,响应面试验设计结果如表3所示。
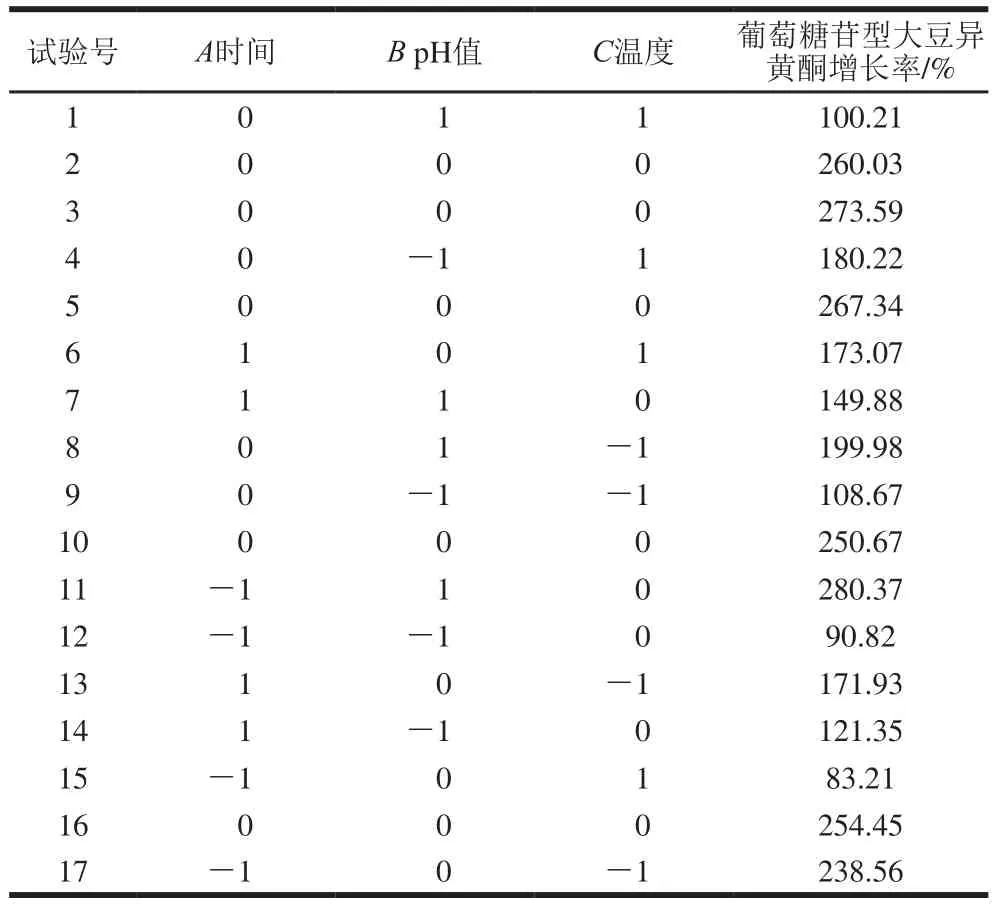
表3 碱水解的响应面试验设计结果Table3 Box-Behnken design with response variable for alkaline hydrolysis
利用Design-Expert得到响应值与被检变量之间的关系。对表3试验数据进行二次多元回归拟合,得到了葡萄糖苷大豆异黄酮增长率的回归方程:Y=210.85+3.06A-24.96B-2.10C-9.18AB+24.23AC-14.52BC-19.98A2-79.41B2-1.52C2。
为检验拟合方程的有效性,进一步对其进行分析,其中葡萄糖苷型大豆异黄酮增长率回归方程及显著性结果见表4,对该模型的方差分析见表5。
从表5可知,试验所选用的模型显著(P<0.05),校正决定系数值为0.783 1,说明此模型能解释78.31%响应值变化,相关系数R值为0.926 5说明拟合程度好,适合度缺损(失拟项)P值为0.797 6,P值大于0.5,不显著,说明残差均由随机误差引起,进一步说明此模型的拟合度良好。离散系数表示试验的精确度,数值越大,表明试验的可靠性越差[27],本试验中变异系数为10.28%,模型方程能较好地反应真实值[27]。综上所述,回归模型拟合程度好,试验误差较小,模型合适。
模型一次项A不显著(P>0.05),二次项A2不显著(P>0.05);一次项B显著(P<0.05),二次项B2极显著(P<0.01);一次项C、二次项C2不显著(P>0.05);交互项AB、BC显著(P<0.05),交互项AC不显著(P>0.05)。
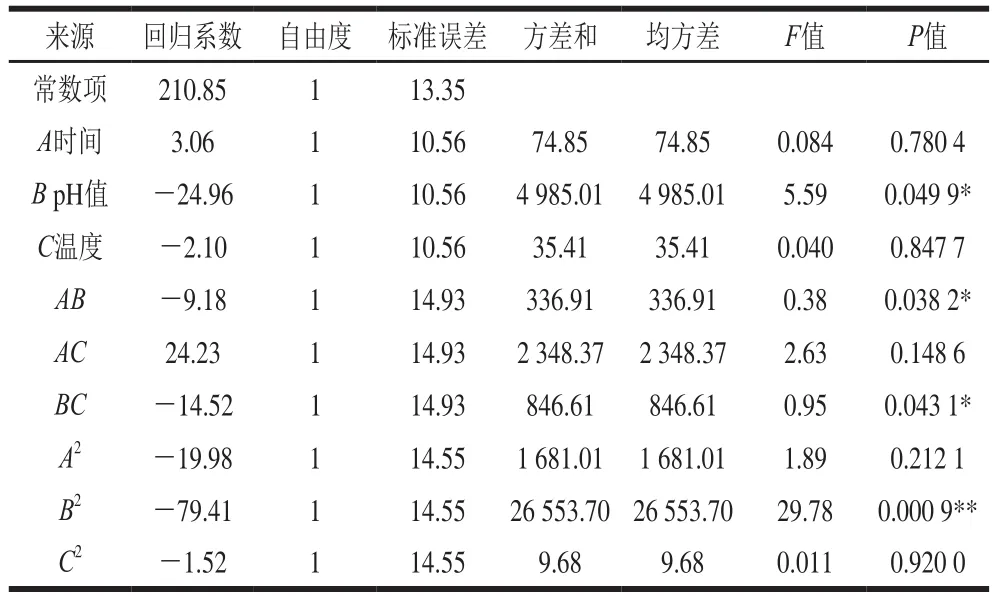
表4 葡萄糖苷型大豆异黄酮增长率拟合多元二次方程模型的方差分析Table4 Analysis of variance (ANOVA) for the effect of alkaline hydrolysis conditions on the increase rate of glucoside isof l avones
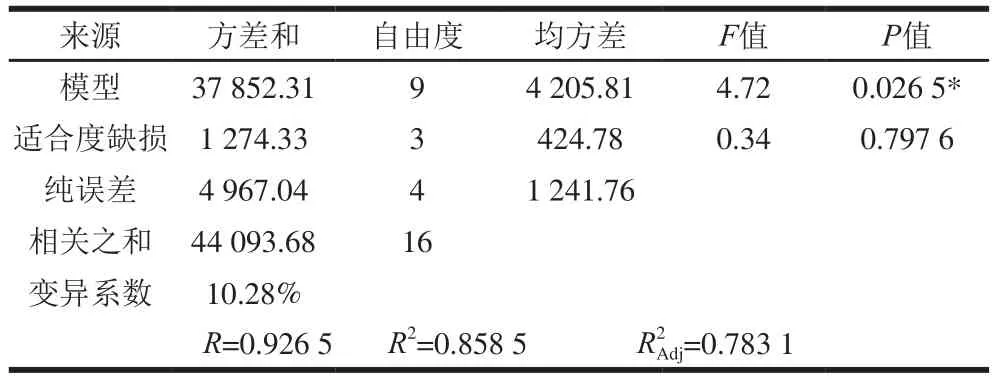
表5 多元回归模型方差分析Table5 ANOVA for the quadratic polynomial model
F值反映了各因素对葡萄糖苷增长率的影响程度,F值越大表明对增长率的影响越大[28],由表4可知,各因素对葡萄糖苷增长率影响程度的大小顺序为:水解pH值>水解时间>水解温度。
2.4 碱水解各因素交互作用分析

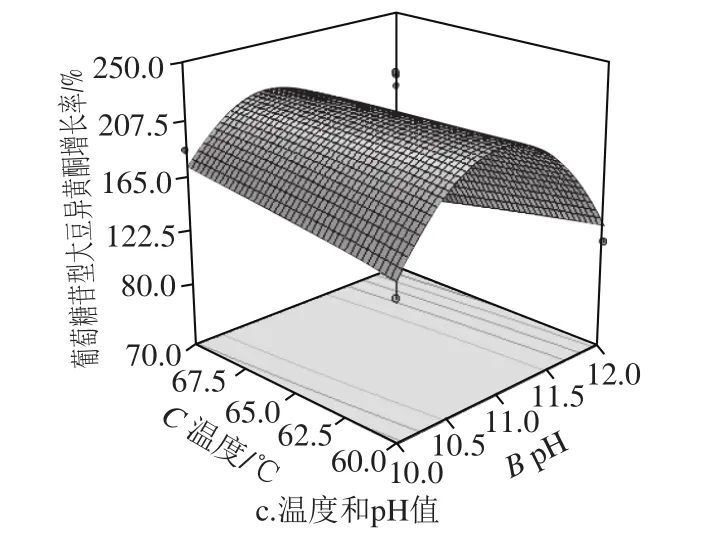
图4 碱水解条件对葡萄糖苷型增长率影响的响应面图Fig.4 Response surface plots showing the interactive effects of hydrolysis conditions on the increase rate of glucoside isof l avones
由图4a可知,等高线密集呈椭圆形,时间与pH值交互显著,对指标影响大。pH值曲面坡度陡峭,水解时间曲面平缓,pH值对指标影响更为显著。当pH 11左右时,增长率最大,随后增长率随着pH值的增加而降低;由图4b可知,等高线稀疏呈圆形,温度与时间交互作用弱,对结果影响不显著。当温度到65 ℃左右,时间在50 min左右增长率最大;由图4c可知,温度与pH值交互显著,pH值对葡萄糖苷型大豆异黄酮增长率影响显著,温度影响不大。
2.5 碱水解参数优化及验证结果
运用Design-Expert软件得到碱水解的最优条件为:时间48.92 min、温度63.36 ℃、pH 11.5,此条件下葡萄糖苷型大豆异黄酮增长率为299.32%,考虑到实际操作的可行性,参数调整为时间49 min、温度63 ℃、pH 11.5,将参数代入拟合方程,计算得出在此条件下葡萄糖苷型大豆异黄酮增长率为298.73%。在最优校正条件下进行3 次平行实验,增长率分别为287.36%、284.55%、287.29%,重复性好,平均值为286.40%,得出的实验值与理论值差异不显著,可确定该多元二次回归方程适合于对葡萄糖苷增长率的预测,且结果准确。
由表3可知,水解时间50 min、pH 12、温度65 ℃时,葡萄糖苷型大豆异黄酮增长率达280.37%,小于最优校正条件下所得结果,但结果差异不显著(P>0.05),考虑工艺所需时间的长短和温度高低及成本,仍考虑采用最优校正条件。
2.6 低压处理单因素试验结果
2.6.1 压力对大豆苷元转化率的影响
由图5可知,随着压力的增加,压力破坏葡萄糖苷键的能力逐渐增大,苷元转化率升高,当压力为0.25 MPa时,转化率最大,随着压力的继续增大,低压破坏了苷元结构[29],转化率开始降低,但仍高于之前的水平,故适宜水解压力在0.2~0.3 MPa。
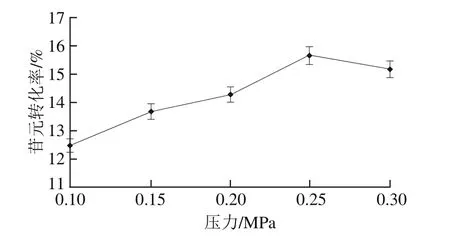
图5 压力对苷元转化率的影响Fig.5 Effect of pressures on the conversion rate of aglycones
2.6.2 压力作用时间对大豆苷元转化率的影响

图6 压力作用时间对苷元转化率的影响Fig.6 Effect of low-pressure processing time on the conversion rate of aglycones
由图6可知,随着压力作用时间的延长,压力持续作用于葡萄糖苷键,键断裂几率增大,苷元转化率升高,10 min时转化率最大,随着压力作用时间的继续延长,转化率开始降低,可能是持续的压力作用破坏了苷元结构,故适宜低压作用时间在8~12 min之间。
2.6.3 料液比对大豆苷元转化率的影响
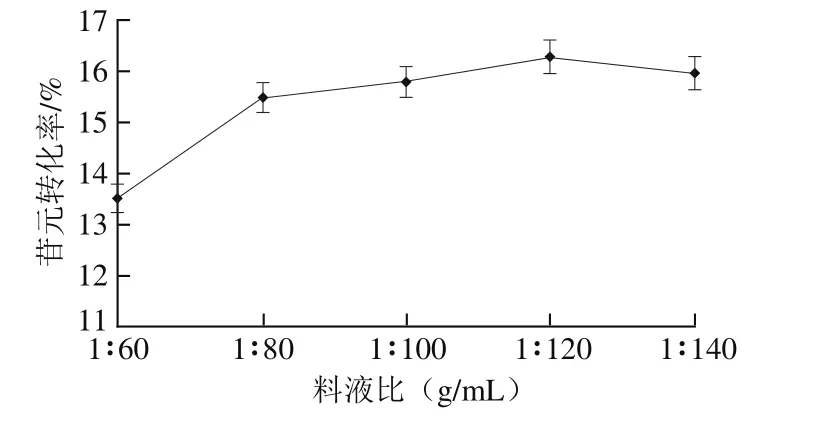
图7 料液比对苷元转化率的影响Fig.7 Effect of solid-to-solvent ratio on the conversion rate of aglycones
由图7可知,随着溶液提取试剂的增加,压力与溶液的接触增加,更加均匀地作用于溶质,苷元转化率升高,当料液比为1∶120(g/mL)时,转化率最大,随着提取试剂比例的继续增加,转化率略有降低,但仍高于之前水平,故适宜料液比在1∶100~1∶140(g/mL)之间。
2.7 响应面优化低压条件的结果
本实验利用Design-Expert软件,响应面试验设计结果如表6所示。

表6 低压处理的响应面试验设计结果Table6 Box-Behnken design with response variable for low-pressure processing
利用Design-Expert得到响应值与被检变量之间的关系。对这些试验数据进行二次多元回归拟合,得到了大豆苷元转化率回归方程:Y=16.65+0.55A+0.42B-0.087C-0.033AB-0.010AC-0.065BC-1.23A2-1.40B2-0.43C2。为检验方程有效性,进一步对其进行分析,其中苷元转化率回归方程及显著性结果见表7,对该模型的方差分析结果见表8。

表7 大豆苷元转化率拟合多元二次方程模型的方差分析Table7 ANOVA for the effect of low-pressure processing conditions on the conversion rate of aglycones
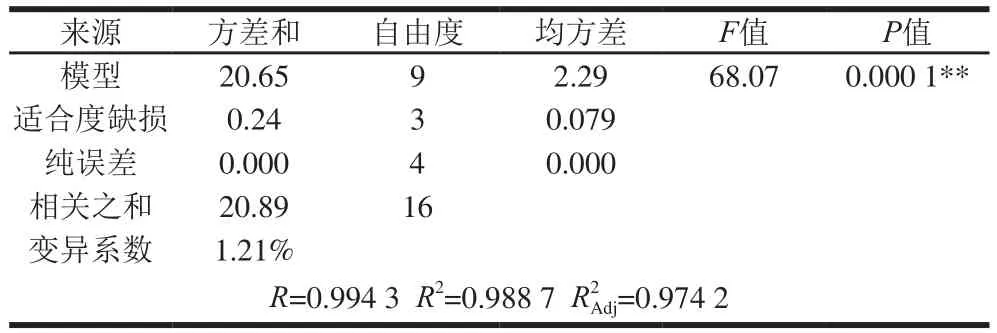
表8 多元回归模型方差分析Table8 ANOVA for the quadratic polynomial models
由表7可知,试验选用的模型极显著(P<0.01),校正决定系数值为0.974 2,说明此模型能解释97.42%响应值变化;相关系数R值为0.994 3,说明拟合程度好;变异系数1.21%,变异系数小,试验的可靠性高。综上所述,归模型拟合程度好,试验误差小,模型合适。模型一次项A和B,二次项A2和B2对响应值影响极显著(P<0.0 1),二次项C2对响应值的影响显著(P<0.05);一次项C,交互项AB、BC、AC对响应值的影响均不显著(P>0.05)。由表7可知,各因素对苷元转化率影响程度的大小顺序为:压力>时间>料液比。
2.8 低压处理各因素交互作用分析
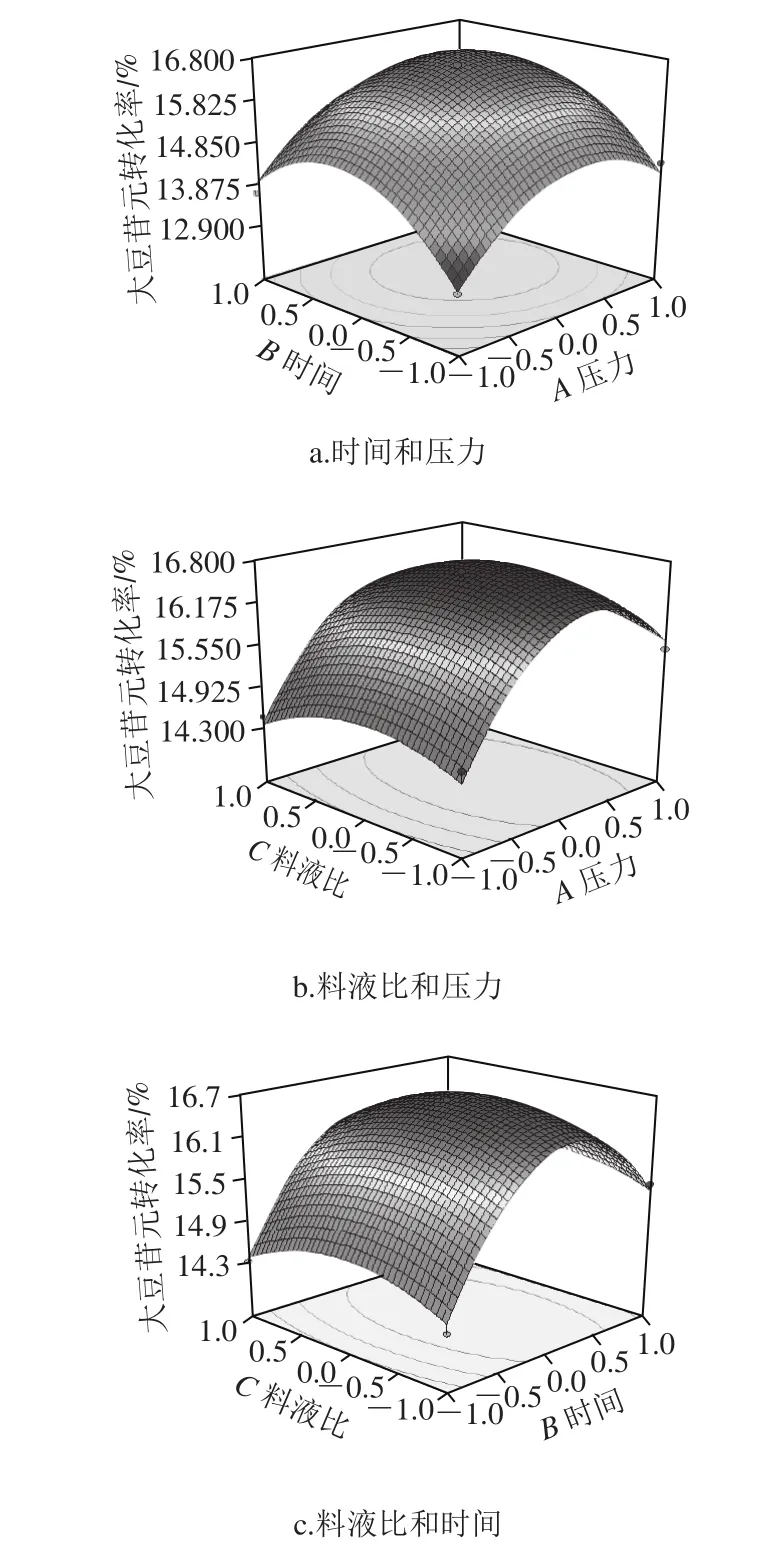
图8 低压条件对苷元转化率影响的响应面图Fig.8 Response surface plots showing the interactive effects of lowpressure processing conditions on the conversion rate of aglycones
由图8a可知,时间与压力交互不显著。在10 min、0.25 MPa左右时转化率最大;由图8b可知,压力与料液比交互显著,压力曲线坡度陡峭,时间曲线平缓,压力对转化率影响更为显著。随着压力的增加,转化率升高,0.25 MPa左右转化率最大;由图8c可知,时间与料液比交互显著,其中料液比对转化率影响小,时间影响效果显著。随着时间的延长,苷元转化率逐渐升高,10 min左右时转化率最大。
2.9 低压处理参数优化及验证实验结果
运用Design-Expert软件,求出被检变量的最优值:压力0.26 MPa、时间10.3 min、料液比1∶117.68(g/mL),此条件下大豆苷元转化率为16.75%。考虑操作的可行性,参数调整为:压力0.26 MPa、时间10.3 min、料液比1∶120(g/mL),将参数代入拟合方程得苷元转化率为16.74%。在最优校正条件下进行3 次平行实验,实验结果分别为16.58%、16.71%、16.71%,重复性好,平均值为16.67%,与理论值差异不显著,该多元二次回归方程适合于对大豆苷元转化率预测,且结果准确。
由表6得知,压力0.25 MPa、料液比1∶120(g/mL)、时间10 min时苷元转化率可达16.65%,小于最优校正条件下所得结果,但结果差异不显著(P>0.05),考虑后者工艺所需压力和时间均低于最优条件下的压力和时间,在降低生产成本的基础上仍能获得与最优校正条件下相当的结果,故将压力0.25 MPa、时间10 min、料液比1∶120(g/mL)作为最优工艺条件。
3 结 论
原料中葡萄糖苷型大豆异黄酮绝对质量为17.28 mg,苷元3.04 mg。在碱水解最优条件为pH 11.5、温度63 ℃、时间49 min,葡萄糖苷型大豆异黄酮的绝对质量为49.49 mg,增长率为286.40%。获得了葡萄糖苷型大豆异黄酮的积累。后接低压最优条件为压力0.25 MPa、时间10 min、料液比1∶120(g/mL),在此条件下苷元绝对质量达11.29 mg,苷元转化率为16.65%。由此得出碱水解对原料中乙酰基型、丙二酰基型转化葡萄糖苷型大豆异黄酮效果显著。单一的低压处理对苷元转化率虽有效果,但远低于酶法[8-12],而且低压伴随的120 ℃以上高温就会对苷元有破坏作用[30]。由此后续研究侧重以碱水解为前处理的炒制、适宜低压、固定化酶、微生物发酵等复合技术,进一步提高大豆苷元转化率。

