高产纳豆激酶菌株的分离与发酵纳豆过程中生物胺的变化
高泽鑫,何腊平,2,*,刘亚兵,高 冰,李翠芹,刘涵玉
(1.贵州大学酿酒与食品工程学院,贵州 贵阳 550025;2.贵州省农畜产品贮藏与加工重点实验室,贵州 贵阳 550025;3.湖北工业大学生物工程与食品学院,湖北 武汉 430068;4.贵州大学化学与化工学院,贵州 贵阳 550025)
纳豆起源于中国,是传统的发酵食品,唐朝时期传入日本,有1 000 a以上食用历史[1]。纳豆类似中国的豆豉,主要经枯草芽孢杆菌(Bacillus subtilis)发酵而来,日本将纳豆作为营养食品和调味品[2],我国主要将豆豉用锅蒸煮或炒后作为调味料。日本学者Sumi等[3]于1987年首次对纳豆及其提取物作了系统研究,并找到了具有纤溶活性的纳豆激酶。据报道,全球每年因患血栓类疾病死亡的人数多达1 200万,而中国约占总数的1/5[4],因此关于溶栓的药物开发成为了现在研究的热点。由于纳豆激酶具有高效溶栓作用,因此受到了各界的广泛关注[5]。产纳豆激酶菌株的来源有很多,如日本纳豆食品中、一些海洋生物中、中国台湾的土壤中、中国的豆豉和亚洲发酵虾酱中[6-10],也可能存在于传统发酵的肉食品中。
食品中的生物胺主要通过微生物脱羧酶的作用生成含氮化合物[11]。口服摄入生物胺通常不会引起不良反应,因为人体肠道中有大量胺氧化酶能快速代谢含氮化合物,所以多数生物胺在人体中没有直接的毒性[12]。然而,如果生物胺代谢能力过饱和或代谢活性被特异性抑制剂减弱,则可能发生食物中毒[13]。常见的中毒症状有恶心、呼吸困难、潮热、出汗、神经过敏、头痛、明亮的红色皮疹、口腔烧灼感、低渗或高血压,这主要是由组胺、酪胺和β-苯乙胺引起[14]。据报道,在食品中组胺含量100 mg/kg被认为是人类食用的上限,而酪胺含量100~800 mg/kg和β-苯乙胺含量达到30 mg/kg是有毒剂量[15]。目前测定食品中生物胺含量的方法很多[16-17],如毛细管电泳法、气相色谱法、液相色谱法等,而本实验采用高效液相色谱-紫外检测的方法来测定发酵纳豆中生物胺的变化情况。
本研究通过酪蛋白平板和纤维蛋白平板筛选法从贵州织金特色农家土制烟熏腊肉中分离出1 株高产纳豆激酶菌株,并采用生理生化和分子生物学的方法对菌株进行鉴定[18]。分离于传统食品中的微生物一般不存在安全性问题,但产纳豆激酶的菌株一般会产生物胺。所以本研究在分离的菌株鉴定的基础上,接着以黄豆为主要碳源,对其进行纯种固态发酵,检测其在发酵过程中产生物胺的变化、产生的纳豆激酶活力和生物量变化情况,探讨菌株产生物胺的安全性问题,为纳豆的工业化生产提供理论支持。
1 材料与方法
1.1 材料、试剂与培养基
1.1.1 材料
黄豆为市售有机黄豆;菌株筛选样品为贵州织金农家土制烟熏腊肉。
1.1.2 试剂
牛凝血酶(1 000 U/g)、牛纤维蛋白原 沈阳拜英生物技术有限公司;尿激酶生物标准品(1 240 IU/g)中国食品药品检定研究院;细菌基因组DNA提取试剂盒天根生化科技有限公司;生物胺标准品:色胺、组胺、精胺、2-苯乙胺、腐胺、亚精胺、尸胺、酪胺、丹磺酰氯 美国Sigma公司;乙腈、甲醇(均为色谱纯)北京百灵威科技有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
筛选培养基:干酪素5 g/L,葡萄糖1 g/L,酵母膏1 g/L,K2HPO41 g/L,KH2PO40.5 g/L,MgSO40.1 g/L,琼脂 20 g/L,pH 7;液体种子培养基:葡萄糖10 g/L,酵母提取物5 g/L,牛肉膏10 g/L,NaCl5 g/L,pH 7;斜面培养基:蛋白胨10 g/L,酵母提取物5 g/L,NaCl 10 g/L,琼脂20 g/L,pH 7;平板计数培养基:蛋白胨5 g/L、酵母浸粉 2.5 g/L、葡萄糖1.0 g/L、琼脂15 g/L,pH 7;固态发酵培养基:黄豆清洗干净,加入4 倍体积的去离子水浸泡,常温浸泡18 h,沥水后加入3%食盐和3%蔗糖。
1.2 仪器与设备
SW-CJ-10超净工作台 苏州净化有限公司;LS-B75L立式压力蒸汽灭菌器 江阴滨江医疗设备有限公司;DW-86L286立式超低温保存箱 青岛海尔特种电器有限公司;CX21SF1奥林巴斯生物显微镜 上海新苗医疗器械制造有限公司;SPX生化培养箱 上海科恒实业发展有限公司;HYG-A全温摇瓶柜 太仓市实验设备厂;S1000TM聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Thermal Cycler公司;Gel Doc XR凝胶成像仪 美国Bio-Rad公司;TS-2102C恒温振荡器 上海天呈仪器有限公司;1100高效液相色谱仪及检测器、SB-C18色谱柱 美国Agilent公司。
1.3 方法
1.3.1 纳豆激酶活力测定
纳豆激酶活力测定采用Astrup等[19]的方法,并对尿激酶标准品配制进行改进。将尿激酶标准品配制为248、496、744、992、1 240 IU/mL,各取10 μL点样于纤维蛋白原平板孔中,放入恒温培养箱中37 ℃孵育18 h后取出,测定溶解圈的面积。以溶解圈的面积(mm2)为横坐标,以尿激酶活性为纵坐标作标准曲线。样品的进样方法与标准品的方法相同,将孵育完的纤维蛋白原平板用游标卡尺测定溶圈的直径并计算各溶圈面积,根据尿激酶标准曲线测得样品纳豆激酶活力。
1.3.2 高产纳豆激酶菌株的筛选
将腊肉切碎制成样品悬液用8.5%的生理盐水10 倍梯度稀释,取10-7、10-8、10-9三个稀释度涂布于酪蛋白平板上。由于纳豆激酶是碱性丝氨酸蛋白酶,可水解酪蛋白形成透明圈,根据这一特性在37 ℃条件下倒置培养24 h后挑取出形态不同且有明显水解透明圈的菌落,进行纯化后接种到斜面培养基上4 ℃冰箱保存备用。用接种环挑选2~3 环斜面培养基上的菌苔接种到液体种子培养基中,在37 ℃、180 r/min的条件下培养24 h。培养完成后于4 ℃、12 000×g离心10 min。将粗酶液进行纳豆激酶活力测定。
1.3.3 菌株形态与生理生化鉴定
将筛选得到的酶活力最高的菌株在酪蛋白平板上画线,37 ℃倒置培养24 h,观察单菌落形态,对菌株进行革兰氏染色正文,观察菌体形态。根据文献[20]对菌株进行生理生化鉴定。考察其对色氨酸、蔗糖、苦杏仁苷等的利用情况。
1.3.4 菌株分子鉴定
菌株活化后使用细菌基因组DNA提取试剂盒进行提取。扩增使用的上游引物为27F,下游引物为1492R。25 μL反应体系为模板DNA2 μL;27F 2.5 μL;1492R 2.5 μL;Go Taq Green Master Mix(2×)12.5 μL;去离子水5.5 μL。反应条件为94 ℃预变性5 min,94 ℃变性1 min,退火温度从65 ℃降至55 ℃,每个循环降低0.5 ℃,退火时间为3 s,72 ℃延伸1 min,35 个循环;恒定退火温度下进行94 ℃变性1 min,55 ℃退火30 s,72 ℃延伸1 min。PCR产物送上海生工公司双向测序,将双向测序结果通过DNA man软件进行拼接,再登录NCBI将所得序列结果与数据库中的已知序列进行相似性比对,采用MEGA 5.0软件构建系统发育树。
1.3.5 纳豆固态发酵
挑选颗粒饱满、无畸形、色泽淡黄的市售有机黄豆,用去离子水冲洗,直至无杂物,豆水质量比1∶4浸泡18 h后,沥干水后分装入三角瓶各50 g,再向每瓶加入1.5 g食盐和1.5 g的蔗糖。放在高压蒸汽灭菌锅中蒸煮15 min,随即放入超净工作台内冷却。挑取2~3 环菌苔接种到液体种子培养基中,于37 ℃、180 r/min的条件下培养18 h,然后按4%的接种量接种到冷却好的固态发酵培养上,37 ℃培养72 h,每12 h摇晃一次。
1.3.6 固态发酵生物量与酶活力分析
在纳豆固态发酵期间,每隔6 h取纳豆样品,稀释涂布于平板计数培养基上,37 ℃倒置培养18 h,统计单菌落个数,计算生物量,每个时间点做3 个重复。同时发酵期间每6 h测定纳豆激酶活力。称取2 g纳豆于10 mL离心管中加6 mL无菌的生理盐水,4 ℃浸提24 h,用玻璃棒捣碎经12 000×g离心10 min,上清液即为固态发酵粗酶液。
1.3.7 生物胺样品前处理
将每隔6 h取的固态发酵剩余样品用研钵研磨均匀,准确称取10 g样品置于50 mL离心管中,加入25 mL 0.4 mol/L高氯酸,振荡提取30 min,5 000 r/min离心10 min,取上清液备用。将沉淀如上述方法再加入25 mL高氯酸连续提取3 次,合并4 次上清液,最后用0.4 mol/L高氯酸定容至100 mL容量瓶。
1.3.8 生物胺标准溶液制备与样品衍生
生物胺标准溶液的配制参照GB/T 5009.208—2016《食品中生物胺含量的测定》[21]。取0.5 mL标准溶液于10 mL离心管中,依次加入100 μL2 mol/L氢氧化钠溶液、150 μL饱和碳酸氢钠溶液缓冲,再加入1 mL丹磺酰氯衍生剂(5 mg/mL,溶剂为丙酮),振荡混匀后在避光条件下60 ℃水浴30 min,15 min时振荡一次。加入50 μL 25%氨水终止衍生反应,避光静置30 min,加入700 μL乙腈溶液混匀,用0.22 μm有机滤头过滤,于4 ℃避光保存,用于高效液相色谱测定。样品溶液衍生的条件及方法与标准溶液相同。
1.3.9 色谱条件
色谱柱为Agilent SB-C18,紫外检测波长为254 nm,柱温30 ℃,进样量20 μL,流动相A为乙腈,流动相B为去离子水,流速为0.8 mL/min,采用的洗脱梯度见表1。
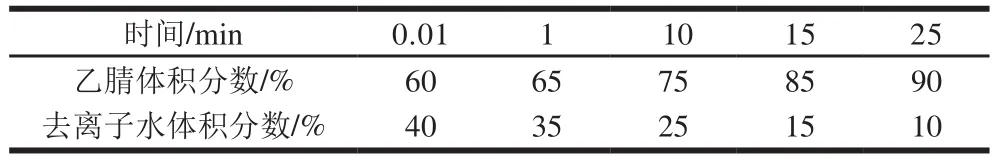
表1 梯度洗脱程序Table1 Gradient elution program
2 结果与分析
2.1 高产纳豆激酶菌株的筛选
通过将烟熏腊肉样品进行稀释涂布,再经酪蛋白平板筛得18 株形态不同且有明显透明圈的菌落,选取水解透明圈最大的7 株菌进行纯化。将纯化好的7 株菌液态发酵,取上清粗酶液注入琼脂糖-纤维蛋白原平板中,测定其溶圈面积,计算酶活力,结果见图1。
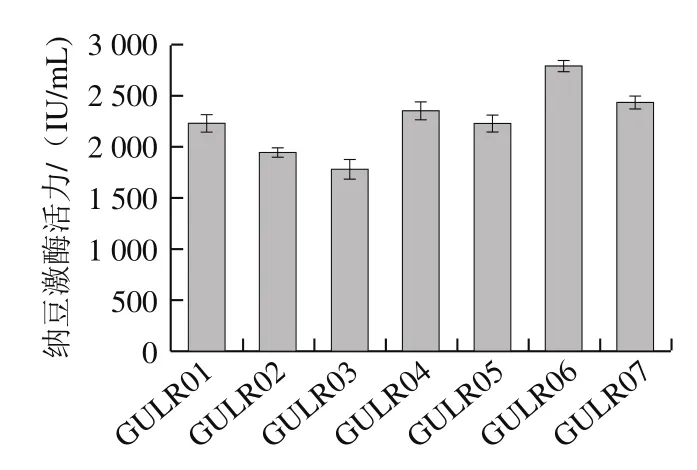
图1 高产纳豆激酶菌株筛选结果Fig.1 Screening of high-yield nattokinase-producing strain
从图1可以看出,GULR06的产酶能力最高,其液态发酵24 h后的纳豆激酶活力达到(2 793±53)IU/mL。其次为GULR07活力达到(2 431±65)IU/mL。由此选定GULR06为纳豆激酶高产菌株,进行鉴定。
2.2 高产菌形态学及生理生化鉴定
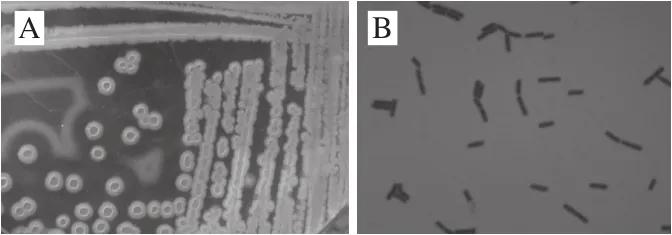
图2 GULR06的菌落形态(A)和革兰氏染色图(B)Fig.2 Colony (A) and Gram-staining (B) of strain GULR06
由图2A可知,GULR06菌落在酪蛋白平板上形成圆形、低凹起、有黏性的小菌落,其颜色呈乳白色,边缘规则,无光泽,稍隆起,不透明,菌落直径2.0~2.9 mm。该菌株革兰氏染色菌体为紫色,为革兰氏阳性菌,细胞呈杆状,单个、成对或链状排列,芽孢中生或近中生,初步判断为芽孢杆菌属,其革兰氏染色菌体形态见图2B。
对菌株GULR06进行部分生理生化特征实验。该菌株不能发酵半乳糖、乳糖、卫茅醇、松叁糖、岩糖、塔格糖、鼠李糖,阿东醇、阿拉伯糖醇和木糖醇,同时不能与色氨酸发生发应。参照文献[20]对枯草芽孢杆菌的描述,初步确定该菌株为枯草芽孢杆菌,菌株GULR06的生理生化鉴定结果见表2。

表2 菌株GULR06的生理生化鉴定结果Table2 Identif i cation of strain GULR06
2.3 分子生物学鉴定及系统发育树构建
PCR产物扩增片段送上海生工基因公司双向测序,将双向测序结果通过DNA man软件进行拼接后显示GULR06菌株16S rDNA全长为1 461 bp。BLAST分析结果显示该基因同枯草芽孢杆菌的16S rDNA基因相似度达到100%。通过MEGA 5.0软件与同属亲缘关系较近的模式菌株进行同源性分析并构建系统发育树,结果如图3所示。系统发育学分析结果表明,该系统发育树以莱西式菌FJ426598作为一个单独的外群种,其中GULR06菌株与枯草芽孢杆菌KY123872.1菌株在同一分支,结合前面的形态学和生理生化鉴定结果,最后鉴定GULR06为枯草芽孢杆菌。
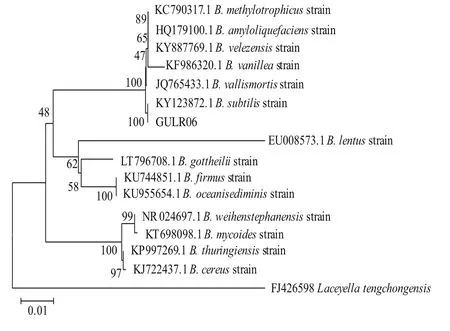
图3 基于16S rDNA序列同源性的菌株GULR06的系统发育树Fig.3 Phylogenetic tree based on the 16S rDNA sequence of strain GULR06
2.4 纳豆发酵中生物量变化及产酶特性
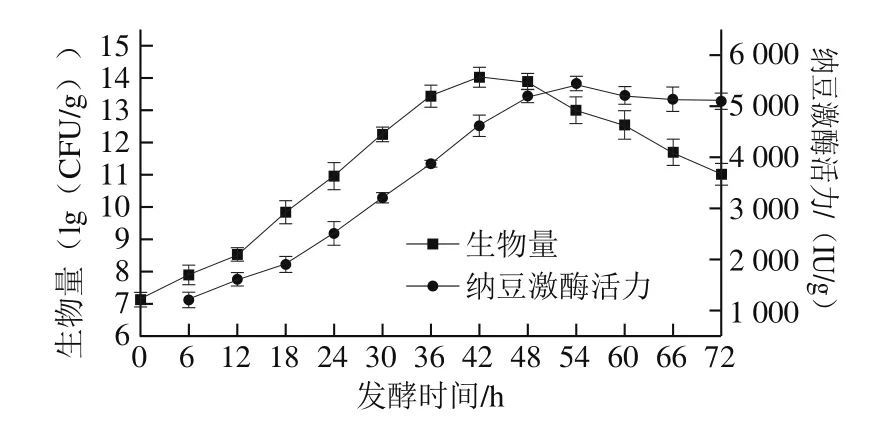
图4 纳豆发酵中菌株生物量及纳豆激酶活力的变化Fig.4 Changes in biomass and nattokinase biosynthesis during natto fermentation
如图4所示,将菌株GULR06用于纳豆固态发酵,表现出了细菌生长的一般规律,从生物量曲线上可以看出,0~12 h内为延滞期,该阶段时间较短;12~42 h为对数生长期,活菌数由8.53(lg(CFU/g))增加至14.03(lg(CFU/g)),此阶段菌株GULR06大量繁殖,在42 h时活菌数达到固态发酵中的最高值;42~48 h内是稳定期;48 h之后是衰亡期。由纳豆激酶相对活力变化曲线可以发现,随着菌体生长,纳豆激酶才被逐渐合成。54 h时,纳豆激酶活力达到最高,为(5 439.5±149)IU/g,此时活菌数已降至13(lg(CFU/g))。54 h以后,纳豆激酶活力逐渐降低,这可能是在衰亡期的菌株GULR06代谢出具有能够降解纳豆激酶的物质造成的。目前,国内外有关筛选产纳豆激酶菌株酶活力的报道多数为100~3 000 IU/g,另外有部分较高纳豆激酶活力的报道为3 000~5 000 IU/mL[22-25]。本研究所分离菌株GULR06的纳豆激酶活力显著高于大多的报道,具有良好的开发应用前景。
2.5 生物胺衍生物标准品高效液相色谱分析及精密度实验结果
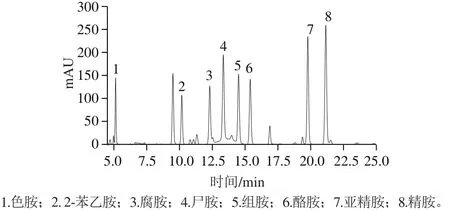
图5 生物胺混合标准品高效液相色谱图Fig.5 HPLC chromatogram of mixed standard of biogenic amines
如图5所示,8 种生物胺衍生物标准品在25 min内能全部出峰,出峰前后顺序分别为色胺、2-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺和精胺。其中,色胺、2-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺的保留时间分别为5.129、10.173、12.305、13.338、14.500、15.517、19.777、21.144 min,分离度都大于1,由此可见各种生物胺衍生物标准品能有效分离。
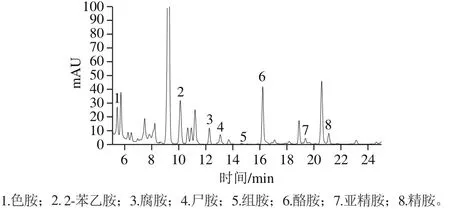
图6 纳豆样品中生物胺的高效液相色谱图Fig.6 Chromatogram of biogenic amines in natto sample
由图6可知,纳豆样品中生物胺在液相色谱上分离效果较好,可由生物胺混合标准品图谱的保留时间来确定样品的生物胺。
表3 高效液相色谱法测定生物胺的特征指标及其精密度实验结果Table3 Calibration equations, correlation efcient and precision(relative standard deviation) for biogenic amines
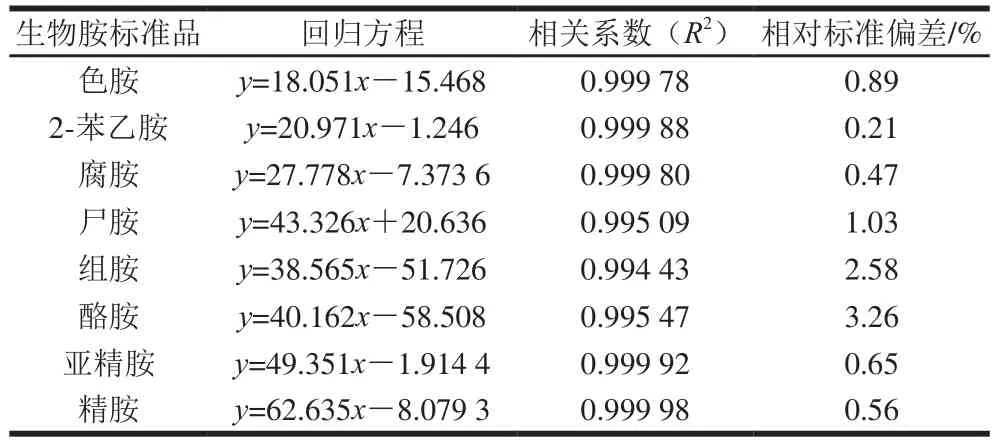
表3 高效液相色谱法测定生物胺的特征指标及其精密度实验结果Table3 Calibration equations, correlation efcient and precision(relative standard deviation) for biogenic amines
生物胺标准品 回归方程 相关系数(R2) 相对标准偏差/%色胺 y=18.051x-15.468 0.999 78 0.89 2-苯乙胺 y=20.971x-1.246 0.999 88 0.21腐胺 y=27.778x-7.373 6 0.999 80 0.47尸胺 y=43.326x+20.636 0.995 09 1.03组胺 y=38.565x-51.726 0.994 43 2.58酪胺 y=40.162x-58.508 0.995 47 3.26亚精胺 y=49.351x-1.9144 0.999 92 0.65精胺 y=62.635x-8.0793 0.999 98 0.56
由表3可见,8 种生物胺标准品的回归方程相关系数R2均大于0.994 0,说明标准曲线呈良好的线性关系,能满足检测样品中生物胺的要求。对质量浓度为80 mg/L的生物胺混合标准品,连续进样6 次,8 种生物胺的相对标准偏差范围为0.21%~3.26%,均小于4%,说明该液相色谱具有良好的精密度,方法重复性也较好。
2.6 纳豆发酵过程中生物胺的含量变化
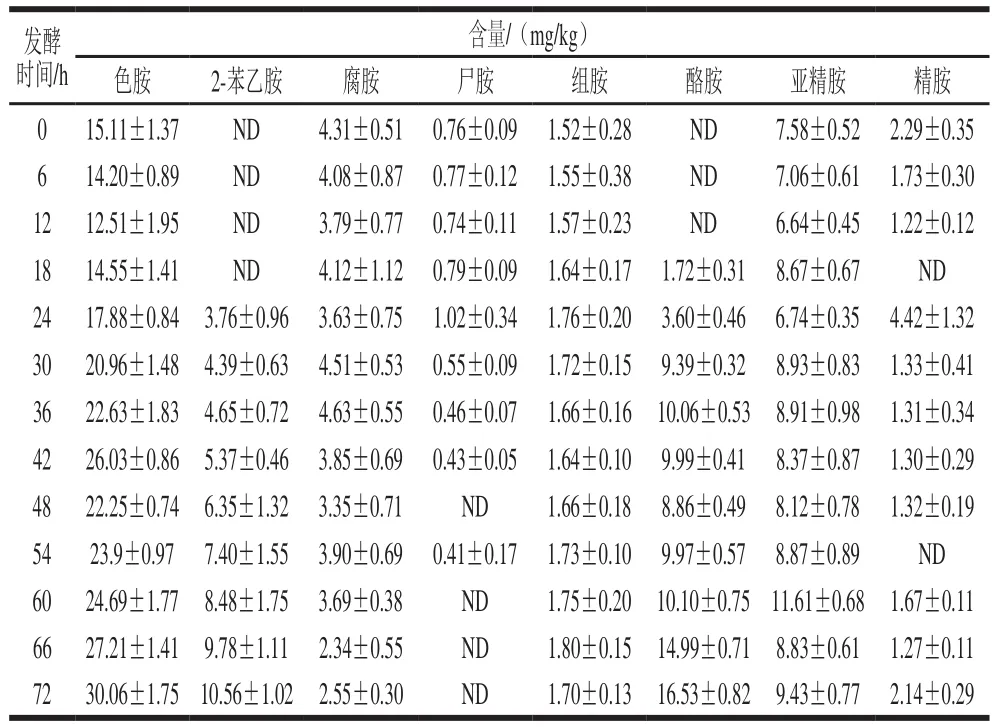
表4 纳豆发酵中生物胺含量Table4 The contents of biogenic amines in natto products
纳豆发酵过程中的生物胺含量见表4,从不同发酵时间的纳豆样品中共检测出8 种生物胺,只有尸胺、2-苯乙胺、精胺和酪胺在部分发酵时间中未能检测出。在发酵过程中不同生物胺的产量均有差异,其中色胺、2-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺和生物胺总量在纳豆发酵过程中的含量范围分别为12.51~30.06、ND~10.56、2.34~4.63、ND~1.02、1.52~1.80、ND~16.53、6.64~11.61、ND~4.42、26.47~72.97 mg/kg。从表4可以看出,除了色胺、2-苯乙胺、酪胺和亚精胺的生物胺含量上升外,其他的生物胺含量都保持不变或缓慢的下降,但生物胺总量由于色胺和酪胺较大幅度升高而上升。有报道指出,酪胺和尸胺能够抑制肠道中组胺-N-甲基转移酶和二胺氧化酶的活性,从而增强组胺对机体的毒性[26]。同时尸胺和腐胺可以同亚硝酸盐发生反应生成致癌物质亚硝胺,并能黏附一些肠黏膜上的肠道致病菌对机体构成危害[27-28]。另外,由于发酵食品中生物胺的形成不仅与原料选择和加工条件相关,同时也跟发酵过程中的微生物联系紧密,因此生物胺含量的高低也可被视为发酵过程中微生物污染的重要指标。
在整个纳豆发酵过程中,生物胺总量的变化趋势是随着时间推移而缓慢的增加。其中,在发酵0~12 h过程中生物胺总量有一定的下降,造成这种现象的原因可能是由于该时段为纳豆发酵时的延滞期,菌株GULR06在适应固态发酵环境,菌株缓慢开始生长,生物胺的代谢也刚开始进行,导致总生物胺的产生量低于总生物胺的挥发量,因而在此阶段生物胺的总量缓慢下降。在12~72 h的生物胺总量总体呈上升趋势,只有42~48 h中有一定的下降,这是由于该阶段为菌株的衰亡期,菌株大量死亡或生长畸形,生理代谢活动趋于停滞,而生物胺缓慢挥发导致此阶段生物胺总量下降。有研究表明,人体摄入生物胺总量超过1 000 mg/kg时会严重危害健康[29]。而由图7可以看出,本实验采用的枯草芽孢杆菌GULR06纯种进行纳豆发酵的各时段生物胺总量均小于80 mg/kg,远低于报道的危害人体健康的生物胺总量。有调查显示[30],25%的日本人每天食用100~200 g纳豆,以纳豆样品中检测的生物胺总量进行估算,应不存在安全问题,因而具有很大的商业生产价值。结合图4的纳豆发酵中纳豆激酶的合成曲线,可发现在用枯草芽孢杆菌GULR06进行纳豆发酵时,纳豆激酶相对活力在54 h时达到最大,为(5 439.5±149)IU/g,而在此时间生物胺总量为(56.18±4.94)mg/kg。以生产安全和纳豆激酶活力的角度而言,采用枯草芽孢杆菌GULR06进行纳豆生产时应在发酵到54 h时终止反应。
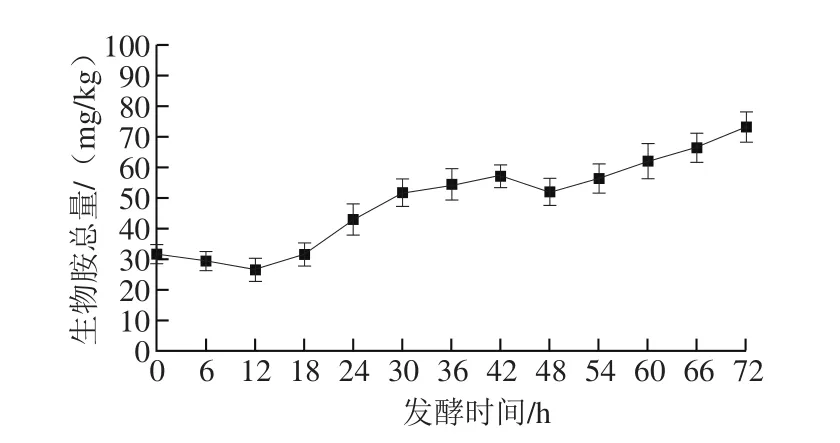
图7 纳豆发酵中生物胺总量变化曲线Fig.7 Changes in biogenic amines contents during natto fermentation
3 结 论
本研究采用纤溶活性筛选法从贵州织金农家土制烟熏腊肉中分离筛选出一株高产纳豆激酶菌株GULR06,对菌株的菌株形态、生理生化特征、16S rDNA序列分析以及系统发育分析,鉴定得到该菌株为枯草芽孢杆菌。用黄豆为主要原料进行固态发酵制备纳豆,通过高效液相色谱-紫外检测方法对发酵过程中的生物胺进行检测,得到在25 min内尸胺、腐胺、2-苯乙胺、色胺、精胺、酪胺、亚精胺、组胺在都能得到很好的分离,线性关系良好,R2均大于0.994 0,重复性的相对标准偏差均小于4%。在纳豆发酵过程中,对人体危害较大的2-苯乙胺、酪胺、组胺的含量均没有超过危险值,且生物胺总量范围在26.47~72.97 mg/kg之间,远低于人体摄入生物胺总量,所以本研究生产的纳豆不存在生物胺的食用安全性问题。
同时结合研究了发酵过程中纳豆激酶活力和生物量的变化。发现在发酵到54 h时,纳豆激酶活力达到最高,为(5 439.5±149)IU/g,活菌数为13(lg(CFU/g)),此时生物胺总量为(56.18±4.94)mg/kg。以纳豆安全性和酶活力得率的角度,得到了用枯草芽孢杆菌GULR06进行纳豆生产时应在发酵到54 h时终止反应。由于本研究所制备的纳豆具有高纤溶活性和安全性好的优点,因而对纳豆食品的研发和食品安全的控制都有很好的指导意义。

