产β-葡萄糖苷酶酵母菌的分离鉴定及其在人参皂苷Rg3转化中的应用
苏 敏,朴春红,*,梁德春*,初 琦,王玉华,王 尚,陈 月,胡 洋,霍 越
(1.吉林农业大学食品科学与工程学院,吉林 长春 130118;2.韩国庆熙大学人参资源中心,韩国 京畿道水源 449-701)
人参皂苷是人参(Panax ginseng C. A. Mey. entum)中主要生物活性成分之一,属于四环三萜皂苷,结构上由苷元与糖连接而成,由于苷元结构类型、糖基的数量和位置的不同,其性质和功能具有很大差异[1]。将人参中含量丰富的人参皂苷(Rb1、Rb2、Rc、Rd、Re、Rg1、Rf等)转化为药用价值更高、肠道吸收功能更强的稀有人参皂苷(Rh1、Rh2、F1、F2、Rg3、Rb3、Rh2、compound K等)成为现代研究的重点之一[2],其中稀有人参皂苷Rg3具有抑制肿瘤细胞增殖、浸润、转移作用,抑制胃癌诱导的血管内皮细胞增殖作用等备受关注[3]。然而自然生长的人参中人参皂苷Rg3含量极少[4],可以通过化学法、酶法和微生物法达到转化的目的。微生物法转化原理主要在于微生物所分泌的β-葡萄糖苷酶为主的酶系对人参皂苷进行转化。人参皂苷Rb1与人参皂苷Rg3相比,只在C-20位上多出2 个葡萄糖基[5],利用β-葡萄糖苷酶转移葡萄糖基的作用[6],可以将人参皂苷Rb1转化为人参皂苷Rg3(图1)[7]。邵巍等[8]研究利用β-葡萄糖苷酶将人参皂苷Rb1的C-21位2 个—GLc键水解,进而转化为稀有人参皂苷Rg3;闫炳雄等[9]研究发现经黑曲霉发酵人参后,也可生成人参皂苷Rg3,并得到较好的转化效果。
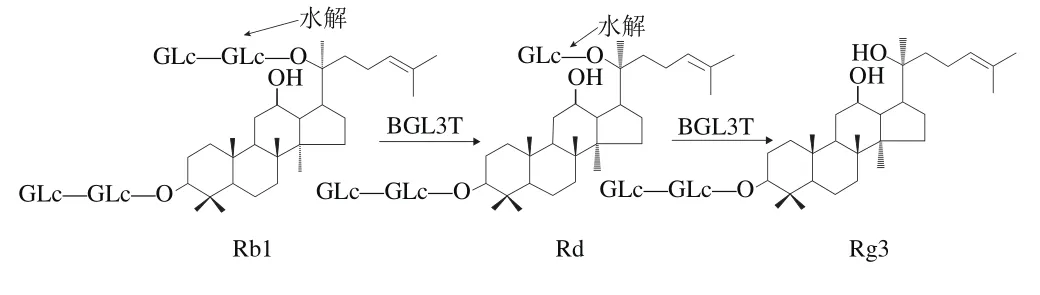
图1 人参皂苷Rg3转化途径[7]Fig.1 Transformation pathway of ginsenoside Rg3
kefir粒是一种多菌种共生的可食用微生物资源,研究表明kefir粒发酵液中含有β-葡萄糖苷酶在内的丰富酶系[10-11],其中β-葡萄糖苷酶是转化人参皂苷的重要酶之一[12-13],但目前利用kefir粒发酵人参的研究鲜有报道。本项目组利用kefir粒发酵全组分人参浆,研究发现其香气成分发生明显变化,人参感官品质得到显著改善,人参总皂苷含量也得以提高[14],本实验采用改良七叶苷琼脂糖培养基,从kef i r粒发酵人参浆中分离出β-葡萄糖苷酶菌株,并优化该菌株发酵人参转化稀有人参皂苷Rg3的发酵工艺。
1 材料与方法
1.1 材料与试剂
人参(4 a生)产于吉林省汪清县;kefir粒为本实验室保存菌种;伊利纯牛乳 市售。
人参皂苷Rb1(140518)、Rd(CAS号:52705-93-8)、Rg3(CAS号:14197-60-5)(纯度≥98%) 南京景竹生物有限公司;硅胶60薄层板 德国Merk公司;Taq DNA聚合酶、Ezup柱式酵母基因组DNA抽提试剂盒、DNA Ladder Mix marker 生工生物工程(上海)股份有限公司;乙腈、甲醇为色谱纯,其他试剂为分析纯。
1.2 仪器与设备
LC-20AT高效液相色谱仪、CS-9301PC薄层扫描仪日本岛津公司;AppLied Biosystems 3730XLDNA电泳槽、DYCP-31DN稳压电泳仪 北京六一仪器厂;DYY-5电热恒温水槽 上海一恒科学仪器有限公司;DK-8D凝胶成像仪 上海复日科技仪器有限公司;FR980恒温培养箱 太仓市科教器材厂;DHP-9162恒温摇床 太仓市实验设备厂。
1.3 方法
1.3.1 培养基制备
改良七叶苷琼脂糖培养基的配制参照宋欣等[15]的方法改良,配方为1 g七叶苷、0.5 g柠檬酸铁、2 g酵母膏、0.5 g蛋白胨、20 g琼脂,经121 ℃高压蒸气灭菌20 min;种子培养基配方为10 g酵母粉、20 g蛋白胨、20 g葡萄糖、20 g琼脂、1 000 mL蒸馏水、调至pH 6.0、经121 ℃高压蒸气灭菌20 min;人参浆制备方法为挑选无病虫害的完整鲜人参,清洗干净,蒸制20 min,按照人参-水质量比1∶2、5 000 r/min多次点动共计3 min打浆,110 ℃灭菌20 min。
1.3.2 产β-葡萄糖苷酶菌株的筛选与鉴定
形态结构鉴定:kefir粒在28 ℃条件下发酵人参浆48 h后,将其按10-3、10-4、10-5、10-64 个梯度稀释,各取50 μL菌液均匀涂布于改良七叶苷培养基,25 ℃培养48 h,菌落周围出现黑色的水解斑则为产β-葡萄糖苷酶菌株[16]。
分子鉴定方法:26S rDNA D1/D2区的序列分析是按照Jespersen[17]和Baleiras[18]等的方法。待测菌株DNA提取采用SK8257试剂盒操作;使用引物为NL1(5’-GCATATCAATAAGCGGAGGAAAAG-3’)和NL4(5’-GGTCCGTGTTTCAAGACGG-3’),由生工生物工程(上海)股份有限公司合成引物和序列测定,所得菌株DNA序列信息在NCBI上BLAST比对分析。PCR反应体系(25 μL):包括基因组DNA(20~50 ng/μL)0.5 μL,10×Buffer(含有Mg2+)2.5 μL,dNTP(各2.5 mmol/L)1 μL,Taq DNA聚合酶0.2 μL、上游引物(10 μmol/L)0.5 μL,下游引物(10 μmol/L)0.5 μL,加双蒸水至25 μL;PCR反应程序:94 ℃预变性4 min、94 ℃延伸45 s;55 ℃延伸45 s;72 ℃延伸1 min;30 个循环;72 ℃修复延伸10 min。PCR扩增产物用1%琼脂糖凝胶电泳检测,电泳条件为150 V、100 mA、20 min,使用凝胶成像仪观察结果。
1.3.3 人参浆全组分的发酵
将全人参培养基以5 mL/100 g的接种量接种107CFU/mL的马克斯克鲁维酵母菌,28 ℃培养48 h。由于本研究策略是尽可能不加大体系体积的前提下,提高稀有人参皂苷的含量,且前期实验表明摇床培养和静置培养对Rg3的含量变化不显著,因此实验采用静置培养。同等培养条件下加入相等体积的无菌水作为未发酵人参空白对照组。发酵结束后立即冷冻,随后使用真空冷冻进行干燥,干燥后将样品真空包装,-4 ℃储存备用[19]。
1.3.4 全组分发酵人参浆中总人参皂苷的提取
取发酵人参浆冻干粉末1 g,利用索氏提取法,三氯甲烷加热回流3 h后,弃去三氯甲烷,挥干溶剂,移入100 mL锥形瓶中,加入50 mL饱和正丁醇,静置过夜后,超声处理(功率250 W,频率50 Hz)30 min,过滤后取滤液25 mL,置于蒸发皿中蒸干,干燥物中加入少量甲醇溶液完全溶解后转入5 mL容量瓶定容后用于检测[20]。将各人参皂苷标品溶于100%甲醇中制得0.2 mg/mL溶液用于皂苷的分析[21]。
1.3.5 人参皂苷的测定
1.3.5.1 高效液相色谱(high performance liquid chromatography,HPLC)法
将1.3.4节中的总人参皂苷提取液用0.22 μm微孔滤膜过滤后,利用HPLC进行分析。分析条件:C18色谱柱(4.6 mm×250 mm,5 μm);柱温35 ℃;进样量10 μL;流速1 mL/min;流动相A为5%磷酸溶液、B为乙腈,洗脱条件是0~45 min,33% B;45~80 min,49% B;检测波长为203 nm[22]。
1.3.5.2 薄层层析(thin layer chromatography,TLC)法
将人参皂苷点样于TLC硅胶板上,展开剂为氯仿-甲醇-水(10∶5∶1,V/V)[23],喷20%硫酸-乙醇溶液后于110 ℃显色5 min。用薄层扫描仪扫描其灰度,按下式计算皂苷转化率:

式中:A为未发酵样品灰分质量;B为发酵后样品灰分质量。
1.3.6 单因素试验
考察人参-水质量比、pH值、接种量、发酵时间对转化人参皂苷Rg3含量的影响。人参皂苷Rg3含量表示1 g人参干质量含有的稀有人参皂苷Rg3含量。以转化人参皂苷Rg3含量为考核指标,确定各单因素试验合适的发酵条件,为转化人参皂苷Rg3的条件优化提供参考范围,试验设计设置3 个平行。
1.3.7 响应面试验
筛选得到的菌株转化人参皂苷Rg3单因素试验的基础上,采用Box-Behnken设计试验因素与水平(表1),试验结果用Design Expert 8.1分析,确定各因素及因素之间的交互作用对人参皂苷Rg3含量的影响,优化其工艺条件[24]。

表1 Box-Behnken试验因素与水平Table1 Factors and levels used in Box-Behnken design
1.4 数据处理与统计
采用MEGA5.0构建系统发育树,采用Design Expert 8.1响应面优化设计。数据以 ±s表示,采用Microsoft Excel 2010处理数据,用GraphPad Prism5.0制图,应用SPSS 17.0统计分析数据,组间比较采用单因素方差分析。
2 结果与分析
2.1 kef i r粒发酵人参液中稀有人参皂苷Rg3含量的变化
HPLC法分析人参稀有皂苷发现人参皂苷Rg3保留时间与Rh2、compound K的基本一致,紫外检测器条件下无法精确分析其变化。因此将HPLC法与TLC法相结合分析人参浆中人参皂苷Rg3的转化情况。人参皂苷Rg3有多种转化途径,其中一条转化途径为人参皂苷Rb1→Rd→Rg3[25]。本实验测定5%接种量kef i r粒发酵人参浆,28 ℃培养3 d后,发酵人参浆中人参皂苷Rb1、Rd和Rg3变化结果如表2所示。kef i r粒发酵后大大增加了Rg3的含量,稀有皂苷Rg3提高了134.7%。同时,发酵人参中人参皂苷Rb1比未发酵组降低了41.3%,人参皂苷Rd提高了104.5%。因此可以推测,kefir粒发酵人参转化人参皂苷Rg3可能的转化途径为Rb1→Rd→Rg3,研究表明β-葡萄糖苷酶在该转化途径中起重要作用[19]。

表2 ke fi r粒发酵人参皂苷含量Table2 Ginsenoside content in ke fi r fermented ginseng mg/g
2.2 产β-葡萄糖苷酶菌种的筛选
kefir粒发酵人参菌液涂布于改良七叶苷培养基上培养36 h后,筛选出产黑色水解斑的菌株C21(图2A),判断其为产β-葡萄糖苷酶的菌种。在七叶苷培养基中产黑色水解斑的菌落,进行形态结构鉴定,挑取单一菌落经反复划线分离得纯培养,制片、革兰氏染色、电子显微镜下观察其形态。形态相似,菌株在固体种子培养基中呈乳白色、平滑、不透明,表面光滑,菌落易挑起(图2B)。显微镜(×100)下观察形态结果如图2C所示,初步鉴定结果为一株酵母菌,进一步对其进行分子鉴定。
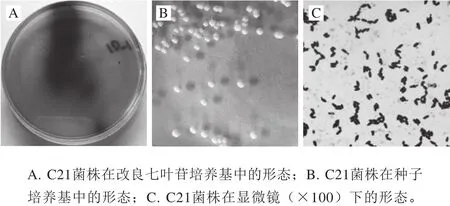
图2 产β-葡萄糖苷酶菌菌株的培养形态与形态特征Fig.2 Colony morphology and cultural characteristics of the strain capable of producing β-glucosaccharase on agar plate
2.3 产β-葡萄糖苷酶菌株分子鉴定
利用NL1和NL4一对引物扩增待测菌株26S rDNA近5’端D1/D2区域,扩增结果见图3。由图3可知,扩增产物经电泳检测出现578 bp荧光条带,与预期结果一致,片段大小与已报道的片段(500~600 bp)相符[15]。将待测菌株的D1/D2区域测序,在GenBank中进行同源性序列搜索(BLAST Search),结果显示待测菌株与马克斯克鲁维酵母序列相比,同源性高达99%(图4),因此进一步验证待测菌株为马克斯克鲁维酵母菌(Kluyveromyces marxianus)。该菌种是克鲁维酵母属中非常重要的一个菌种,因其耐高温、生长速率快且安全性高等诸多优势而应用于如酶类、乙醇等工业生物技术领域[26]。王和平[27]和曾爽[28]等从kefir粒分离鉴定出马克斯克鲁维酵母菌,钟浩等[12]从6 种不同来源的kefir粒分离的4 种菌种中也含有马克斯克鲁维酵母,与本研究的结果一致。微生物转化人参皂苷反应机制一般认为是微生物产生的酶水解人参皂苷中的糖基,从而引起结构的改变而得到稀有皂苷,如人参皂苷Rg3。目前研究结果表明,微生物转化Rg3的酶主要为β-葡萄糖苷酶[29],而利用微生物产β-葡萄糖苷酶应用于人参皂苷转化的研究多数为黑曲霉等真菌。因黑曲霉菌株的产酶活性会随着保存时间的延长而降低,不利于储存[30],在食品加工中的应用受到限制。近年来,许多学者关注于研究筛选产β-葡萄糖苷酶的食品级安全菌种。如金清等[31]研究从辣白菜、四川泡菜等蔬菜发酵筛选乳酸菌,史学伟等[32]研究从新疆特色葡萄中筛选产β-葡萄糖苷酶酵母菌等。kef i r粒中含有多种乳酸菌和酵母菌等微生物,但是kefir粒发酵全组分人参时,发现产β-葡萄糖苷酶的微生物为马克斯克鲁维酵母。马克斯克鲁维酵母适应性强,可以推测kefir粒发酵人参中马克斯克鲁维酵母成为优势菌种,抑制了乳酸菌的生长。将该菌株保存于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),保藏编号为13907。
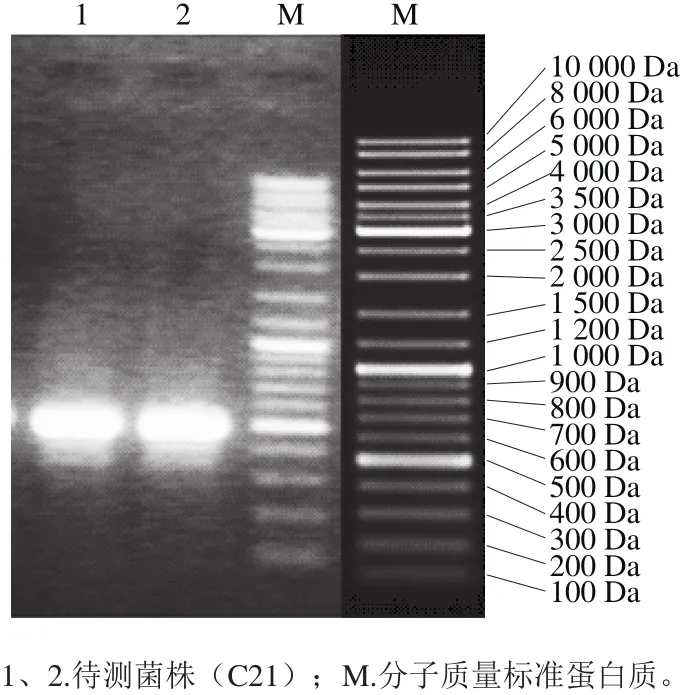
图3 待测菌株(C21)26S rDNA D1/D2区域的PCRFig.3 PCR of the 26S rDNA D1/D2 region of the strain (C21)
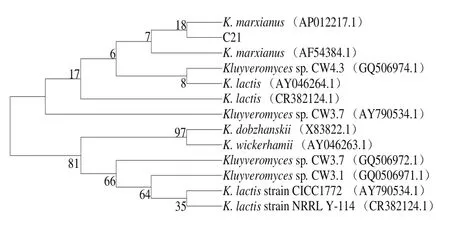
图4 依据26S rDNA序列的系统发育树Fig.4 Phylogenetic tree based on 26S rDNA sequences constructed by neighbor-joining method
2.4 马克斯克鲁维酵母发酵人参提高人参皂苷Rg3工艺优化
2.4.1 单因素试验结果
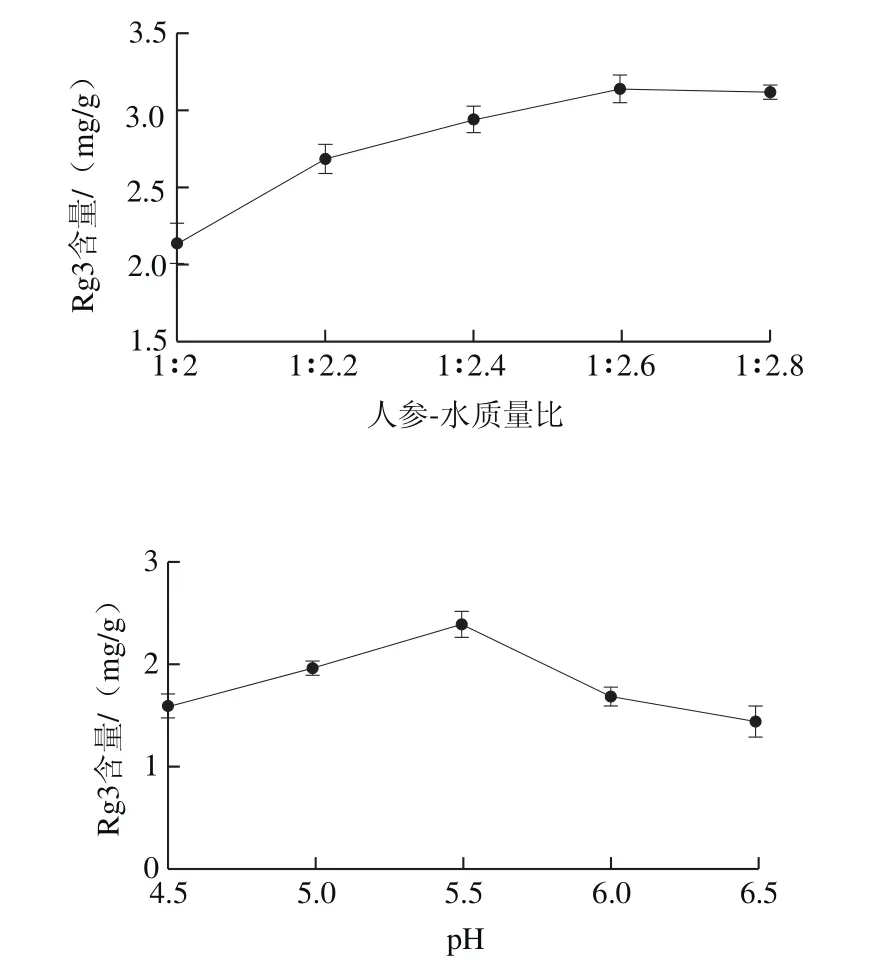

图5 人参-水质量比、pH值、接种量和发酵时间对人参皂苷Rg3含量的影响Fig.5 Effects of ginseng-to-water ratio, pH value, inoculumconcentration, and fermentation time on the content of ginsenoside Rg3
由图5可知,人参-水质量比在1∶2.0~1∶2.6范围内,随着水比例的增加,人参皂苷Rg3含量呈现上升趋势,当人参-水质量比为1∶2.6时人参皂苷含量达到最大值为(3.22±0.18)mg/g,随后人参皂苷Rg3含量趋于稳定。在pH值范围为4.5~6.5范围内,随着pH值的增加,人参皂苷Rg3的含量呈现先上升再下降的趋势,当pH值为5.5时,人参皂苷Rg3的产量达到最大值为(2.36±0.23)mg/g。考察马克斯克鲁维酵母接种量对稀有皂苷转化率的影响中发现,随着接种量的增加,人参皂苷Rg3的含量呈现先增加后减少的趋势,当接种量为3%时,人参皂苷含量达到最高值为(3.02±0.25)mg/g,随后人参皂苷Rg3的含量有所下降,这可能是由于酵母菌的积累所产生的次级代谢产物将人参皂苷Rg3转化成其他皂苷。在发酵时间1~9 d内,随着发酵时间延长,人参皂苷Rg3含量呈现先上升后下降的趋势,且呈阶梯状下降,当发酵时间3 d时,人参皂苷Rg3的含量达到最大值为(3.13±0.11)mg/g。结果显示,人参-水质量比、pH值、接种量和发酵时间对转化Rg3影响显著。但是所有试验组的人参浆pH值范围保持在5.5~6.0左右,从成本和工业化生产角度出发,选择人参-水质量比、接种量和发酵时间进行响应面试验分析。
2.4.2 响应面试验结果与方差分析
根据Box-Behnken试验设计原理,综合单因素试验结果,进行3因素3水平响应面试验,结果如表3所示,方差分析结果见表4。

表3 响应面试验设计及结果Table3 Experimental design and results for response surface analysis
对上述试验结果进行二次回归拟合,建立的回归方程为Y=3.40+0.26A-0.099B-0.024C+0.30AB+0.055AC-0.33BC-0.50A2-0.39B2+0.24C2。

表4 方差分析结果Table4 Analysis of variance for quadric regression model
从表4可得出,整体模型的F值为78.44(P<0.000 1),表明试验所采用二次回归方程模型极显著,在统计学上是有意义的。本试验失拟项P值为0.220 3大于0.05,对模型有利,无失拟因素存在。该模型方程决定系数R2值为0.977 6,说明回归方程拟合程度良好,自变量与响应面之间线性关系显著,可用于人参皂苷Rg3含量检测试验的理论预测[24]。对比影响人参皂苷Rg3含量的主次因素为人参-水质量比(A)>接种量(B)>发酵时间(C)。

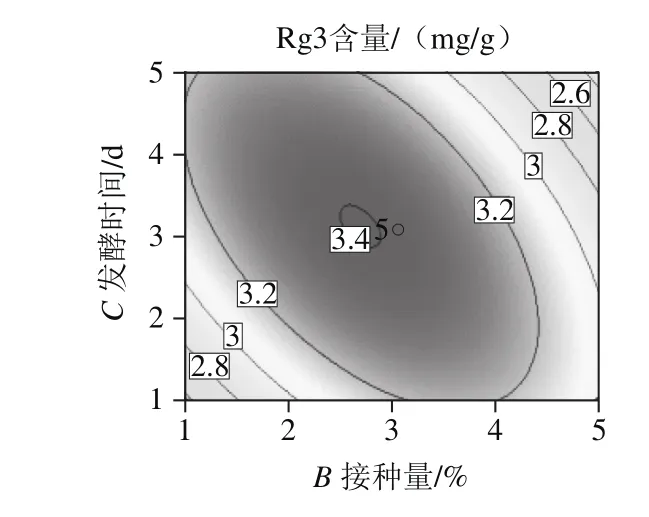
图6 Box-Behnken试验模型响应面图和等高线图Fig.6 Rsponse surface and contour plots
由图6可以看出,对人参-水质量比、接种量和发酵时间3 个因素交互作用分析,得到交互因素的响应面图,等高线图均为椭圆形,响应面三维图均有稳定点,且为极大值。结果显示人参-水质量比和酵母接种量、酵母接种量和发酵时间均具有交互性(P<0.05),人参-水质量比和发酵时间的交互作用不显著(P>0.05)。通过数据处理分析可知,优化的发酵条件为人参-水质量比1∶2.65、发酵时间3 d、接种量2.94%,人参皂苷Rg3含量最大预测值为3.3298 mg/g。为检验模型的准确性,采用优化后最佳发酵条件进行发酵验证实验,3 次实验得到人参皂苷Rg3含量平均值为(3.31±0.04)mg/g。预测值与实际值接近,说明该回归模型优化的发酵工艺是有效的。
众多学者致力于微生物发酵转化人参皂苷的研究[1,2,15],得到了较好的结果。江波等[33]研究发现,马克斯克鲁维酵母分泌的酶具有糖基转移的活性,能促进人参皂苷的形成。本实验研究kefir粒以及首次探索从kefir粒分离得到的产β-葡萄糖苷酶菌株发酵全组分人参,发现均能显著提高人参皂苷Rg3含量,经优化发酵工艺后人参皂苷Rg3含量与未发酵人参中人参皂苷Rg3相比提高了3.48 倍,高于陈旸等[34]研究的2.3 倍和吴迪等[35]研究的转化率44%。更值得关注的是,马克斯克鲁维酵母发酵人参后产生特殊的香气,给人们一种非常愉悦的感受。本课题组对kefir粒发酵人参后香气成分进行分析,发现发酵后的人参增加了果香味和烧烤香味,同时降低其不良风味[14]。人参进入新资源食品原料库后,除人参皂苷含量外,人参的感官品质也成为重要的食品加工因素。运用微生物法发酵改善人参风味有希望成为开发人参高价值食品的有效途径。
3 结 论
本实验从kefir粒发酵人参浆中筛选出产β-葡萄糖苷酶的菌株,经鉴定为马克斯克鲁维酵母(Kluyveromyces marxianus)。通过Box-Behnken试验设计优化马克斯克鲁维酵母转化生产人参皂苷Rg3工艺,优化后的工艺为人参-水质量比1∶2.65、发酵时间3 d、马克斯克鲁维酵母接种量2.94%,该条件下人参皂苷Rg3含量为(3.31±0.04)mg/g,转化率为248%,比优化之前提高了1.84 倍。该结论为全组分人参发酵食品工业化生产提供理论数据。

