滤纸片法筛选抑制嗜水气单胞菌群体感应的乳酸菌及抑制作用分析
林 洋,孙梦桐,吕欣然,白凤翎,*,励建荣,沈 琳
(1.渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013;2.北京林业大学生物科学与技术学院,北京 100083;3.大连东霖食品股份有限公司,辽宁 大连 116101)
嗜水气单胞菌(Aeromonas hydrophila)是一种兼性厌氧的革兰氏阴性条件致病菌,广泛存在于淡水、海水、水量较为丰富的土壤和池塘等自然环境中。在养殖水体环境中,该属细菌极易感染鲫鱼、鲤鱼和罗非鱼等鱼类,导致其皮肤溃疡、鱼鳍腐烂、眼球突起,也可引发水产动物出现败血症和人类的腹泻病等[1-2]。嗜水气单胞菌的致病性与其产生的溶血素、气溶素、蛋白酶、脂肪酶、肠毒素、黏附素及外膜蛋白等毒力因子密切相关[3-5]。
群体感应(quorum sensing,QS)指细菌细胞间通过分泌信号分子进行相互交流,当信号分子浓度达到特定阈值时,细胞会启动特定基因尤其是多种致病基因的表达[6]。随着人们对QS系统深入了解,发现许多病原菌的致病性与其自身QS系统密切相关[7]。QS能够参与致病菌毒力因子的表达、生物被膜的形成以及生物发光等现象。Khajanchi等[8]研究发现A. hydrophila SSU的QS系统中存在双组分信号转导系统(QseBC),参与其生物被膜、胞外蛋白酶、群集和泳动的调控。杨安林等[9]发现外源信号分子AI-2能促进嗜水气单胞菌聚集形成菌落,提高生物被膜的生成量,增强细菌耐药性。Jahid等[10]认为嗜水气单胞菌所产生的N-丁酰高丝氨酸内酯(N-butanoy-l-L-homoserie lactone,C4-HSL)和N-己酰高丝氨酸内酯(N-hexanoyl-L-homoserie lactone,C6-HSL)均可参与其生物膜的形成和蛋白酶的产生,对QS系统具有调控作用。
群体感应抑制剂(quorum sensing inhibitor,QSI)通常针对QS系统发挥抑制作用,且不干扰细菌体内的正常生命活动[11]。QSI可通过阻断QS传导信号分子的合成、降解QS信号分子、降低或抑制信号分子受体蛋白活性以及菌群间竞争4 种方式发挥抑制作用[12]。生物源性QSI一般来源于动物、植物和微生物,微生物源性QSI主要来自于真菌和细菌的代谢产物。唐艺丹等[13]发现海洋真菌Penicillium sp. QF046代谢产物中存在对紫色杆菌QS具有抑制作用的星形曲霉毒素。Natrah等[14]研究发现微藻可有效降低A. hydrophila和A. salmonicida的毒力效应,具有抑制QS活性的作用。
乳酸菌分布广泛自然生态环境中,通过营养物竞争、生态位竞争、形成酸性环境以及产生拮抗性代谢产物等多种方式抑制他种微生物的生长繁殖[15]。乳酸菌生物制剂具有安全高效、绿色无残留等优势,广泛应用于各种食品领域。对于乳酸菌是否能够通过影响QS系统的表达实现抑制食品腐败菌和食源性致病菌的生长繁殖,其代谢产物中是否存在QSI,国内外鲜见报道。Park等[16]从泡菜中分离到Lactobacillus sakei NR28,发现它能够有效降低Escherichia coli ATCC43894 QS系统中AI-2的活性,从而抑制许多相关毒力因子的表达,具有QS抑制活性。
本实验以水产养殖致病菌嗜水气单胞菌为研究对象,从传统发酵食品的乳酸菌中筛选能够抑制嗜水气单胞菌QS的菌株,并探究其对嗜水气单胞菌蛋白酶、嗜铁素等毒力因子及生物膜形成的影响,为研发水产养殖乳酸菌微生态制剂提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株及培养条件
乳酸菌菌株:分离自传统发酵酸菜、芥菜、豆角、雪菜、黄瓜。
指示菌株:紫色杆菌(Chromobacterium violaceum)CV026,自身不产生N-酰基-高丝氨酸内酯类信号分子(N-acylhomoserine lactones,AHLs),仅当外源AHLs存在时,菌株可产生紫色菌素,可检测C4-HSL~C8-HSL的信号分子,由本实验室保藏。
目标菌株:嗜水气单胞菌LY-2,分离自大菱鲆体表,由本实验室保藏。
1.1.2 培养基和试剂
MRS琼脂、LB肉汤、LB琼脂 北京奥博星生物技术有限公司;乳酸菌生化鉴定管 杭州天和微生物试剂有限公司;甲醇(色谱级) 德国Merck公司;乙酸乙酯国药集团化学试剂有限公司;卡那霉素、细菌基因组DNA快速抽提试剂盒、DNA Marker-D、Taq聚合酶链式反应(polymerase chain reaction,PCR)Master mix上海生工生物工程有限公司。
1.2 仪器与设备
DL-CJ-2N超级洁净工作台 北京市东联哈尔仪器制造有限公司;SPX-250生化培养箱 宁波海曙赛福实验仪器厂;Vortex GENIUS 3振荡器 德国IKA公司;5804R高速冷冻离心机、ABI stepone plus PCR仪德国E p p e n d o r f公司;D Y Y-8 C电泳仪北京市六一仪器厂;Q u a n t i t y O n e凝胶成像系统、I m a r k酶标仪 美国B i o-R a d公司;MS105UD电子分析天平 瑞士梅特勒-托利多有限公司;GI54DS立式高压蒸汽灭菌锅 致微(厦门)仪器有限公司;RE-2000A旋转蒸发器 上海亚荣生化仪器厂;Free Zone 2.5台式真空冷冻干燥机 美国Labconco公司;S-4800扫描电镜、E-1045镀金仪 日本日立公司。
1.3 方法
1.3.1 乳酸菌无细胞上清液(cell free supernatants,CFS)和嗜水气单胞菌AHLs的制备
将初筛获得的乳酸菌接种于MRS液体培养基中,2.0%的接种量传代培养2 次,37 ℃培养12 h。经4 ℃、8 000 r/min离心10 min,用0.45 μm滤膜过滤获得CFS,4 ℃冰箱保存备用;
将-80 ℃保存的嗜水气单胞菌接种于LB肉汤,30 ℃培养12 h,以1.0%的接种量传代培养1 次后,4 ℃、8 000 r/min离心10 min,获得的上清液中含有AHLs,4 ℃冰箱保存备用。
1.3.2 乳酸菌QSI的筛选
滤纸片法:将180 μL的乳酸菌CFS分两次浸湿于直径为5 mm的圆形滤纸片上,无菌风吹干,对照组为MRS,备用;紫色杆菌CV026过夜活化2 次后,以2%接入量接种于200 mL含有200 μg/mL卡那霉素的LB肉汤中,30 ℃培养24 h,取2 mL紫色杆菌CV026与25 mL含有25 μL嗜水气单胞菌AHLs的LB培养基混合,将滤纸片置于培养基上,30 ℃培养24 h,记录孔周围出现的不透明的白色浑浊圈。
1.3.3 乳酸菌粗提物的制备
取100 mL乳酸菌CFS置于500 mL分液漏斗中,100 mL乙酸乙酯分5 次加入后沿同一方向缓慢振荡静置,待分层明显后收集乳化层于三角瓶,将5 次萃取液合并后于45 ℃、120 r/min条件下真空旋转蒸发至有机溶剂气味完全消失,将残留液转存至无菌锥形瓶,真空冷冻干燥制成粉末置于-18 ℃冰箱保存备用。
1.3.4 乳酸菌粗提物最小抑菌浓度(minimum inhibitory concentration,MIC)测定
采用液体倍比稀释法[17],将乳酸菌粗提物置于10 mL LB肉汤中制成终质量浓度分别为2、4、8、16、32 mg/mL的溶液,以不加乳酸菌粗提物的LB肉汤为对照组,向每只试管中各加入浓度为106CFU/mL目标菌菌悬液180 μL,30 ℃培养24 h,肉眼观察,无浑浊现象的最小浓度为MIC,每组平行3 次。
1.3.5 乳酸菌粗提物对生物膜的影响
1.3.5.1 抑制率的测定
采用96 孔板法,96 孔板中每孔加入180 μL菌液,再加入20 μL粗提物,对照组MRS补平。30 ℃培养24 h后,移出孔内培养液,用200 μL无菌水清洗3~5次,再添加200 μL 0.4%的结晶紫染色5 min,然后用无菌水清洗3 次,置于60 ℃恒温干燥箱干燥10 min,取出96 孔板,在每个孔中加入200 μL 95%乙醇溶液,每个孔内移出150 μL到另一96 孔板内,用酶标仪在595 nm波长下测定OD值,每个样品设置3 个平行。抑制率按式(1)计算:抑菌率/%=OD对照-ODQSI×100(1)OD对照
式中:OD对照为嗜水气单胞菌菌悬液OD值;ODQSI为粗提物处理组的OD值。
1.3.5.2 光学显微镜观察
在24 孔板中放入无菌盖玻片(R=1.4 cm),孔内加入1 mL LB肉汤和10 μL过夜培养的目标菌菌液及100 μL QSI粗提物,30 ℃培养24 h后,再用超纯水润洗盖玻片3次,0.4%结晶紫染色20 min,油镜下观察。
1.3.5.3 扫描电镜分析
在24孔板中放入无菌盖玻片(R=1.4 cm),孔内加入1 mL LB肉汤和10 μL过夜培养的嗜水气单胞菌菌悬液及100 μL QSI粗提物,30 ℃培养24 h后,用超纯水润洗盖玻片3 次,2.5%戊二醛溶液中4 ℃固定过夜。用超纯水洗涤3 次除去残留的戊二醛,分别用40%、70%、90%、100%乙醇溶液进行脱水处理15 min,盖玻片真空干燥,喷金,扫描电镜观察。
1.3.6 胞外蛋白酶检测
参考Sacherer等[18]的方法配制脱脂乳平板。将脱脂奶粉15%、琼脂粉1.5%溶于蒸馏水中,105 ℃灭菌15 min。待测样品分别为嗜水气单胞菌菌悬液+AHLs、嗜水气单胞菌菌悬液+MRS肉汤(0 mg/mL)、嗜水气单胞菌菌悬液+乳酸菌粗提物(4 mg/mL)、嗜水气单胞菌菌悬液+乳酸菌粗提物(8 mg/mL)。待培养基冷却至40~50 ℃时,倾注平板,无菌风吹干,采用双层琼脂扩散法[19],测量水解圈的直径,每组3 个平行,30 ℃培养24 h。
1.3.7 嗜铁素的检测
参照Shin等[20]的方法制作CAS(chrome azurol sulphonate)检测平板。待测样品分别为嗜水气单胞菌菌悬液+AHLs、嗜水气单胞菌菌悬液+MRS肉汤(0 mg/mL)、嗜水气单胞菌菌悬液+乳酸菌粗提物(4 mg/mL)、嗜水气单胞菌菌悬液+乳酸菌粗提物(8 mg/mL),待培养基冷却至40~50 ℃时,倾注平板,无菌风吹干。采用双层琼脂扩散法[19],测量黄色晕圈直径,每组3 个平行,30 ℃培养24 h。
1.3.8 乳酸菌粗提物对嗜水气单胞菌群集和泳动运动的抑制
参照Packiavathy等[21]的方法并稍作修改,将不同质量浓度乳酸菌粗提物经0.22 μm的滤膜过滤除菌后,分别与群集培养基(1%蛋白胨、0.5%琼脂、0.5%氯化钠及0.5%葡萄糖)和泳动培养基(1%胰蛋白胨、0.3%琼脂及0.5%氯化钠)混匀倒板,使平板中乳酸菌粗提物的终质量浓度达到0、2、4、8 mg/mL。向冷却的平板中央加入5 μL嗜水气单胞菌菌液,无菌风吹干,30 ℃培养48 h,观察嗜水气单胞菌的迁移情况。迁移抑制率按式(2)计算:
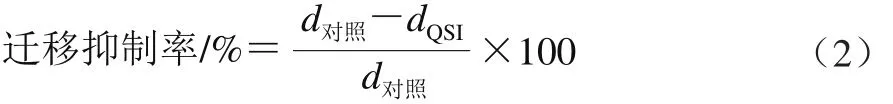
式中:d对照为对照组嗜水气单胞菌群集或泳动的迁移直径/mm;dQSI为乳酸菌粗提物处理组嗜水气单胞菌群集或泳动的迁移直径/mm。
1.3.9 乳酸菌粗提物对嗜水气单胞菌AHLs的降解
取10 μL AHLs粗提物加到终质量浓度为0、4、8 mg/mL的QSI粗提物中,37 ℃培养24 h。取2 mL紫色杆菌CV026与25 mL LB琼脂混匀倒板,倒入底层铺有素琼脂的平板中,用牛津杯打孔,孔内分别加入180 μL样品,30 ℃培养24 h,记录孔周围出现紫色晕圈的直径。
1.3.10 乳酸菌菌株鉴定
1.3.10.1 生理生化鉴定
挑选具有QS抑制作用的乳酸菌菌株,参照文献[22-23]进行乳酸菌菌株生理生化鉴定。
1.3.10.2 16S rRNA鉴定
吸取1.0 m L乳酸菌菌株培养12 h的菌悬液加入1.5 mL EP管中,12 000 r/min离心5 min,采用D N A快速抽提试剂盒提取菌株D N A,以16S rDNA通用引物进行PCR扩增。正向引物为27f(5’-AGAGTTTGATCCTGGCTCAG-3’),反向引物为1492r(5’-TACGGYTACCTTTGTTACGACTT-3’),引物由上海生工生物技术公司合成。PCR扩增反应体系为DNA模板1.0 μL、Taq PCR Master mix 12.5 μL、dd H2O 9.5 μL、上游引物1.0 μL、下游引物1.0 μL,总体积25 μL。PCR扩增程序:94 ℃预变性2 min,94 ℃变性1 min,60 ℃退火1 min,72 ℃延伸90 s,72 ℃保持10 min,循环30 次,4 ℃保温。PCR产物经1%琼脂糖凝胶电泳,观察凝胶成像系统的扩增效果并照相。将扩增成功的PCR产物送至上海生物工程股份有限公司进行测序。测序结果经校对后与NCBI上GenBank数据库中的己有序列进行BLAST比对分析,运用MEGA 5.0软件构建乳酸菌菌株系统发育进化树。
1.4 数据处理
利用软件Origin 8.0进行实验数据处理,数据平行测定3 次,结果用 ±s表示,采用SPSS 18.0软件对数据进行统计学分析。
2 结果与分析
2.1 乳酸菌菌株QSI的筛选
利用滤纸片法从来自传统发酵食品中的135 株乳酸菌中获得6 株对嗜水气单胞菌QS有抑制作用的菌株,其中菌株SCT-2、AJS3-1、LHJ1-3对嗜水气单胞菌QS抑制作用明显,抑菌圈直径分别为10.57、9.05 mm和8.79 mm(表1)。图1为香草醛及3 株乳酸菌对紫色杆菌CV026产紫色素的抑制效果图,可以看出菌株SCT-2的抑制QS效果明显优于香草醛。因此选择菌株SCT-2进行后续实验。

表1 传统发酵蔬菜中乳酸菌对嗜水气单胞菌QS的抑制作用Table1 Antagonistic QS effects of LAB from Chinese traditional fermented vegetables against A. hydrophila

图1 香草醛(a)及乳酸菌(b)对紫色杆菌CV026产紫色素的抑制作用Fig.1 Inhibitory effect of vanillin and LAB on violacein production of C. violaceum CV026
2.2 乳酸菌粗提物的MIC测定结果
SCT-2粗提物对嗜水气单胞菌和紫色杆菌CV026的抑菌情况如表2所示,肉眼观察到嗜水气单胞菌和紫色杆菌CV026试管中16 mg/mL及16 mg/mL以上均无浑浊现象,确定16 mg/mL为抑制嗜水气单胞菌的MIC。为验证菌株SCT-2是通过抑制嗜水气单胞菌QS而不是抑菌的方式发挥作用,因而选择8 mg/mL及以下质量浓度的菌株SCT-2粗提物进行后续研究。
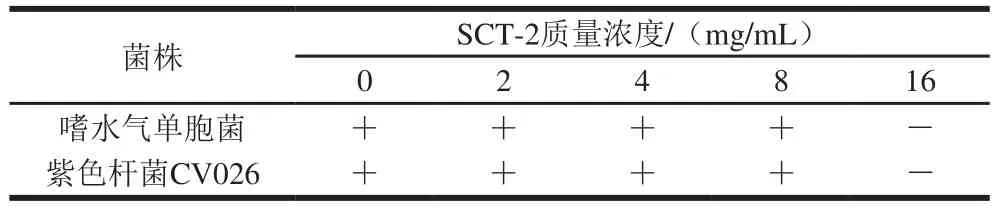
表2 菌株SCT-2粗提物对嗜水气单胞菌及紫色杆菌CV026的MIC Table2 MICs of SCT-2 against A. hydrophila and C. violaceum CV026
2.3 乳酸菌粗提物对生物膜形成的影响
生物膜指附着在实体表面的微生物群落,通过生长繁殖并分泌一些蛋白质、DNA和多糖等,将细菌包裹其中组合成的胞外聚合物基体膜状物[24]。96 孔板法结果表明,菌株SCT-2粗提物质量浓度为8 mg/mL时,对嗜水气单胞菌生物膜的抑制率为45.16%。图2是菌株SCT-2粗提物对嗜水气单胞菌生物膜影响的光学显微镜和扫描电镜图片。光学显微镜图片显示,对照组嗜水气单胞菌有浓密的细菌菌落而实验组细菌菌落密度比较稀疏,结果表明菌株SCT-2粗提物能够有效抑制嗜水气单胞菌生物膜的形成(图2A、B)。扫描电镜图片显示,对照组嗜水气单胞菌生物膜结构致密,而实验组生物膜发生断裂。说明菌株SCT-2粗提物不仅能够降低嗜水气单胞菌生物膜的生成量,而且可使其生物膜断裂(图2C、D)。
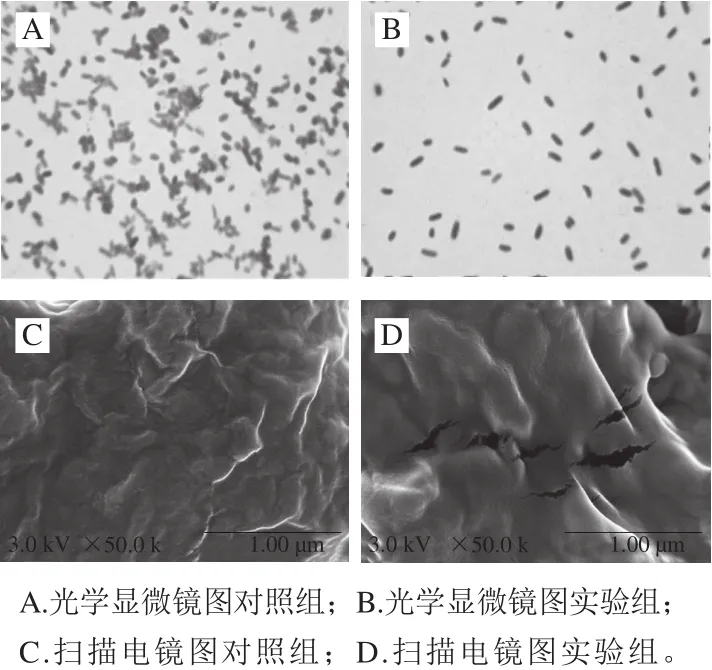
图2 菌株SCT-2粗提物对嗜水气单胞菌生物膜形态的影响Fig.2 Effect of crude extract on biof i lm morphology of A. hydrophila
2.4 乳酸菌粗提物对嗜水气单胞菌蛋白水解活性的影响
嗜水气单胞菌的胞外蛋白酶能够消化掉层片素和胶原等多种胞外组织基质,使其变为可供机体利用的氨基酸,为病原菌的生长繁殖提供了良好的条件[25]。AHLs与菌株SCT-2粗提物对嗜水气单胞菌蛋白水解活性的影响如图3所示,AHLs能够使脱脂乳平板中水解圈直径由(15.27±0.23)mm增大到(17.05±0.15)mm,两者间具有显著差异(P<0.05)。此外,水解圈的大小随着菌株SCT-2粗提物质量浓度的增大而减小。由此看出,菌株SCT-2粗提物可显著抑制嗜水气单胞菌蛋白酶的产生(P<0.05),降低其致病性,且4 mg/mL和8 mg/mL的菌株SCT-2粗提物对蛋白酶的抑制率分别达到12.05%和27.18%,结果表明,菌株SCT-2粗提物对嗜水气单胞菌蛋白酶的抑制作用与其质量浓度呈正相关。
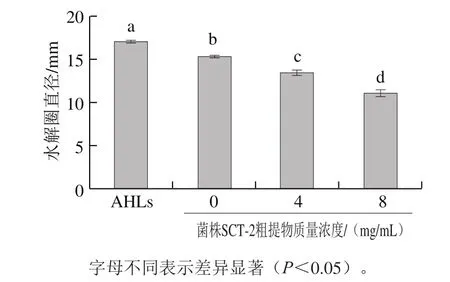
图3 AHLs和乳酸菌粗提物对嗜水气单胞菌蛋白水解活性的影响Fig.3 Inhibitory activities of AHLs and crude extract from SCT-2 against proteolytic activity of A. hydrophila
2.5 嗜铁素的检测结果
嗜铁素是指微生物在与Fe3+在低铁应激条件下形成的一种螯合因子,嗜水气单胞菌通过产生嗜铁素与环境中其他微生物竞争性结合Fe3+,影响其他微生物生长以维持自身菌群密度的稳定[26-27]。由图4可知,与0 mg/mL相比,AHLs处理组嗜铁素的生成量显著增大。结果表明QS对嗜水气单胞菌嗜铁素的产生存在调控作用。菌株SCT-2粗提物处理组的黄色圈明显小于0 mg/mL,随着菌株SCT-2粗提物质量浓度的增大,黄色圈的直径逐渐减小,且4 mg/mL和8 mg/mL的菌株SCT-2粗提物对嗜铁素的抑制率分别达到14.59%和22.11%,说明菌株SCT-2粗提物能够有效抑制嗜水气单胞菌嗜铁素的产生进而使其致病能力减弱。
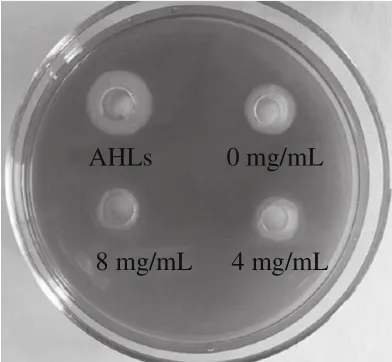
图4 AHLs和菌株SCT-2粗提物对嗜水气单胞菌嗜铁素产生的影响Fig.4 Inhibitory activities of AHLs and crude extract from SCT-2 against siderophore production of A. hydrophila
2.6 乳酸菌粗提物对嗜水气单胞菌群集和泳动现象抑制
群集和泳动都是由细菌鞭毛介导。群集是一种群体行为,微生物在可湿固体培养基表面或液体培养基内运动。泳动是个体行为,微生物在固体培养基表面或半固体培养基上运动,产生可见生长圈的现象[28]。细菌的群集和泳动运动能力与细菌的侵袭能力有直接关系,对于病原细菌来说,抑制其运动性是重要的治病因素之一[29]。图5是菌株SCT-2粗提物对嗜水气单胞菌群集和泳动的影响,随着菌株SCT-2粗提物质量浓度的增加,嗜水气单胞菌迁移直径均呈现增加下降趋势,当菌株SCT-2粗提物质量浓度为0 mg/mL时,嗜水气单胞菌的群集和泳动的迁移直径分别为(19.71±0.56)mm和(12.17±0.42)mm,群集培养基中8 mg/mL的菌株SCT-2粗提物可使嗜水气单胞菌的迁移直径降低为(9.05±0.87)mm,迁移抑制率达到54.08%。泳动培养基中4 mg/mL的菌株SCT-2粗提物可使嗜水气单胞菌的迁移直径降低为(7.52±0.63)mm,迁移抑制率达到38.21%,而8 mg/mL的乳酸菌粗提物使嗜水气单胞菌的迁移完全受到抑制。
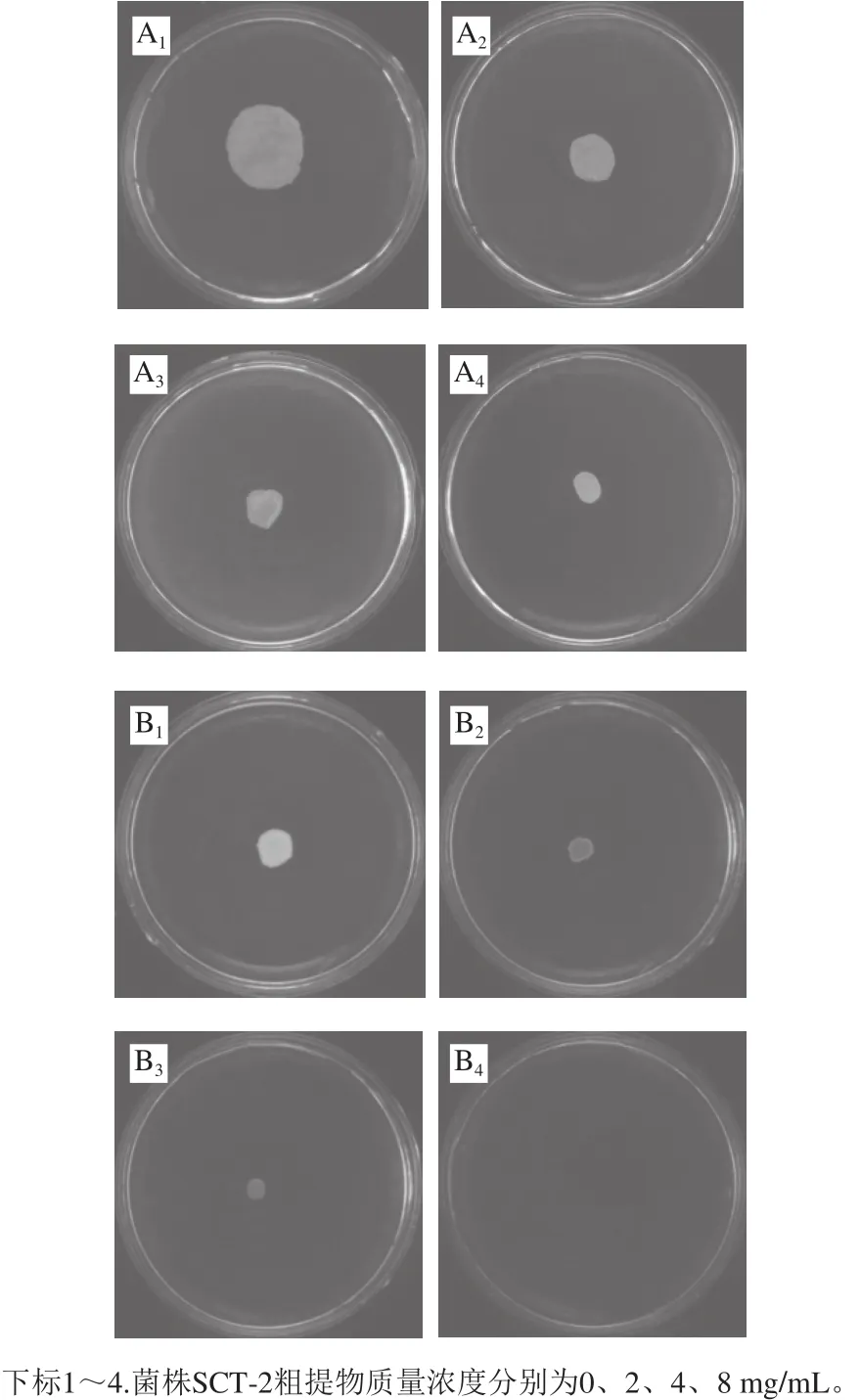
图5 菌株SCT-2粗提物对嗜水气单胞菌群集(A)和泳动(B)的抑制作用Fig.5 Inhibitory activities of crude extract from SCT-2 on swarming (A)and swimming (B) of A. hydrophila
2.7 乳酸菌粗提物对嗜水气单胞菌的信号分子的降解
图6是乳酸菌粗提物对嗜水气单胞菌信号分子降解效果图。与对照组相比,利用质量浓度为4 mg/mL和8 mg/mL菌株SCT-2粗提物处理时,紫色晕圈变小且降解率分别达到12.14%和32.27%。结果表明,菌株SCT-2粗提物可降解嗜水气单胞菌信号分子,从而抑制嗜水气单胞菌的QS。Torres等[30]将分离自贝类的Alteromonas stellipolaris PQQ-42与C6-HSL(10 mmoL/L)共培养,降解率可达99.7%,进而抑制V. mediterranei VibC-Oc-097的QS现象,本研究与其结果相似。
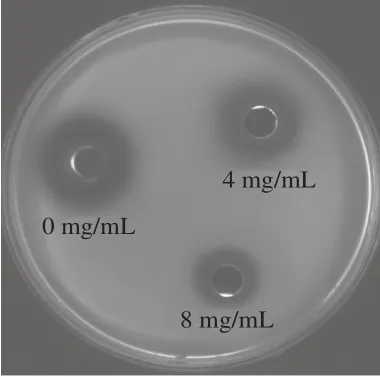
图6 菌株SCT-2粗提物降解AHLsFig.6 AHLs degradation by crude extract from SCT-2
2.8 乳酸菌菌株鉴定
菌株SCT-2的生理生化鉴定结果见表3,初步断定菌株SCT-2为植物乳杆菌(Lactobacillus plantarum)。

表3 菌株SCT-2的生理生化鉴定结果Table3 Physiological and biochemical characteristics of strain SCT-2
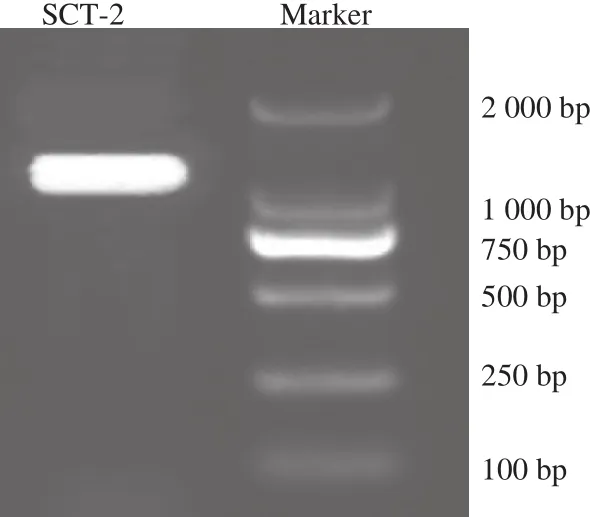
图7 菌株SCT-2的16S rRNA基因扩增电泳图Fig.7 PCR amplif i cation products of 16S rRNA gene from strain SCT-2

图8 菌株SCT-2的16S rRNA系统发育树Fig.8 Phylogenetic tree based on the 16S rRNA sequence of strain SCT-2
图7是菌株SCT-2的16S rRNA基因扩增电泳图,可以看出菌株SCT-2核酸序列在1 400 bp左右出现特异性亮带,表明目标片段被成功扩增,扩增产物送至生工生物工程(上海)股份有限公司测序,将菌株测序结果与NCBI数据库中已知序列进行比对,构建系统发育树,由图8可知,菌株SCT-2与L. plantarum KM577184.1在同一个分支上,置信度为100%,因此菌株SCT-2被鉴定为植物乳杆菌(L. plantarum),该结果与生理生化鉴定结果相同。
3 结 论
本研究从辽宁锦州酸菜中筛选出对嗜水气单胞QS抑制效果较好的乳酸菌菌株SCT-2,应用8 mg/mL菌株SCT-2粗提物对嗜水气单胞菌生物膜的抑制率为45.16%,光学显微镜下观察进一步证明其能够抑制细菌生物膜的形成,扫描电镜分析表明菌株SCT-2粗提物不仅能够降低嗜水气单胞菌生物膜的生成量,而且使其生物膜发生断裂。8 mg/mL的菌株SCT-2粗提物对嗜水气单胞菌蛋白酶和嗜铁素的抑制率分别达到27.18%和22.11%,且对嗜水气单胞菌的群集和泳动现象抑制明显;菌株SCT-2粗提物可通过降解信号分子实现QS抑制作用。经生理生化和16S rRNA鉴定为植物乳杆菌(L. plantarum)。

