α-L-鼠李糖苷酶以催化活性包涵体形式异源表达及其酶学性质
李彬春,张 甜,吉亚茹,李艳琴,丁国斌
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室,山西 太原 030006)
α-L-鼠李糖苷酶(EC. 3.2.1.40)作为一类糖苷水解酶,特异性水解切割天然糖苷产物末端的α-L-鼠李糖基,如黄酮糖苷芦丁、曲克芦丁、柚皮苷、橙皮苷、槲皮苷和地奥司明,人参皂苷Re和Rg2、萜烯糖苷以及其他含有末端α-L-鼠李糖基的天然糖苷化合物[1-2]。α-L-鼠李糖苷酶因其众多生物催化应用已成为一类生物技术重要酶,如柑橘类果汁脱苦味[3-4]、酶法制备异槲皮素[5-8]、由柚子皮或柚皮苷酶法制备樱桃苷[4,9]、酶法改善天然黄酮糖苷的生物利用率[10]与生物学活性[11-13],以及酶法制备人参皂苷Rd[14];此外,可利用α-L-鼠李糖苷酶水解作用的逆反应酶法合成天然α-L-鼠李糖苷[15-16]。
基于氨基酸序列同源性,α-L-鼠李糖苷酶分布于糖苷水解酶(glycoside hydrolase,GH)家族GH28、GH78和GH106(CAZy数据库[17]),其中以GH78家族α-L-鼠李糖苷酶的研究最为透彻,迄今为止,共有26 个GH78家族α-L-鼠李糖苷酶基因被克隆,均来源于微生物,其中18 个来自细菌,主要类属于乳酸细菌,仅4 个晶体结构被解析,结构域组成差异很大,其中来源于Streptomyces avermitilis MA-4680的SaRha78A由6个结构域组成,包括一个催化结构域和一个碳水化合物结合结构域(carbohydrate binding module,CBM)67[18],而来源于Klebsiella oxytoca的KoRha仅包括2个结构域,且无CBM67[19]。GH78家族α-L-鼠李糖苷酶的催化结构域是典型的(α/α)6结构,采用翻转型催化机制,催化残基为广义酸碱对,催化广义酸碱对已通过定点突变[18,20]或复合体结构分析[19]被确定,为谷氨酸与谷氨酸或天冬氨酸与谷氨酸。
利用原核系统表达外源重组蛋白的瓶颈是目的蛋白多以包涵体形式存在,过去一直认为包涵体是错误折叠、无生物活性的蛋白质,需经过变复性过程方可获得可溶性生物活性蛋白[21]。然而,近年来越来越多的研究发现一些酶蛋白在特定条件下可以一种催化活性包涵体的形式表达[22-25],催化活性包涵体具有众多优点,正逐渐引起研究人员的关注,首先,催化活性包涵体表达量大,生产过程简捷且费用低[26];其次,催化活性包涵体代表了一种全新、无载体、无细胞、可降解的固定化策略[27-28],创新性将酶蛋白表达过程与酶固定化过程有机结合起来,直接作为生物催化剂且可多次重复使用;再者,包涵体直径一般为50~500 nm,属于纳微级材料,催化活性包涵体可作为一种纳米生物催化机器。因此,催化活性包涵体作为一种全新的酶异源表达策略,具有很好的工业应用前景。
本研究以土壤细菌解肝磷脂土地杆菌(Pedobacter heparinus)作为研究材料,拟通过基因组挖掘策略利用直接克隆法获得具有新颖酶学特性的全新α-L-鼠李糖苷酶资源,以期应用于天然黄酮糖苷生物转化研究。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和质粒
解肝磷脂土地杆菌购自中国普通微生物菌种保藏管理中心,菌种保藏号1.2820;宿主菌大肠杆菌Trans-1-Blue和BL21(DE3)购自北京全式金生物技术有限公司;载体pET-28a为本实验室保存。
1.1.2 培养基
2×YT培养基:胰蛋白胨16 g,酵母提取物10 g,氯化钠5 g,加蒸馏水至1 L。
1.1.3 试剂
快速限制性内切酶NdeI与XhoI、T4 DNA连接酶与DNA分子质量标准(DL5000 DNA Marker) 宝生物工程(大连)有限公司;DNA聚合酶TransStart®FastPfu Fly DNA Polymerase 北京全式金生物技术有限公司;对硝基苯酚-α-L-吡喃鼠李糖苷(p-nitrophenol-α-L-rhamnopyranoside,PNPR) 美国Sigma公司;基因上下游引物、蛋白质分子质量标准(15~150 kDa双色预染蛋白Marker)以及其他化学试剂 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
ZWY-2102C立式双层全温振荡器、ZXGP-B2050电热恒温箱 上海智城分析仪器制造有限公司;YT-CJ-1ND超净工作台 北京亚泰科隆仪器技术有限公司;PTC-200梯度聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;SCIENTZ-IID超声波细胞破碎仪 宁波新芝生物科技股份有限公司;CR22G台式高速冷冻离心机日本日立公司;UV-5800PC紫外-可见分光光度计
上海元析仪器有限公司;水平电泳槽、垂直电泳槽、电泳仪 上海天能科技有限公司。
1.3 方法
1.3.1 引物设计
根据解肝磷脂土地杆菌的α-L-鼠李糖苷酶基因PhRha78E(Phep2773,GenBank数据库序列号:ACU04972)和PhRha78G(Phep3887,GenBank数据库序列号:ACU06078)核苷酸序列设计特异性上下游引物(表1)。
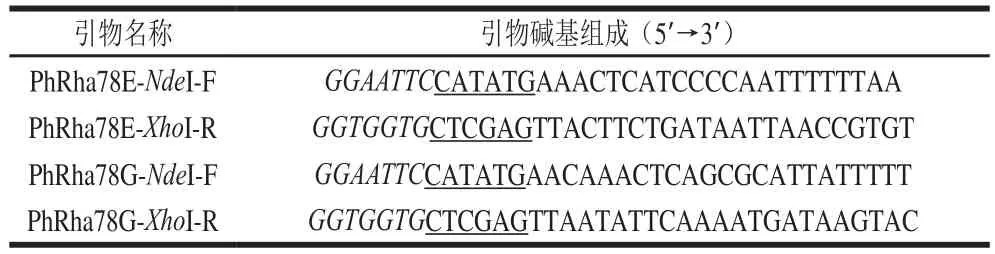
表1 α-L-鼠李糖苷酶基因PCR扩增的上下游引物Table1 Primers used for PCR ampli fi cation of α-L-rhamnosidase genes
1.3.2 α-L-鼠李糖苷酶的基因克隆
以溶于无菌双蒸水的解肝磷脂土地杆菌菌粉作为模板,利用DNA聚合酶TransStart®FastPfu Fly DNA Polymerase进行PCR,PCR扩增条件为:95 ℃预变性5 min;95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,30 个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测扩增出目的基因后,利用Axygen PCR产物清洁试剂盒对目的产物进行回收。
回收的目的基因经NdeI和XhoI双酶切后,与同样经NdeI和XhoI双酶切的载体pET-28a,利用T4 DNA连接酶连接后转化大肠杆菌Trans-1-Blue,菌落PCR鉴定成功连接于pET-28a,菌液送生工生物工程(上海)股份有限公司测序。
1.3.3 α-L-鼠李糖苷酶的异源表达
利用质粒小提试剂盒提取经测序验证基因核苷酸序列正确的重组质粒,转化大肠杆菌BL21(DE3)。种子液培养,挑克隆于5 mL 2×YT培养基中,卡那霉素终质量浓度50 mg/L,37 ℃、200 r/min培养7 h,种子液(体积分数1%)接种于含1 L 2×YT培养基三角瓶中(卡那霉素50 mg/L),37 ℃、200 r/min培养至菌密度OD600nm0.8~1.0时,加入终浓度0.5 mmol/L异丙基-β-D-硫代吡喃半乳糖苷(isopropyl β-D-thiogalactoside,IPTG)后16 ℃、200 r/min诱导表达过夜。次日8 000 r/min、4 ℃离心收集菌体,菌体称质量,菌体经pH 8.0的50 mmol/L NaH2PO4-Na2HPO4缓冲液(1∶12(g/mL))重悬后超声破碎,13 000 r/min、4 ℃离心30 min,沉淀称质量,分别取上清液和沉淀重悬液进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE),检测α-L-鼠李糖苷酶的表达情况。
1.3.4 催化活性包涵体酶液的制备
超声破碎离心后的沉淀经pH 8.0的50 mmol/L NaH2PO4-Na2HPO4缓冲液重悬,4 ℃、12 000 r/min离心10 min,去上清液,沉淀保存于-20 ℃冰箱。使用时,沉淀称质量后利用pH 8.0的50 mmol/L NaH2PO4-Na2HPO4缓冲液重悬至所需蛋白质量浓度的酶溶液即为催化活性包涵体酶液。
1.3.5 α-L-鼠李糖苷酶活力的测定
α-L-鼠李糖苷酶的催化活性通过利用紫外-可见分光光度计检测对硝基苯酚释放量来测定,标准反应体系为500 µL,470 µL 50 mmol/L反应缓冲液中加入10 µL PNPR(10 mmol/L,ddH2O溶解),反应温度下金属浴保温2 min,立即加入20 µL包涵体酶液(PhRha78E 20 mg/mL,PhRha78G 50 mg/mL)反应5 min,之后加入500 µL1 mol/L Na2CO3溶液终止反应,测定405 nm波长下吸光度变化值,酶活力按照文献[29]计算,酶活力定义:在最适反应条件下,每分钟释放1 µmol对硝基苯酚所需酶量为1 个酶活力单位(U)。每个反应做3 个平行。
1.3.6 α-L-鼠李糖苷酶的酶学性质测定
1.3.6.1 最适反应pH值测定
测定α-L-鼠李糖苷酶PhRha78E在50 ℃分别于50 mmol/L柠檬酸钠-柠檬酸缓冲液(pH 3.9~5.8)、NaH2PO4-Na2HPO4缓冲液(pH 6.0~8.0)、Tris-HCl缓冲液(pH 8.0~8.6)、甘氨酸-氢氧化钠缓冲液(pH 8.6~9.0)中的活力;测定α-L-鼠李糖苷酶PhRha78G在40 ℃分别于50 mmol/L柠檬酸钠-柠檬酸缓冲液(pH 4.9~5.7)、NaH2PO4-Na2HPO4缓冲液(pH 6.0~8.0)、Tris-HCl缓冲液(pH 8.0~8.6)、甘氨酸-氢氧化钠缓冲液(pH 8.6~9.0)中的活力。
1.3.6.2 最适反应温度测定
测定α-L-鼠李糖苷酶PhRha78E于50 mmol/L pH 6.5 NaH2PO4-Na2HPO4缓冲液中在20~80 ℃的活力;测定α-L-鼠李糖苷酶PhRha78G于50 mmol/L pH 7.0 NaH2PO4-Na2HPO4缓冲液中在10~60 ℃的活力。
1.3.6.3 酶动力学常数测定
测定α-L-鼠李糖苷酶PhRha78E在60 ℃于50 mmol/L pH 6.5 NaH2PO4-Na2HPO4缓冲液中对不同浓度(0.048~2.4 mmol/L)PNPR的活力,蛋白质量浓度为20 mg/mL,反应时间为1 min;测定α-L-鼠李糖苷酶PhRha78G在40 ℃于50 mmol/L pH 7.0 NaH2PO4-Na2HPO4缓冲液中对不同浓度(0.048~2.4 mmol/L)PNPR的活力,蛋白质量浓度为30 mg/mL,反应时间为1 min。
利用软件GraphPad 6.0基于Michaelis-Menten公式对不同底物浓度及其对应酶活力进行非线性拟合获得米氏常数Vmax与Km,根据公式kcat=Vmax/[E]计算获得转换数kcat,从而计算催化效率kcat/Km。
2 结果与分析
2.1 α-L-鼠李糖苷酶基因的扩增
基因组信息挖掘揭示解肝磷脂土地杆菌的基因组(GenBank序列号:CP001681)[30]含有大量糖苷水解酶基因,其中含有10 个GH78家族α-L-鼠李糖苷酶基因,对其中两个基因Phep2773和Phep3887进行研究,分别命名为PhRha78E和PhRha78G。以解肝磷脂土地杆菌基因组为模板,进行PCR扩增,琼脂糖凝胶电泳显示获得大小分别约为2 200 bp和2 700 bp的单一条带,结果如图1所示,与目的基因大小相符,扩增得到目的基因。

图1 α-L-鼠李糖苷酶基因的PCR扩增结果Fig.1 PCR ampli fi cation of α-L-rhamnosidase genes
2.2 α-L-鼠李糖苷酶基因重组表达质粒的鉴定

图2 α-L-鼠李糖苷酶基因重组质粒构建的菌落PCR鉴定结果Fig.2 PCR ampli fi cation for identi fi cation of α-L-rhamnosidase genes ligated into the vector pET-28a
以转化后的菌斑作为模板,pET-28a通用引物T7和T7-ter为引物,PCR扩增,菌落PCR结果如图2所示,PhRha78E的阳性克隆在大小约2 400 bp处存在单一条带,显示其5 个克隆中3 个为阳性克隆,PhRha78G的阳性克隆在大小约2 900 bp处存在单一条带,显示其5 个克隆中4 个为阳性克隆。分别选择两个阳性克隆送去测序,测序结果显示插入表达载体pET-28a的目的基因核苷酸序列与其理论序列一致,表明重组质粒正确插入了目的基因,成功构建了重组表达质粒pET-28a-PhRha78E和pET-28a-PhRha78G。
2.3 α-L-鼠李糖苷酶以催化活性包涵体形式异源表达
将重组质粒pET-28a-PhRha78E和pET-28a-PhRha78G分别转化大肠杆菌BL21(DE3),获得重组菌株并进行诱导表达,菌体超声波破碎低温高速离心后,取上清液和沉淀样品进行SDS-PAGE分析,图3显示在目的酶理论分子质量大小处(PhRha78E,86 kDa和PhRha78G,103 kDa)存在蛋白条带,二者仅少量以可溶性形式表达于上清液,大部分以包涵体形式存在于沉淀。
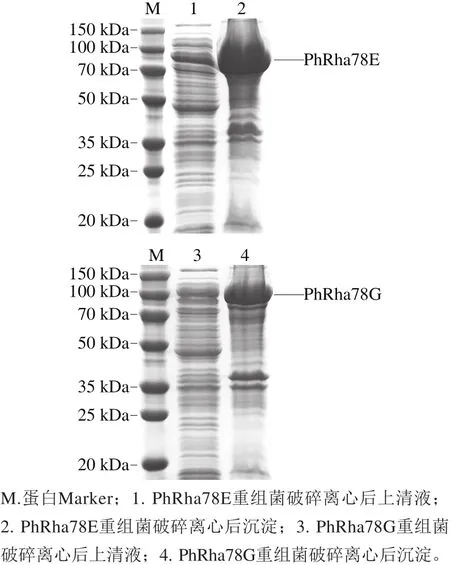
图3 α-L-鼠李糖苷酶重组蛋白质的SDS-PAGE图Fig.3 SDS-PAGE analysis of recombinant proteins of α-L-rhamnosidases
将含有目的酶包涵体的沉淀用pH 8.0的50 mmol/L NaH2PO4-Na2HPO4缓冲液重悬,探测目的酶包涵体能否催化水解底物PNPR,利用紫外-可见分光光度计检测405 nm波长处产物对硝基苯酚的吸光度变化,显示目的酶包涵体可以催化水解PNPR,具有α-L-鼠李糖苷酶活性,表明目的酶PhRha78E和PhRha78G在大肠杆菌中以催化活性包涵体形式表达,每克菌体可分别获得0.42 g和0.39 g含目的酶催化活性包涵体的沉淀(表2)。

表2 α-L-鼠李糖苷酶催化活性包涵体的收率Table2 Production of α-L-rhamnosidases as catalytically active inclusion bodies
2.4 α-L-鼠李糖苷酶催化活性包涵体的酶学性质

图4 pH值对PhRha78E(A)和PhRha78G(B)酶活力的影响Fig.4 Effects of pH on enzymatic activity of PhRha78E (A) and PhRha78G (B)
α-L-鼠李糖苷酶PhRha78E的pH值-酶活力曲线(图4A)显示,最适反应pH值为6.5,在pH 5.4~7.5之间,相对酶活力在78%以上,即使在酸性pH 4.8仍能保持62%酶活力。PhRha78G的pH值-酶活力曲线(图4B)显示其最适反应pH值为7.0,在pH 5.7~8.6之间,相对酶活力在70%以上,即使在碱性pH 9.0依然能有28%酶活力。相同pH值不同反应缓冲体系的酶活力不同,与相同pH值NaH2PO4-Na2HPO4缓冲体系或甘氨酸-氢氧化钠缓冲体系相比,Tris-HCl缓冲体系显著抑制α-L-鼠李糖苷酶PhRha78E和PhRha78G的催化活性。

图5 温度对PhRha78E(A)和PhRha78G(B)酶活力的影响Fig.5 Effects of temperature on enzymatic activity of PhRha78E (A)and PhRha78G (B)
α-L-鼠李糖苷酶PhRha78E的反应温度-酶活力曲线(图5A)显示其最适反应温度为60 ℃,在高温70 ℃仍能保持69%酶活力。然而,PhRha78G的反应温度-酶活力曲线(图5B)显示其最适反应温度却为40 ℃,在低温20 ℃仍然能保持43%酶活力。虽然二者来源于同一菌株,二者催化活性对温度的适应性却差异很大。
酶动力学曲线(图6)显示:PhRha78E和PhRha78G对底物PNPR的最大反应速率Vmax较小,表明催化活性较低,分别为124.3 U/g和70.0 U/g,PhRha78E是PhRha78G的1.8 倍;PhRha78E和PhRha78G的转换数kcat分别为0.18 s-1和0.12 s-1;PhRha78E和PhRha78G的米氏常数Km较小,分别为0.55 mmol/L和0.40 mmol/L;PhRha78E和PhRha78G的催化效率kcat/Km分别为327 L/(mol·s)和300 L/(mol·s)(表3)。
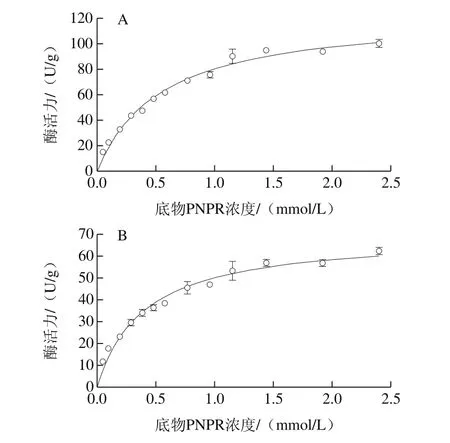
图6 PhRha78E(A)和PhRha78G(B)酶动力学曲线Fig.6 Enzyme kinetic curves of PhRha78E (A) and PhRha78G (B)

表3 α-L-鼠李糖苷酶的酶动力学常数Table3 Enzymatic kinetic parameters of α-L-rhamnosidases
3 讨 论
本研究基于基因组挖掘策略从土壤细菌解肝磷脂土地杆菌基因组中获得两个新型α-L-鼠李糖苷酶基因PhRha78E和PhRha78G,目的酶PhRha78E和PhRha78G仅少量以可溶性形式表达于上清液,大部分以包涵体形式存在于沉淀,并且以包涵体表达的PhRha78E和PhRha78G具有α-L-鼠李糖苷酶催化活性,发现了在大肠杆菌中以催化活性包涵体形式异源表达的α-L-鼠李糖苷酶,目的酶蛋白表达量大,每克菌体可制备约0.4 g含目的酶包涵体的沉淀,生产率高,显著降低了生产成本。
α-L-鼠李糖苷酶PhRha78E和PhRha78G催化活性包涵体的最适pH值分别为6.5和7.0,与已报道细菌源α-L-鼠李糖苷酶相似,处于中性pH值略偏酸性,然而PhRha78E和PhRha78G的活性pH值范围较宽,同时覆盖了酸碱性pH值范围,PhRha78G在碱性pH 8.6仍能保持72%酶活力,这对于黄酮糖苷生物转化非常重要,因为黄酮糖苷易溶于碱性溶液,然而,迄今为止仅有两个细菌源α-L-鼠李糖苷酶的最适pH值为碱性。Tris-HCl缓冲液显著抑制了PhRha78E和PhRha78G的催化活性,与来源于多形拟杆菌的α-L-鼠李糖苷酶BtRha78D和BtRha78E性质一致[29],这可能是由于Tris的分子结构与α-L-鼠李糖相似,Tris分子含有3 个羟基和1 个氨基,从而可以与α-L-鼠李糖苷酶的催化中心形成氢键。PhRha78E和PhRha78G的最适温度分别为60 ℃和40 ℃,高于原始菌的最适生长温度,尤其是PhRha78E,70 ℃条件下仍能保持69%酶活力,与已报道细菌源α-L-鼠李糖苷酶相似,较高的反应温度对于黄酮糖苷生物转化亦重要,因为高温有助于黄酮化合物溶解。本研究发现的两个新型α-L-鼠李糖苷酶虽来源于同一菌株,酶学性质却差异较大,可应用于不同的生物催化领域,并且丰富了现有α-L-鼠李糖苷酶资源库。

