赭曲霉毒素A脱毒菌株的筛选与鉴定
胡海宁,袁国强,何鸿建,梁志宏*
(中国农业大学 北京食品营养与人类健康高精尖创新中心,食品科学与营养工程学院,北京 100083)
据美国食品药品监督管理局统计,每年全球约有25%的食品被真菌毒素污染,年损失量约10亿 t[1]。赭曲霉毒素A(ochratoxin A,OTA)是青霉属(Aspergillus sp.)和曲霉属(Penicillium sp.)真菌产生的一种真菌毒素,广泛分布于各类农产品,如谷物、葡萄、咖啡豆、可可豆、坚果、香料和肉制品等[2]。在已发现的300多种真菌毒素中,OTA毒性仅次于黄曲霉毒素B1。已有研究表明,OTA对人和动物具有肾毒性、肝毒性、基因毒性、致突变性、致畸性和胚胎毒性等,并被国际癌症研究机构确定为II B类致癌物[3]。为防治OTA,最佳措施是在作物收获前后抑制真菌的生长繁殖和OTA的产生,但OTA的污染无法完全避免。生物脱毒方法能够利用微生物或酶类的代谢活动或吸附作用将食品或饲料中残留的真菌毒素含量降低至限量标准以下[4]。相较于物理脱毒和化学脱毒,生物脱毒具有专一性强、环境友好、效率高和较好地保持食品或饲料营养等优势。近年来,生物脱毒的基础研究发展迅速,已有大量利用微生物脱除OTA的报道,包括丝状真菌[5-6]、酵母菌[7-8]和细菌[9-10]等。
微生物主要通过两种方式,即吸附作用和代谢活动,来脱除OTA。前者主要依靠微生物细胞壁对OTA的吸附作用,常见于酵母菌和乳酸菌[11-12]。而后者主要是依赖某些酶类将OTA转化为其他物质。OTA的化学结构是一分子异香豆素部分(ochratoxin α,OTα)与一分子L-β-苯丙氨酸通过肽键连接。肽键的水解、内酯环打开和羟基化是OTA主要的转化途径。OTα是肽键水解的产物,已有研究表明OTα对动物基本无毒,且在动物体内的半衰期是OTA的十分之一[13]。OTA转化为OTα的降解路径在自然界的生物体内广泛分布,是动植物脱除OTA毒性的主要方式[14]。而内酯环打开和羟基化反应相对较少见,且脱毒产物的毒性并没有被阐明。
用于脱毒的微生物常以添加剂的形式加入到食品或动物饲料中,人和动物的胃肠道是其发挥脱毒作用的主要环境之一,因此脱毒微生物必须能耐受肠道环境并能在该环境下保持脱毒活性。肠道微生物在该方面具有先天优势,其对肠道环境具有良好的适应性,对肠道的潜在危害性较低,并且含有大量的有益菌,能够为筛选适用于食品或饲料中的OTA脱毒菌株提供丰富资源。本实验为定向筛选脱除OTA的菌株,先以添加一定量OTA的饲料饲喂小鼠,以收集的粪便为研究材料,再通过添加一定质量浓度OTA的LB固体培养基逐步筛选,然后利用LB液体培养基进行二次筛选,并以高效液相色谱(high performance liquid chromatography,HPLC)法评价菌株体外脱除OTA的能力,最后通过培养条件优化,以期筛选出能够高效脱除OTA的菌株。
1 材料与方法
1.1 材料与试剂
OTA(纯度98%) 美国Sigma-Aldrich公司;BALB/c小鼠 北京维通利华实验动物技术有限公司。
1.2 仪器与设备
2690/2695型HPLC仪 美国Waters公司;DM2500光学显微镜 德国Leica公司;细菌DNA提取试剂盒天根生化科技(北京)有限公司;ALD/1244 PCR仪美国Bio-Rad公司;3001酶标仪 芬兰Thermo Fisher Scientif i c公司。
1.3 方法
1.3.1 菌株的初筛
以1 kg体质量添加210 μg OTA[15]的饲料饲喂BALB/c小鼠90 d后,收集粪便,用无菌生理盐水将粪便稀释至10-1和10-2。初筛培养基采用双层斜面平板结构,如图1所示,将12 mL LB固体培养基倾注于平板底层形成一定角度的斜面,另将添加5 μg/L OTA的12 mL LB固体培养基倾注于平板上层。将粪便稀释液均匀涂布在培养基上层,37 ℃培养箱中避光培养72 h。
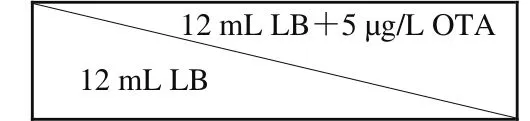
图1 初筛培养基的双层斜面平板结构Fig.1 Double-deck slant medium for primary screening
将初筛培养基上生长的菌株转接于10 mL含5 μg/L OTA的新鲜的LB固体培养基上37 ℃避光培养24 h,再将生长的菌株继续转接于新鲜的LB固体培养基上,并将培养基中OTA质量浓度依次提高至6 μg/L和10 μg/L。
1.3.2 菌株的复筛
选取在含10 μg/L OTA的LB固体培养基上生长的菌株,接种于10 mL的LB液体培养基中。在200 r/min、37 ℃条件下,摇床过夜培养20 h。取0.5 mL发酵液于1 mL的离心管中,添加一定量的OTA使其终质量浓度为25 μg/mL。以0.5 mL的LB液体培养基添加25 μg/mL的OTA作为对照组。将样品和对照组于37 ℃、200 r/min的条件下,避光培养24 h。利用HPLC法测定OTA的剩余量。所有实验重复3 次。
1.3.3 OTA的提取与定量
先用1 mol/L盐酸将样品的pH值调为2~3,再加入0.5 mL三氯甲烷,振荡混匀后,4 ℃、6 000×g离心10 min,取三氯甲烷层,重复萃取2 次,将萃取液充分混合后用氮气吹干,用1 mL无水甲醇复溶,经0.22 μm的有机系微孔滤膜过滤后,用HPLC仪测定OTA的含量[16]。
HPLC系统所使用的色谱柱为C18Spherisorb S5 ODS2柱(4.6 mm×150 mm,5 μm),配有荧光探测器;激发波长和发射波长分别为333 nm和467 nm;流动相选择乙腈-水-乙酸(99∶99∶2,V/V);流速为1 mL/min;检出限为0.02 ng;上样量为20 μL。OTA脱除率的计算公式如下:

1.3.4 菌株的鉴定
1.3.4.1 形态鉴定
将菌株接种于LB固体培养基平板上,37 ℃培养24 h后观察菌落形态,并经简单染色法和革兰氏染色法,在显微镜下观察。
1.3.4.2 16S rDNA鉴定
使用细菌DNA提取试剂盒提取菌株基因组DNA。以基因组DNA为模板,以8f/1492R[17]为引物,进行PCR扩增。PCR体系为30 μL,向离心管中依次加入3 μL 10×buffer,2.4 μL dNTPs,1.5 μL上游引物,1.5 μL下游引物,1 μL DNA模板,0.3 μL Taq酶,然后用无菌水补充至30 μL,稍加混合后立即进行PCR。PCR程序:95 ℃预变性5 min;进入循环:95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共30 个循环;最后72 ℃保温7 min。取10 μL扩增产物进行2.0%琼脂糖凝胶电泳,凝胶成像系统中观察PCR产物片段大小。PCR产物由北京擎科新业生物技术有限公司测序,测序结果在美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI)中使用BLAST程序比对,并利用MEGA 6.0软件通过邻接法(Neighbour-Joining)构建系统发育树。
1.3.5 菌株生长条件的优化
以菌液的OD600nm值作为评价指标,通过单因素优化法,确定菌株生长的最适pH值、最适温度和最适摇床速率。所有实验重复3 次。菌株经生长条件优化后,测试体外OTA脱毒能力,方法同1.3.2节及1.3.3节。
1.3.5.1 最适生长pH值的确定
将菌株接种于LB液体培养基37 ℃、200 r/min摇床培养16~18 h作为种子液,取3 mL种子液接种于50 mL的LB液体培养基,用1 mol/L氢氧化钠溶液和1 mol/L盐酸将pH值分别调至5.50、6.50、7.00、7.50和8.00。将培养基置于37 ℃、200 r/min摇床中培养22~24 h。利用酶标仪测定菌液的OD600nm值。
1.3.5.2 最适生长温度的确定
将新鲜的种子液接种于LB液体培养基,调节至1.3.5.1节确定的最适生长pH值,分别置于28、37、44 ℃的摇床,200 r/min培养22~24 h,其他条件同1.3.5.1节。测定菌液OD600nm值。
1.3.5.3 最适生长摇床速率的确定
将新鲜的种子液接种于LB液体培养基,调节至1.3.5.1节确定的最适生长pH值,并将培养基置于1.3.5.2节确定的最适生长温度下,分别以150、200、230 r/min摇床培养22~24 h,其他条件同1.3.5.1节。测定菌液OD600nm值。
1.4 数据处理
结果表示为±s(n=3),使用Prism 5.0软件进行单因素方差分析(one-way analysis of variance,ANOVA),并利用多重比较检验(Bonferroni’s multiple comparison test)进行显著性差别分析(P<0.05)。
2 结果与分析
2.1 菌株的初筛
小鼠肠道正常菌群受到多种因素的影响,包括小鼠品种、年龄、饲养环境、饲料、个体差异和性别差异等因素。尹业师等[18]对影响小鼠肠道菌群的多种因素进行比较,发现小鼠在出生28 d后饲料和饲养环境是影响肠道菌群的主要因素,饲料的不同会导致肠道菌群有一定的波动,严重会造成菌群失调。
本实验以1 kg体质量添加210 μg OTA的饲料饲喂小鼠,研究已表明该剂量的OTA对小鼠健康的影响较小[15]。但在OTA的胁迫作用下部分肠道菌可能会发生变异,其中可能产生能够脱毒的菌株。此外,肠道菌群中本身也可能存在脱除OTA的菌株。不同于其他报道的筛菌方法,本实验的初筛培养基采用双层斜面平板结构,OTA质量浓度从一侧到另一侧梯度升高,该法能够观察到OTA质量浓度对菌株生长的影响,结果发现菌株的生长随OTA质量浓度梯度同样呈梯度变化,高质量浓度区菌落数目明显偏少。某些菌株虽然能够耐受OTA,但在含OTA的培养基上生长繁殖会受到抑制,培养基中OTA的质量浓度越高,抑制作用越明显,但如果某些菌株能够利用OTA作为碳源,其在含OTA的培养基上生长繁殖一般不会受到限制。初筛培养基后,再利用含一定质量浓度OTA的LB固体培养基多次筛选,培养基中OTA质量浓度依次提高,本实验经筛选共获得12 株在OTA质量浓度达到10 μg/L的培养基上依然能够大量生长繁殖的菌株,依次编号为YH1~YH12,这些菌株极有可能具备脱除OTA的能力。
2.2 菌株的复筛
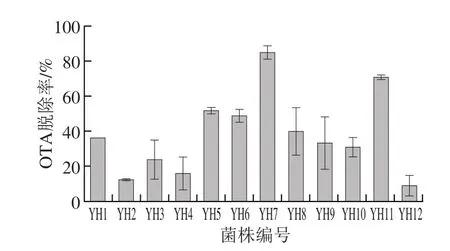
图2 12 株初筛菌的OTA脱除率Fig.2 OTA detoxif i cation rates of 12 strains
以12 株初筛菌株体外脱除OTA,并以HPLC法检测OTA的残余量。如图2所示,12 株菌均具有不同程度的OTA脱除效率,该结果证明本实验采用的全新筛菌方法能够从动物肠道中筛选出OTA脱毒菌株。菌株YH7的OTA脱除率显著高于其他菌株,表明在该12 株菌中YH7的脱毒能力最强,OTA脱除率达84.6%(图3)。菌株YH7被选取进行下一步的形态鉴定和16S rDNA鉴定。
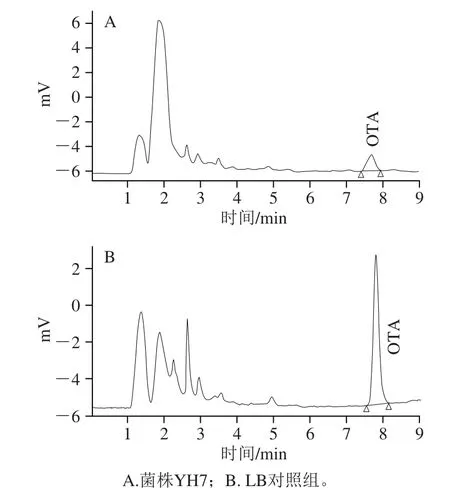
图3 菌株YH7的HPLC图Fig.3 HPLC chromatogram of strain YH7
2.3 菌株的鉴定
2.3.1 菌株的形态鉴定
菌株YH7的菌落形态为黄色,有光泽,菌落边缘整齐,表面湿润光滑,显微镜下细胞形态为细小短杆状,革兰氏染色呈阴性。
2.3.2 16S rDNA鉴定
在NCBI上使用BLAST进行16S rDNA序列比对,结果显示菌株YH7序列与Escherichia coli O83:H1 NRG857C具有99%的序列同源性。结合如图4所示的系统发育树分析,可确定菌株YH7属于大肠杆菌(E. coli)。
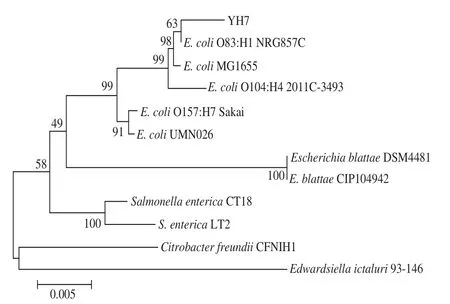
图4 菌株YH7的系统发育树Fig.4 Phylogenetic tree of strain YH7
2.4 菌株生长条件的优化
从图5A可以看出,OD600nm值在pH 7.5左右达到最大,表明菌株YH7在中性和弱碱性条件下生长良好,该结果与预期相符;图5B显示OD600nm值在37 ℃处最大,表明菌株YH7更适合在37 ℃生长;从图5C可看出,OD600nm值随摇床速率的增加而增加,在摇床速率超过200 r/min时,OD600nm值不再显著性变化,因此,菌株YH7的最适摇床速率确定为200 r/min左右。
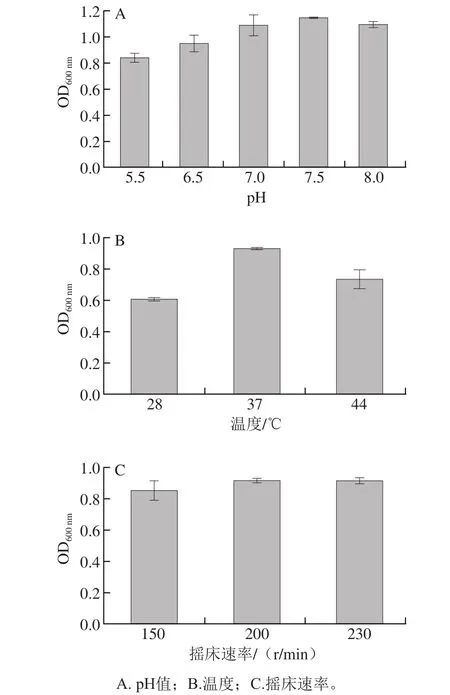
图5 不同培养条件下YH7菌液的OD600 nm值Fig.5 OD600 values of YH7 cultures under different conditions
菌株YH7是从小鼠粪便中分离出来的肠道菌。本实验通过优化得到的菌株YH7最适生长条件与肠道的环境条件非常接近,符合其作为肠道菌的特性。菌株YH7经过生长条件优化后,体外脱除OTA的能力得到显著提高,脱除率达90.6%。
3 讨 论
肠道微生物不仅对肠道环境具有良好的适应性,对动物肠道的潜在危害性较低,并且其中通常含有大量的益生菌。益生菌主要包括芽孢杆菌属(Bacillus)、乳杆菌属(Lactobacillus)、链球菌属(Streptococcus)、肠球菌属(Enterococcus)的一些菌种和一些酵母菌(Saccharomyces)[19]。由于益生菌被普遍认为是安全的,在作为脱毒产品被相关管理部门如欧洲食品安全局批准进入市场前,无须经历严格而繁琐的安全评价程序以证明其对人和动物的基本无害性[20]。除此之外,益生菌能够分泌抗真菌物质、转化真菌毒素或真菌毒素的受体、增强动物胃肠道对病原体的免疫应答等[21-22]。因此,益生菌在食品或饲料脱毒领域中的应用具备先天优势。而动物肠道也成为脱毒微生物的理想来源。
目前已经有一些涉及肠道微生物脱除OTA的报道。相对于单胃动物,反刍动物对包括OTA在内的真菌毒素的抵抗力普遍较强[23],原因被认为是反刍动物瘤胃中存在具有较高OTA降解能力的细菌,一些原生动物似乎也参与到OTA的降解中[24-25]。据报道,一种来源于瘤胃的溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)能够脱除一定量的OTA[26]。除了反刍动物,人类、猪和小鼠的肠道内也均发现具有OTA降解活性的微生物。Camel等[27]利用人肠道微生物在体外降解OTA,72 h后降解率最高达47%。一种厌氧菌被Upadhayaa等[28]从猪肠道内分离,在体外固体发酵培养基上,该菌在24 h后完全降解OTA。据Madhyastha等[29]的报道,鼠肠道微生物能够将OTA水解为基本无毒的OTα,且大肠和盲肠是OTA水解的主要场所。虽然肠道微生物用于OTA脱毒的研究取得了一定的进展,但绝大多数报道未涉及脱毒微生物分离和鉴定。
本实验从饲喂OTA的小鼠粪便中分离筛选出一株可以高效脱除OTA的革兰氏阴性菌株YH7,经鉴定确定为一种大肠杆菌,其脱毒能力达到了84.6%,并在pH 7.5、37 ℃、200 r/min摇床速率的培养条件下生长良好。该菌株对OTA的脱毒作用值得进一步研究,例如脱毒产物需要进行安全性评价,脱毒机理还需进一步阐明,以便该菌株能够作为OTA脱毒产品应用于食品或饲料工业。
发展中国家的粮食安全形势较发达国家更加严峻,脱毒技术必须紧跟人们对粮食安全日益增长的需求。生物脱毒技术凭借专一性强、环境友好、效率高和较好地保持食品或饲料营养等优势,迅速成为研究热点。然而,目前对生物脱毒的研究存在诸多难题,主要有以下几点:1)高效稳定的脱毒菌株匮乏;2)菌株的脱毒机理尚不清晰,脱毒相关基因和活性成分有待进一步鉴定;3)对于菌株脱毒产物的安全性需要进一步评价;4)菌株脱毒条件的控制技术不够成熟,离大规模生产应用还很遥远。随着研究的逐步深入,生物脱毒的理论基础将进一步完善,脱毒技术也将进一步发展。相较于其他微生物中,肠道微生物在生物脱毒领域具有先天优势,包括对动物肠道具有更优良的适应性、更低的潜在危害性和可能的益生功能,更加有利于食品或饲料工业中的应用和商业推广,具有更加广阔的发展前景。

