体温高峰与重症监护室内脓毒症患者预后的相关性
毛小强,楼炳恒,崔益明
(衢州市人民医院 急诊科,浙江 衢州 324000)
脓毒症在全球的发病率和病死率均很高[1],目前仍然是ICU患者死亡的主要原因之一。它是由感染引起的全身性炎症反应综合征。发热是脓毒症患者的常见表现之一。有研究认为,体温升高可以减少脓毒症患者的病死率[2]。但也有研究认为,脓毒症的发生与体温之间无明显相关性[3]。因此,到目前为止,临床结果存在分歧。本研究通过观察体温高峰与脓毒症患者预后的关系,探讨体温升高是否会增加脓毒症患者的病死率。
1 对象和方法
1.1 对象 选择2013年1月至2017年5月在衢州市人民医院重症监护室住院的脓毒症患者,住院时间>48 h,共176例;脓毒症患者的诊断参考文献[1]的诊断标准。排除标准:心跳呼吸骤停者;中枢神经系统感染者;蛛网膜下腔出血、颅内出血、肿瘤或脑卒中患者。剔除自动出院或放弃治疗者、数据缺失或不完整者。根据患者入ICU后24 h内体温最高峰值(MAXICU)将患者分为4组,分别为:≤37.4 ℃组、37.5~38.4 ℃组、38.5~39.4 ℃组、≥39.5 ℃组。本研究经衢州市人民医院伦理委员会批准。
1.2 数据收集 统计患者的年龄、性别、急性生理与慢性健康(acute physiology and chronic health evaluation,APACHE II)评分、各种并发症、是否低血压[平均动脉压<65 mmHg(1 mmHg=0.133 kPa)]、急诊室的干预措施(包括静脉扩容量,是否使用血管加压药物,是否深静脉置入,是否输注各种血制品)、实验室检查[包括肌酐(serum creatinine,SCr)、总胆红素(total bilirubin,TBIL)、血小板(blood plate-let,PLT)、国际标准化比值(international normalized ratio,INR)、白蛋白值]、最初的动脉血气(包括pH、PaCO2、PaO2、PaO2/FiO2)、MAXICU、入ICU后的存活天数。
1.3 统计学处理方法 采用SPSS19.0软件进行统计分析。4组计量资料若呈正态分布用±s表示,组间比较采用单因素方差分析,若呈非正态用M(P25,P75)表示,组间比较采用秩和检验;计数资料采用百分率表示,采用Pearson χ2检验。使用Kaplan-Meier法分析体温对脓毒症患者28 d生存率的影响,log-rank检验组间差异;应用Cox比例风险模型分析28 d病死的相关危险因素。P<0.05为差异有统计学意义。
2 结果
2.1 不同体温组患者基本临床资料比较 共纳入182例患者,剔除资料不完整者6例,最终纳入脓毒症组176例,男104例,女72例,年龄35~91岁,平均(71±14)岁。4组间性别、INR、PaCO2差异有统计学意义(P<0.05),而年龄、APACHE II评分、低血压并发症、急诊室的干预措施、输注血制品、实验室检查、最初动脉血气差异无统计学意义(P>0.05)。见表1。
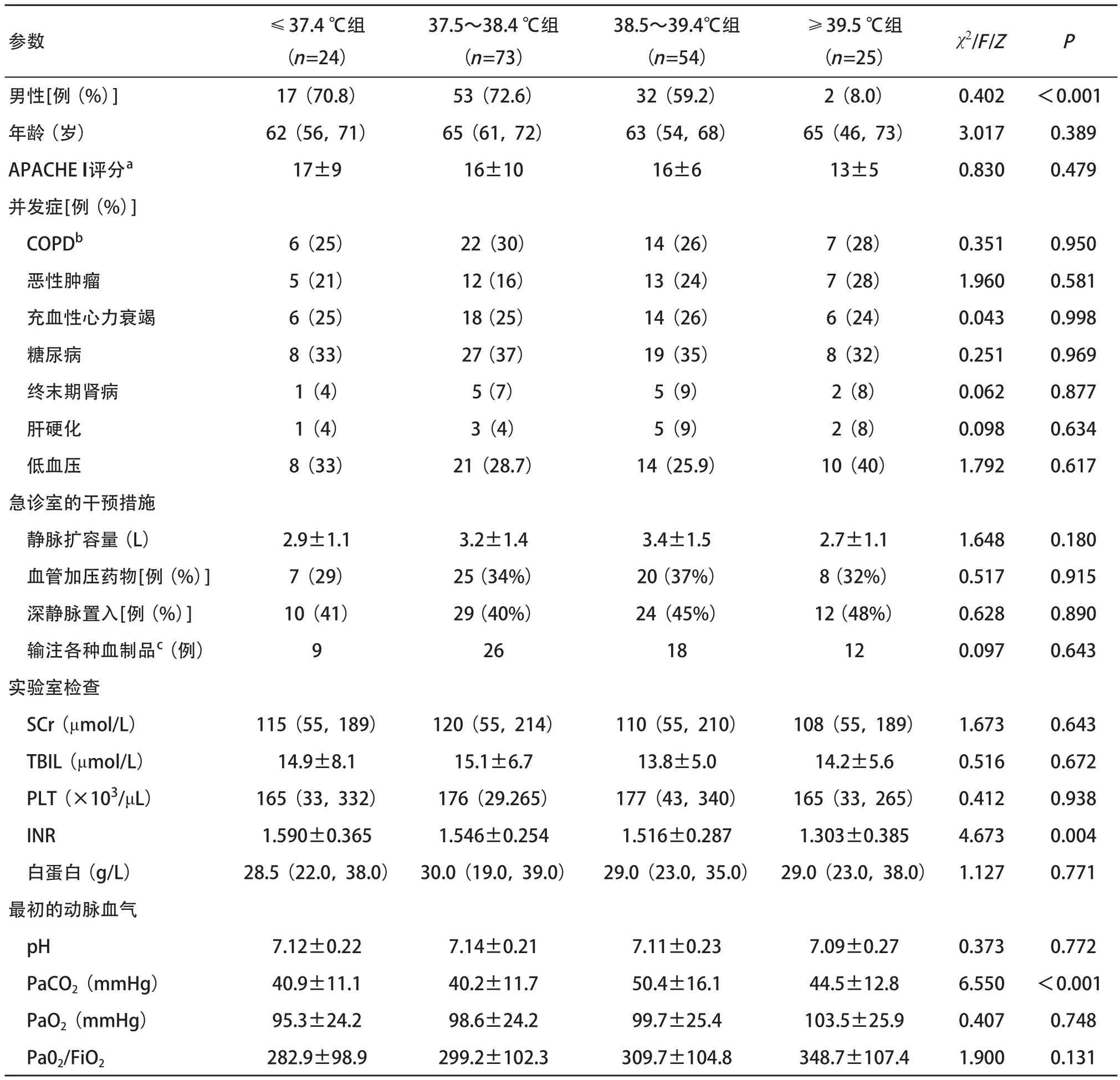
表1 脓毒症患者不同温度分组临床资料比较
2.2 不同体温水平的脓毒症患者入ICU后28 d内病死率比较 4组患者总的28 d病死例数为80例,病死率为45.4%。≤37.4 ℃组、37.5~38.4 ℃组、38.5~39.4 ℃组、≥39.5 ℃组中位生存时间分别为28、13、28、28 d,其病死例数分别为16、39、17、8例。Kaplan-Meier生存曲线分析显示,各体温组患者入ICU后28 d内病死率之间的差异具有统计学意义(log-rank χ2=16.377,P=0.001),见图1。log-rank法进行两两比较,38.5~39.4 ℃组与37.5~38.4 ℃组的生存分布差异具有统计学意义(P<0.001);≥39.5 ℃组与37.5~38.4 ℃组的生存分布差异同样具有统计学意义(P=0.013),其他各组间差异无统计学意义(P>0.05)。
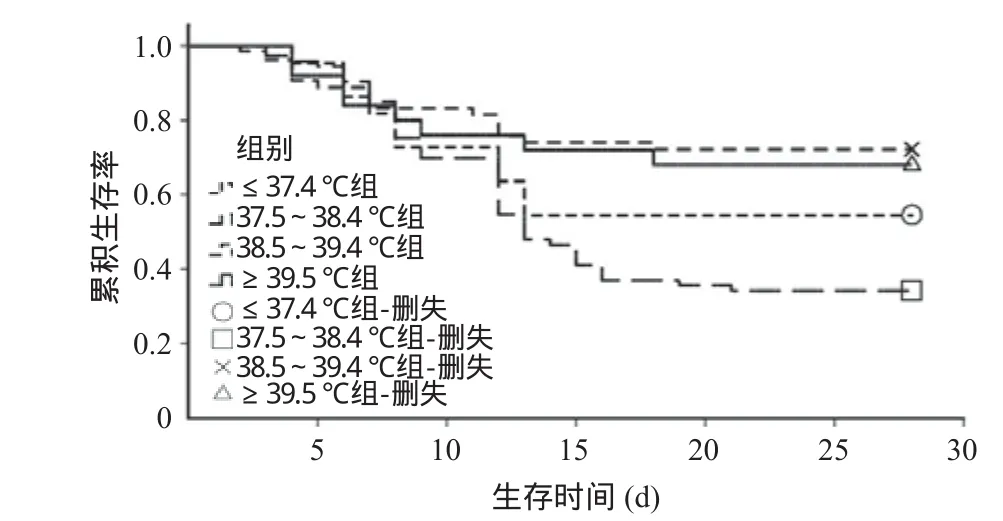
图1 各体温组脓毒症患者28 d累积生存率比较
2.3 Cox比例风险模型分析 以患者入ICU后最高体温(分为37.5~38.4 ℃组、≤37.4 ℃组、38.5~39.4 ℃组、≥39.5 ℃组)、APACHE II评分(按连续变量)、是否使用血制品(0=未使用,1=使用)、INR(按连续变量)、PaCO2(按连续变量),年龄(按连续变量),性别(0=女性,1=男性)为自变量,以患者入ICU后28 d病死为因变量(0=存活,1=死亡)作单因素和多因素Cox回归分析。
单因素Cox回归分析显示,入ICU后最大体温(HR=0.722,95%CI=0.562~0.927,P=0.011),APACHE II评分(HR=1.057,95%CI=1.031~1.084,P<0.001),使用血制品(HR=1.650,95%CI=1.061~2.566,P=0.026),INR水平(HR=2.179,95%CI=1.054~4.509,P=0.036),PaCO2水平(HR=0.978,95%CI=0.961~0.995,P=0.01)是脓毒症患者入ICU后28 d内病死的危险因素。
将单因素Cox回归分析中差异有统计学意义的指标及性别、年龄作为校正因素进行多因素Cox回归分析,结果显示体温仍是影响患者入ICU后28 d内病死的独立危险因素(P=0.045),见表2。
2.4 哑变量回归分析 为进一步对入ICU后最大体温进行多分类哑变量检验,我们以37.5~38.4 ℃组为参照组(哑变量),发现MAXICU=38.5~39.4 ℃是脓毒症患者入ICU后28 d内病死风险的保护因素(38.5~39.4 ℃组患者病死风险是参照组的41.2%;而MAXICU=36.5~37.4 ℃、MAXICU≥39.5 ℃与患者入ICU后28 d内病死风险之间无相关性),见表2。
3 讨论
本研究探讨了体温高峰和脓毒症患者病死率之间的关系。结果发现,MAXICU=38.5~39.4 ℃是脓毒症患者入ICU后28 d内病死风险的保护因素,MAXICU=38.5~39.4 ℃可能能够减少ICU内脓毒症患者的病死率。
我们认为,体温升高是脓毒症患者病死风险的保护因素。理由如下:发热可以提高内毒素效应,与免疫应答相关的细胞因子增加,有利于抵御外来细菌感染,因此,体温升高是一种有益的生理应答;另外一种可能是,重症感染的患者出现体温下降可能是使用了退热剂或者物理降温所致,掩盖了实际上的重症感染,因此,病死的风险增加,很多学者[4-6]也提出:退热剂能够增加患者病死风险;还有一类说法[6-8],发热可直接抑制入侵体内的致命细菌、病毒,减少流行性感冒、脑膜炎、大叶性肺炎的发生。而且,生理范围内的发热还能够增加体内抗生素的活性。因此,适度发热可以增强人体免疫功能,有助于清除外来致病微生物,对机体具有保护作用。2017年SUNDÉN-CULLBERG等[9]采用前瞻性队列研究,观察瑞典30个ICU内2 225例严重脓毒症、脓毒症休克患者的临床资料,特别是患者的病死率,发现超过50%的病死患者,体温均低于38.3 ℃,病死率和体温之间呈负相关;然而,体温升高,ICU住院时间也缩短,存活率也越高。研究者分析,按常理,高热的患者表现出的症状更重,能够得到医护人员更及时、更高质量的治疗,这是否能够解释高热与病死率下降之间的关联?多因素回归分析证实,在所有的风险因素中,体温是预测脓毒症患者死亡风险的最好指标,治疗水平、病情的严重程度等混淆因素都不及体温能够预测患者病死的风险[10]。有研究[11]指出,“脓毒症严重程度评分”可以预测患者病死的风险,其中一项提到,当体温>38.3 ℃的时候,病死风险下降;当患者体温<36 ℃的时候,病死风险增加。有两项单中心研究也认为[12],患者体温超过38.3 ℃,脓毒性休克患者病死的风险会增加,但是,此项研究例数较少,未做细节分析。然而,也有相反的结论,2015年SCHORTGEN等[13]
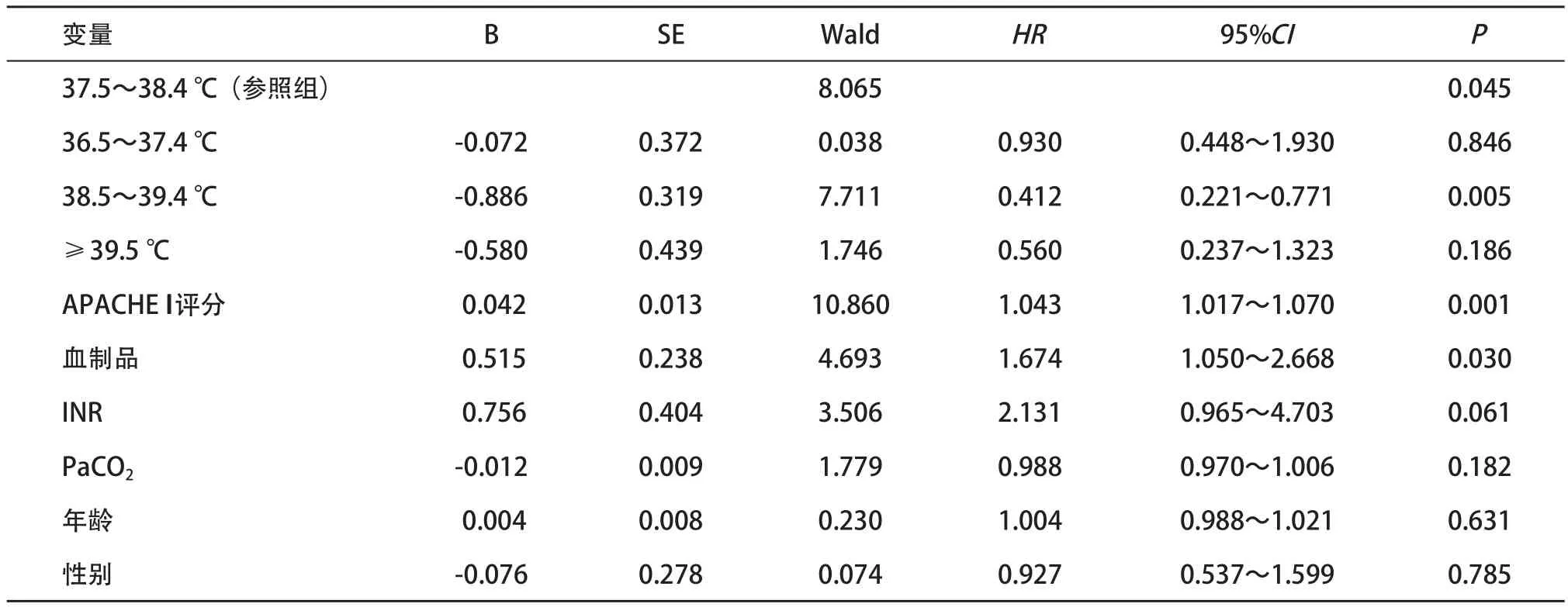
表2 脓毒症患者入ICU后28 d内病死的多元Cox回归分析
为探讨降低体温、心率对脓毒症患者病死率的影响,对随机对照的200例患者进行回顾性分析,同样发现降低体温到<38.4 ℃的时间越长,脓毒症患者的病死率就越低(OR=0.17,95%CI=0.06~0.49,
P=0.001)。甚至有研究未发现脓毒症患者体温与病死率之间的任何关联。然而,这些研究有他们的局限性。例如,体温的记录数量不够;未评估发热的最高值、持续时间,原发、继发感染的严重程度、控制情况,这会影响体温的高低和持续时间,最终影响患者的预后。综上分析,我们认为:目前,临床结果不一,存在分歧,但大样本前瞻性的研究均认为体温升高,脓毒症患者病死率下降,与本研究结论相一致,未来仍需大样本研究证实两者之间的相关性。本研究也存在一定的缺陷,本研究为回顾性研究,无标准化模式去衡量体温和病死率之间的因果关系;因为样本量小,仍未探讨低体温(<36.5 ℃)与病死率的相关性。因此,我们只能提出“高热能够降低脓毒症患者病死率”的假说,仍需随机对照研究去证实体温与脓毒症28 d病死率的因果关系。

