蓝靛果花色苷对高脂血症大鼠肝脏LDLR、ABCG1及ABCA1基因表达的影响
于 伟,张桂芳,宋雪建,甄井龙,迟晓星,王振宇
(1.东北林业大学林学院,黑龙江 哈尔滨 150040;2.黑龙江八一农垦大学 国家杂粮工程技术研究中心,黑龙江 大庆 163319;3.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319;4.哈尔滨工业大学食品科学与工程系,黑龙江 哈尔滨 150001)
蓝靛果花色苷是一种来源极为广泛的功能性天然食用色素,20世纪80年代后,基于生物类黄酮化学结构的明确,人们从分子水平上对花色苷类化合物的性质有了深刻的理解[1]。Tsuda等[2]用亚油酸自动氧化系统、脂质体系统、兔血红细胞膜系统和鼠肝粗粒体系统对矢车菊色素葡萄糖苷和矢车菊色素的抗氧化活性进行实验,发现其具有很强的抗氧化活性,从而认识到花色苷类化合物的性质和应用都根源于其独特的化学结构。花色苷的酚羟基结构对活性氧等自由基有很强的捕捉能力[2-8]。花色苷类化合物通过清除自由基能对自由基诱发的生物大分子损伤起到保护作用,维持细胞膜的流动性和蛋白质的构型构象,具有明显的抑制高血脂、预防心血管病效果[9-11]。从葡萄中提取的花色苷可以有效地降低胆固醇和低密脂蛋白的水平,预防血栓形成,有助于预防心脑血管疾病的发生[12]。国内外研究发现花色苷还可降低人体总胆固醇(total cholesterol,TC)含量(13%~26%),降低低密度脂蛋白胆固醇含量(low density lipoprotein cholesterol,LDL-C)(21%~33%)[13],降低肝脏中甘油三酯(triglyceride,TG)含量[14]。
本课题组在前期的研究中通过液相色谱-二级质谱检测方法对蓝靛果花色苷具体组成成分进行分析,发现蓝靛果花色苷发挥降脂作用的有效成分可能为矢车菊-3-葡萄糖苷,并进行了体内降脂实验,发现其能有效降低高脂血症大鼠体内LDL水平。目前对于蓝靛果花色苷抗氧化及降血脂的分子机制尚不明确,以往对天然产物抑制胆固醇合成机制的研究,只考虑是否对合成的第一步或者限速酶(如HMGCoA还原酶)有抑制作用,很少考虑对胆固醇逆转录作用过程中相关因子的作用。那么,蓝靛果花色苷降低血脂水平的主要途径到底是什么?其作用机理又是如何呢?基于以上问题,本实验主要通过体内实验,利用Western blot和实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,RT-PCR)研究蓝靛果花色苷对高脂血症大鼠肝脏组织中低密度脂蛋白受体(low density lipoprotein receptor,LDLR)及胆固醇逆转运途径中三磷酸腺苷结合盒转运体(ATP-binding cassette transporter,ABCG)基因表达的影响。从基因表达水平上探索蓝靛果花色苷对胆固醇逆转运过程中一些重要因子(LDLR、ABCG1及ABCA1)的调控作用,从而阐明蓝靛果花色苷降血脂的分子机制。
1 材料与方法
1.1 动物、材料与试剂
Wistar大鼠由哈尔滨医科大学实验动物学部提供,许可证编号:SYXK(黑)2011-007。高脂饲料:78.8%(质量分数,下同)普通饲料、10.0%猪油、10.0%蛋黄粉、0.2%胆酸钠、1.0%胆固醇。
蓝靛果花色苷为本实验室提取。
EZNA FFPE RNA Kit 美国Bio-Tek公司;DEPC处理水 上海信帆生物有限公司;SYBR Green PCR试剂盒、逆转录试剂盒、培养基、血清、双抗、胰酶 美国Thermo公司;异丙醇、无水乙醇、氯仿 国药集团药业股份有限公司。
1.2 仪器与设备
7300 Real-time PCR仪 美国ABI公司;TG-16M低温冷冻离心机 上海卢湘仪离心机仪器有限公司;移液枪 法国吉尔森公司;K30旋涡振荡器 上海青浦沪西仪器厂;PRO200电动匀浆机 德国FLUKO公司;Q-TOF 6530质谱仪 美国安捷伦公司。
1.3 方法
1.3.1 动物模型及分组
参考李迪[15]和熊霜[16]等的实验方法,选择2 月龄雄性Wistar大鼠60 只,按体质量随机分成6 组,每组10 只。其中基础饲料对照组,给予普通饲料;其余50 只SD大鼠给予高脂饲料,同时每天添加辅食油渣50 g,自由饮食饮水,每10 d称一次体质量。30 d后,断尾取血,测血清TC、TG浓度。30 d造模后,实验性高脂血症组大鼠TG浓度((3.476±1.37)mmol/L)显著高于正常组TG浓度((1.936±0.532)mmol/L)(P<0.01);实验性高脂血症组大鼠TC浓度((2.415±0.278) mmol/L)显著高于正常组((1.703±0.477)mmol/L)(P<0.05),说明高脂饲料喂养的50 只SD大鼠均造模成功。
根据TC水平将高脂血症大鼠随机分为5 组:高脂血症模型对照组(HFD,1.2 g/(kg·d mb)生理盐水灌胃)、阳性对照组(10 mg/(kg·d mb)辛伐他汀片灌胃)和蓝靛果花色苷低、中、高剂量组(HFD+L、HFD+M、HFD+H,分别给予4.0、40.0、120.0 mg/(kg·d mb)的花色苷灌胃[17])。基础饲料对照组(ND,1.2 g/(kg·d mb)生理盐水灌胃)。
1.3.2 血脂指标测定
每7 d测定大鼠体质量1 次,35 d后,禁食不禁水24 h后断尾采血、分离血清,分别测定大鼠血清中TC、TG、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、LDL-C、载脂蛋白A(apolipoprotein A,Apo-A)和载脂蛋白B(Apo-B)的水平。HDL-C测定:清除法[18];LDL-C测定:清除法[19];TG测定:甘油磷酸氧化酶(glycerol phosphate oxidase,GPO)-过氧化物酶-抗过氧化物酶(peroxidaseanti-peroxidase,PAP)法[20];胆固醇测定:胆固醇氧化酶(cholesterol oxidase,CHOD)-PAP法[21];Apo-A:免疫比浊法[22];Apo-B测定:免疫比浊法[22]。
1.3.3 RT-PCR检测LDLR、ABCG1、ABCA1基因表达水平
称取30 mg肝脏组织,常规Trizol提取总RNA,进行反转录。反应程序为:37 ℃,60 min;85 ℃,5 min;4 ℃,5 min;置于-20 ℃保存。然后将制备好的cDNA进行RT-PCR扩增,反应程序:95 ℃ 10 min;95 ℃ 15 s,60 ℃ 45 s,40 个循环;95 ℃ 15 s;60 ℃ 1 min;95 ℃ 15 s;60 ℃ 15 s。数据采用仪器自带ABI Prism 7300 SDS软件分析;数据处理采用GraphPad Prism 5.0软件。
NCBI primer designing tool设计RT-PCR扩增引物,由上海生工生物技术有限公司合成,具体见表1。

表1 RT-PCR引物Table1 Primers used for RT-PCR
1.3.4 Western blot实验检测LDLR蛋白表达水平
称取30 mg大鼠肝脏组织,进行总蛋白抽提。蛋白用二喹啉甲酸(bicinchoninic acid,BCA)蛋白定量试剂盒进行定量,酶标仪测定OD值。利用垂直电泳仪进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,蛋白处于浓缩胶时电压设置为80 V,蛋白进入分离胶之后电压调至120 V,电泳1 h。然后进行转膜,即在电转完毕后,将PVDF膜置于5%的脱脂奶粉(TBST配制)37 ℃中封闭2 h。分别进行一抗和二抗孵育,一抗孵育:封闭结束之后,TBST清洗PVDF膜3 遍,分别加入以下一抗:兔LDLR(1∶200,V/V)、鼠β-actin(1∶5 000,V/V),4 ℃孵育过夜。二抗孵育:一抗孵育结束后,用TBST洗3 遍,鼠抗/兔抗(1∶2 000,V/V)二抗室温孵育2 h,TBST脱色摇床清洗3 遍。最后 进行免疫检测:PVDF膜上均匀滴加ECL化学显色液,发光强度用ImageQuant LAS 4000mini化学发光成像检测仪检测拍照。
1.4 数据统计学分析
采用SPSS 13.0软件对数据进行统计分析,实验数据均以表示,采用单因素方差Duncan分析,P<0.05为差异有统计学意义。
2 结果与分析
2.1 蓝靛果花色苷对大鼠体质量的影响
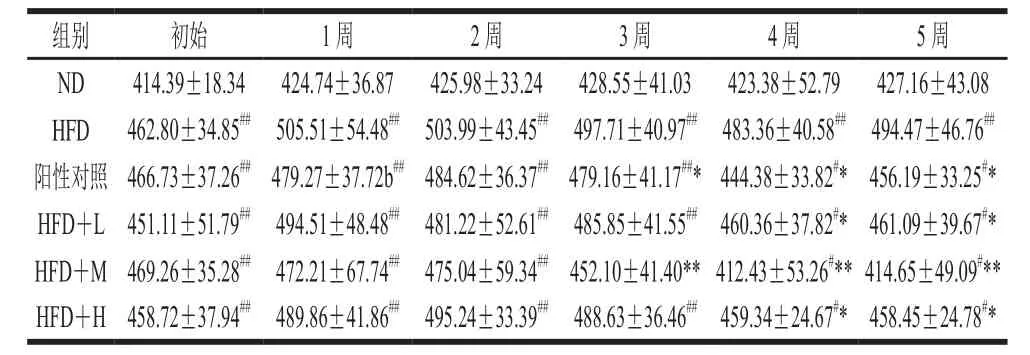
表2 蓝靛果花色苷对大鼠体质量的影响(n= 10)Table2 Effect of LCA on rat body weight (n= 10)g
由表2可知,ND组大鼠体质量在5 周内处于平稳状态;HFD组大鼠体质量呈上升趋势,与ND组有显著性差异(P<0.01)。灌胃3 周后,HFD+M组大鼠的体质量下降,与ND组体质量没有显著性差异(P>0.05),与HFD组体质量有极显著性差异(P<0.01)。灌胃4 周后,与HFD组比较HFD+M组差异显著(P<0.01);与ND组比较,HFD+M组体质量降低,差异显著(P<0.05);与HFD组比较,HFD+L、HFD+H组差异显著(P<0.05)。灌胃5 周后,与HFD组比较,HFD+M组差异极显著(P<0.01);与ND组比较HFD+M组体质量降低,差异显著(P<0.05);与HFD组比较HFD+L、HFD+H组差异显著(P<0.05)。综上可知,不同剂量蓝靛果花色苷对于大鼠体质量都有一定的作用效果,但最适宜的条件为HFD+M。
2.2 蓝靛果花色苷对大鼠血脂指标的影响
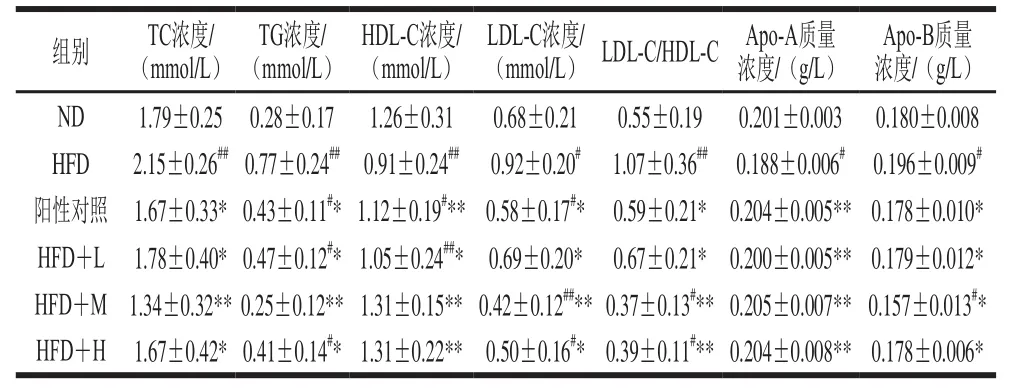
表3 蓝靛果花色苷对大鼠血脂水平的影响(n=10)Table3 Effect of LCA on blood lipid levels in rats (n= 10)
从表3可以看出,灌胃5 周后,TC和TG水平下降,与HFD组相比各剂量组均具有显著性差异(P<0.05或P<0.01),其中HFD+M组最为明显(P<0.01)。与HFD组相比,各剂量组HDL-C水平均升高,具有显著性差异(P<0.05或P<0.01)。与HFD组相比,各剂量组LDL-C水平均降低,具有显著性差异(P<0.05或P<0.01),其中HFD+M组最为明显(P<0.01)。与HFD组相比,各剂量组LDL-C/HDL-C均降低,具有显著性差异(P<0.05或P<0.01),其中HFD+M、H组更为显著(P<0.01)。与HFD组相比,各剂量组Apo-A水平极显著提高(P<0.01)。与HFD组相比,各剂量组Apo-B水平也呈降低趋势(P<0.05)。综上可知,花色苷处理后的大鼠各项指标均得到相应的改善,在HFD+M条件下,作用最为明显。
2.3 蓝靛果花色苷对大鼠肝脏组织中LDLR、ABCG1、ABCA1基因表达水平的影响
RT-PCR对各指标mRNA检测结果显示(表4),经蓝靛果花色苷干预后,与HFD组比较,HFD+L(1.69±0.84)、HFD+M(3.06±1.23)、HFD+H(3.41±1.18)组LDLR mRNA表达量均显著性提高(P<0.05)。与HFD组比较,HFD+M(3.49±1.35)、HFD+H(3.32±1.19)组ABCA1 mRNA表达量均提高,具有显著性差异(P<0.05)。与HFD组比较,HFD+L(1.68±0.75)、HFD+M(3.46±1.76)、HFD+H(3.51±1.19)组ABCG1 mRNA表达量均提高,具有显著性差异(P<0.05)。与ND组比较,各指标在HFD+M、H均具有极显著性差异(P<0.01),而ABCA1在HFD+L也具有显著性差异(P<0.05)。综上可知,蓝靛果花色苷在HFD+M、H时对LDLR、ABCA1、ABCG1 mRNA有较好的促进效果。

表4 蓝靛果花色苷对大鼠肝脏组织中LDLR、ABCA1 and ABCG1 mRNA表达水平的影响(n=10)Table4 Effect of LCA on the gene expression of LDLR, ABCA1 and ABCG1 in livers of rats (n= 10)
2.4 蓝靛果花色苷对大鼠肝脏组织中LDLR蛋白表达的影响
Western blot检测大鼠肝脏组织中LDLR蛋白表达水平,结果显示,经过蓝靛果花色苷干预后,与HFD组比较,HFD+L(0.930±0.082)、HFD+M(1.280±0.087)、HFD+H(1.450±0.080)组LDLR蛋白水平均提高,且差异显著(P<0.05)(图1),LDLR蛋白表达结果与mRNA一致。

图1 蓝靛果花色苷对大鼠肝脏组织中LDLR蛋白表达水平的影响Fig. 1 Effect of LCA on the protein expression of LDLR in livers of rats
3 讨 论
LDLR的表达水平与脂质代谢密切相关,人血液中70%的胆固醇由LDL和极低密度脂蛋白(very low density lipoprotein,VLDL)携带,但绝大部分胆固醇结合于LDL中进行转运和代谢。LDLR对LDL的吞噬和清除是LDL代谢过程中最为关键的环节,同时血液中约75%的LDL通过肝脏被清除,其中90%是通过LDLR途径清除的[23]。LDLR是位于细胞表面的跨膜受体,是分子质量约160 kD的糖蛋白,含839个氨基酸残基。主要功能是参与LDL的代谢过程,血浆中LDL携带的胆固醇主要是通过肝细胞LDLR清除,LDLR对LDL的吞噬与清除是LDL代谢过程中最关键的环节。许多物质在转录水平或转录后水平均可调控LDLR基因的表达。本课题组前期的研究证实了蓝靛果花色苷可降低大鼠血清中LDL-C的水平[17,24]。高脂血症是引发冠心病、动脉粥样硬化、高血压、糖尿病等的首要危险因素,有研究表明花色苷具有明显的降低大鼠血浆TC、TG、LDL-C含量,增加HDL-C含量的功能[25-26],本研究采用蓝靛果花色苷进行实验,从大鼠灌胃后的体质量变化及血脂6 项的变化可以看出,辛伐他汀和花色苷对大鼠的体质量和血脂都有不同程度的影响,均能减轻大鼠体质量,降低大鼠血浆TC、TG、LDL-C含量,增加HDL-C含量;说明花色苷降血脂效果明显。另外,研究结果进一步显示在实验剂量下蓝靛果花色苷可明显增加高脂大鼠肝脏组织中LDLR蛋白和mRNA的表达量,从而降低LDL-C水平,调节体内血脂含量。
Apo-A大部分分布在HDL中,是HDL的最主要载脂蛋白,与血浆HDL水平呈正相关[27-29]。动脉粥样硬化、糖尿病、高脂蛋白血症、肝功不足均可导致Apo-A水平的降低[30-32]。本实验结果显示蓝靛果花色苷能有效升高高脂血症大鼠血清中Apo-A和HDL的水平,花色苷中、高剂量组效果明显。Apo-B存在于LDL的表面,与血浆Apo-B、LDL的水平也呈正相关,本研究结果显示不同剂量的蓝靛果花色苷可有效降低大鼠血清LDL-C水平,中剂量组Apo-B水平下降最明显;提示蓝靛果花色苷能对高脂模型大鼠的肝脏功能有很好的保护作用。
ABCG1和ABCA1是ATP结合转运蛋白家族成员,主要表达于巨噬细胞及各器官的吞噬细胞系统。ABCG1又可以作为转运体,将巨噬细胞中的胆固醇转移至成熟型HDL,ABCG1途径在巨噬细胞胆固醇流出中有重要的地位[33]。ABCG1能增加胆固醇外流,有利于细胞清除多余胆固醇并避免胆固醇在细胞内堆积,但其具体机制至今仍不清楚。Freeman等[34]报道,ABCG1不仅在细胞表面调节胆固醇逆向转运,还可调控细胞外胆固醇微结构域的产生,在胞外区域发挥重要作用。对冠心病患者单核细胞ABCA1反应性的影响已经被证实[35-38],同时有研究显示胆固醇外流增加有助于减轻动脉粥样硬化病变程度[39-41]。ABCA1和ABCG1的表达水平与胆固醇流出密切相关,二者分别负责把细胞内的脂质转运至胞外的Apo A-I和HDL,在维持细胞内胆固醇的动态平衡、阻止脂质在巨噬细胞内的聚集中发挥着重要作用[42-44]。本实验结果显示40.0、120 mg/(kg·d mb)剂量下的蓝靛果花色苷可有效增加高脂大鼠肝脏组织中ABCA1和ABCG1基因表达水平,影响胆固醇逆转运。
综上分析,通过对高脂血症大鼠进行蓝靛果花色苷干预,测定血脂水平、肝脏LDLR及其相关基因ABCG1和ABCA1 mRNA的表达情况,发现在本实验剂量下蓝靛果花色苷可有效调节高脂大鼠体内的血脂指标,增加动物体内LDLR蛋白和基因的表达水平,降低胆固醇含量,其作用机制可能与其调控胆固醇逆转运途径中ATP结合转运蛋白,从而增加胆固醇外流,调节胆固醇逆转运有关。

