格列美脲治疗对2型糖尿病患者代谢指标及血清护骨素水平的影响
袁 宁,王晓娟,乔 彦,杨文翔
(四川省南充市中心医院,四川 南充 637000)
糖尿病(Diabetes mellitus,DM),尤其是2型糖尿病(Type 2 diabetes mellitus,T2DM)作为最常见的DM类型,已然成为严重危害人类健康的公共卫生难题[1]。DM病因和发病机制复杂,起病隐匿,以慢性高血糖为主要特征,T2DM主要与胰岛素抵抗和胰岛素相对不足相关。磺脲类药物属于胰岛素促泌剂,格列美脲为其第三代磺脲类药物[2],较传统磺脲类药物有诸多潜在的优点,如用药剂量小,起效快,作用时间长,副作用小等,并且其体外改善胰岛素抵抗作用更明显,增加了对葡萄糖的摄取和利用,这些优点使格列美脲成为T2DM治疗的一种重要口服降糖药物[3]。护骨素(OPG)[4]是一种可溶性糖蛋白,大量的临床观察研究发现DM患者的血清OPG水平明显升高,并且与血糖控制情况、病程、并发症和心血管事件的发生、死亡风险密切相关,并且阻断OPG相关通路可以改善胰岛素抵抗。本研究对比格列美脲与格列本脲治疗T2DM患者的效果,观察患者治疗前后代谢指标及血清OPG的变化,从而进一步明确格列美脲的应用价值,为临床推广使用提供依据。
1 资料与方法
1.1一般资料选取2015年1月至2016年12月在本院内分泌科门诊就诊或住院的T2DM患者110例,均符合《中国T2DM防治指南(2013年版)》的诊断标准[5],入选前空腹血糖(FBG)≥7.0 mmol/L,或者餐后2小时血糖(2 hBG)≥11.1 mmol/L,但< 16.7 mmol/L;所有患者年龄≥18岁;血糖控制不佳,糖化血红蛋白(HbA1c)>8.0%。排除标准:1型DM或合并DM酮症酸中毒等危急重症;合并严重感染,或严重肝肾功能损伤和血液系统严重疾病;妊娠、哺乳期患者;入组前已使用磺脲类药物,或存在药物过敏史。研究过程中各种原因脱落8例,共102例完成试验,其中将服用格列美脲治疗患者分为观察组(50例),男27例,女23例,年龄(55.21±9.28)岁。服用格列本脲治疗患者分为对照组(52例),男25例,女27例,年龄(56.48±3.58)岁。患者均自愿接受相关治疗和检查,并签署知情同意书,本研究通过医院伦理委员会审核。两组患者的年龄、性别、病程等及入组时血糖水平、代谢指数、血压、体重等数据比较,差异均无统计学意义(P> 0.05),两组资料有可比性。
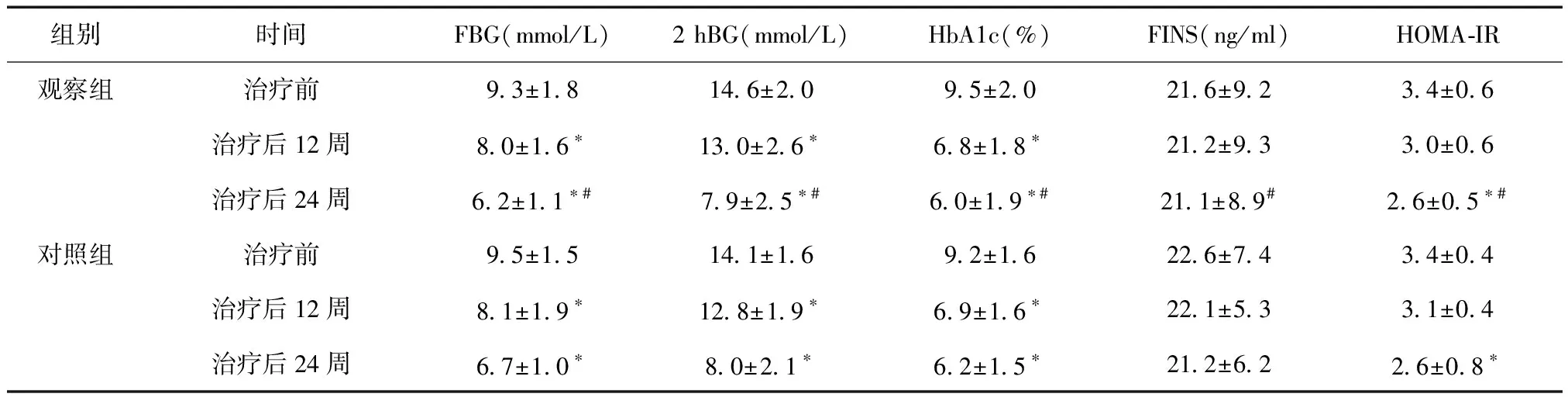
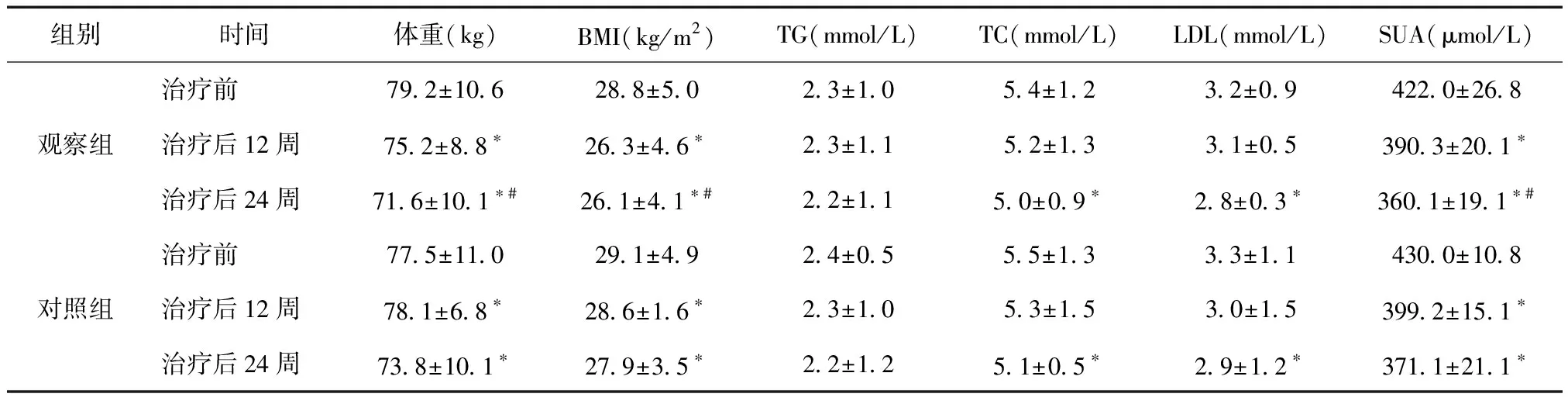
1.2方法观察组给予格列美脲起始剂量1 mg/d,每日早餐前顿服,前4周为调整期,每2周随访1次,根据血糖变化调整用药剂量,如果FBG>7.0 mmol/L,且未出现低血糖反应,则将格列美脲剂量增加1 mg/d,最大量为4 mg/d;如果3.9 1.3观察指标所有患者分别于治疗前、治疗后12周、治疗后24周,测量身高、体重以及血糖、血脂、尿酸等代谢标:空腹血糖(FBG)、餐后2小时血糖(2 hBG)、空腹胰岛素(FINS)、糖化血红蛋白(HbA1c)、血甘油三脂(TG)、总胆固醇(TC)、低密度脂蛋白(LDL)、血尿酸(SUA),血清OPG水平。稳态模型评估胰岛素抵抗指数(HOMA-IR)和胰岛β细胞功能指数(HOMA-β)。所有研究对象均禁食禁水8小时以上,次日清晨空腹抽取静脉血,当日完成检测。记录患者治疗期间的不良反应,低血糖定义为FBG≤3.9 mmol/L。 1.4统计学方法应用SPSS 19.0软件包进行数据处理。计量资料以均数±标准差表示,治疗前后资料比较采用配对t检验。P< 0.05为差异有统计学意义。 2.1治疗前后血糖及胰岛素变化情况观察组治疗后FBG、2 h BG、HbA1c低于治疗前(P< 0.05)。对照组治疗后HOMA-IR明显低于治疗前,HOMA-β明显高于治疗前(P< 0.05)。两组之间比较差异无统计学意义(P> 0.05)。见表1。 表1 两组治疗前后血糖及胰岛素相关指标变化 *与同组治疗前相比,P< 0.05;#与格列苯脲组治疗后相比,P> 0.05 2.2治疗前后代谢相关指标变化情况两组治疗24周后患者的体重指数(BMI)、总胆固醇(TC)、低密度脂蛋白(LDL)、血尿酸(SUA)水平低于治疗前,差异有统计学意义(P< 0.05)。观察组治疗24周体重、BMI、SUA水平明显低于同时间对照组,差异均有统计学意义(P< 0.05)。见表2。 表2 两组治疗前后代谢相关指标变化情况比较 *与治疗前比较,P< 0.05;#与对照组比较,P< 0.05 2.3治疗前后血清OPG水平变化情况两组患者治疗后血清OPG水平显著低于治疗前(P< 0.05),且观察组治疗24周后患者血清OPG水平明显低于对照组,差异有统计学意义(P< 0.05),见表3。 表3 两组治疗前后血清OPG水平变化情况 *与治疗前比较,P< 0.05;#与对照组比较,P< 0.05 2.4不良事件的发生率本研究过程中观察组共发生可能与药物有关的不良事件10例,主要有低血糖反应(4例,40%);胃肠道反应,如腹部不适、恶心纳差、腹胀、腹泻、便秘等,共8例(80%)。对照组有15例发生药物不良反应,低血糖反应6例(40%),胃肠道反应11例(73.33%)。两组不良反应比较,无差异统计学意义(P> 0.05)。所有低血糖反应均为一过性低血糖症状,进食后可缓解。所有患者的肝肾功能、血、尿常规未出现异常。 DM作为一种以高血糖为特征的慢性代谢性疾病,其机制与胰岛素抵抗和胰岛素分泌缺乏有关,胰岛素抵抗可通过促进脂质合成,刺激动脉内膜平滑肌增殖;胰岛素分泌缺乏又会使脂质清除减慢,增加了DM相关血管病变的发生[6]。且DM存在一定程度的代谢紊乱,尤其是脂代谢紊乱。脂质代谢紊乱可加重胰岛素抵抗,加速β细胞衰竭,诱发动脉硬化、冠心病等心血管疾病,严重影响人们的生存质量,目前我国DM患病率逐渐升高,受世界各国的明显关注。流行病学筛查诊断DM患者中,发现T2DM比例高达50%以上。而DM患者血清指标与OPG水平变化可作为机体DM参考指标,有助于临床判断。而格列美脲是新一代磺脲类口服降糖药,具有高效、长效、安全等优点,其主要作用机制是通过刺激胰岛β细胞分泌胰岛素,从而发挥降糖作用[7]。格列美脲作用于胰腺是与65-Kda受体亚单位结合,其结合较格列苯脲快2~3倍,且解离快8~9 倍[8]。并且其可以增加周围组织对胰岛素的敏感性,增加对葡萄糖的摄取和利用,增加脂肪和糖原的合成[9],对T2DM有一定治疗作用。研究也表明尿酸升高的T2DM患者DM肾病的发生率明显升高,同时尿酸升高的T2DM患者发生中风的风险也增高2倍左右[10]。因此纠正高血糖、调节脂质、尿酸代谢,改善胰岛素抵抗对延缓DM的发展有重要作用。 OPG是由血管内皮细胞和平滑肌细胞产生,其主要作用为核因子κB受体活化因子配体的假受体,与RANK竞争结合RANKL,阻断破骨细胞分化,促进成骨细胞凋亡。研究发现OPG与动脉粥样硬化、骨微结构以及骨力学性能等疾病密切相关。文献报道发现在T2DM患者中,其血清OPG水平均可出现明显升高,并且OPG水平与DM病程、DM并发症、血糖控制以及心血管事件及死亡风险相关。阻断RANKL/RANK/OPG信号通路可以改善肝脏膊岛素抵抗,具有预防T2DM发生的作用[11]。本研究中发现血糖控制不良的T2DM患者中OPG呈现高表达,而经格列美脲治疗后,在血糖控制的情况下,OPG水平出现显著下降,并且优于对照组对OPG的影响,说明T2DM患者的血清OPG水平可能与FBG、2 hBG、HbA1c等相关。毛文文等[12]对老年T2DM患者血管病变影响因素研究中发现外周内皮细胞(EPCs)与OPG呈反方向变化,EPC为炎症因子刺激血管内皮细胞产生。张磊等[13]发现OPG、sRANKL可作为T2DM的敏感指标。进一步证实OPG为血管钙化与骨代谢的中间枢纽,且血糖水平受内皮细胞、OPG影响。格列美脲通过良好控制血糖水平,发挥降低血清OPG的作用。 本研究中发现格列美脲对T2DM患者的血糖具有良好的控制作用,经12周用药后患者的FBG、2 hBG、HbA1c均显著下降,用药24周后患者的FBG、2 hBG、HbA1c已基本达到正常水平,其降糖效果与格列本脲类似。同时发现患者的HOMA-IR和HOMA-β指数均得到改善,HOMA被广泛用于临床评价DM人的胰岛素敏感性、胰岛素抵抗水平以及胰岛β细胞功能,可见格列美脲能显著改善患者的胰岛素抵抗,而研究中胰岛素水平在治疗前后变化不显著,进一步说明了格列美脲主要通过增加胰岛素敏感性而发挥降糖作用。 研究还发现格列美脲治疗后患者的平均体重呈现下降趋势,且BMI与治疗前相比具有显著差异,且本研究中患者胆固醇、低密度脂蛋白、血尿酸均有显著下降,但血清甘油三酯的水平未出现显著改变,说明格列美脲在控制血糖的同时,通过改善胰岛素抵抗,发挥调节代谢的作用。再者DM患者血糖增高、胰岛素抵抗使得游离脂肪酸升高,脂蛋白酶及卵磷脂胆固醇转酰酶活性降低、肝脂酶活性升高等原因导致脂代谢紊乱,血糖水平越高,高TC、高TG的发生率也越高。高血糖水平是T2DM患者血脂异常的高风险因素,积极控制血糖水平,可以降低T2DM患者血脂异常的发生率。 此外,在研究过程中格列美脲患者主要不良反应为低血糖和胃肠道不适,但低血糖均为轻度,进食后可缓解,并未影响研究的进程,所以格列美脲在服药治疗过程中不良反应轻微,低血糖发生率低。 综上,格列美脲可有效降低T2DM患者的血糖水平,改善代谢紊乱,并降低血清OPG水平,对预防血管并发症方面具有一定作用,是一种安全有效的口服降糖药。2 结果

3 讨论

