盐酸纳洛酮在慢性阻塞性肺疾病合并呼吸衰竭治疗中的应用研究
孟小蓉,杨 娇,张 磊
( 成都医学院第一附属医院老年科,四川 成都 610500)
慢性阻塞性肺疾病(COPD)是以气流受限及气道慢性炎性反应为特点,呈渐进性发展的肺部疾病[1]。呼吸衰竭(FAR)为COPD的终末期表现,是机体正常氧运输难以维持或CO2难以正常排出的病理状态[2]。在COPD-FAR的治疗上,临床多行机械通气治疗,尽管该疗法可有效改善患者通气、换气障碍,但长期使用常易引发呼吸机相关肺炎,不利于患者康复[3]。我院将盐酸纳洛酮应用于COPD-FAR的临床治疗,效果满意,现报道如下。
1 资料与方法
1.1一般资料2015年12月至2017年11月我院收治的COPD-FAR患者128例,男76例(59.38%),女52例(40.62%),年龄53~80岁[(65.49±6.63)岁];COPD病程4.50~17.86年[(10.98±1.19)年];体质量指数17.39~24.78 kg/m2[(21.38±2.16)kg/m2];呼吸频率23~39次/分[(32.76±3.31)次/分];急性加重时间2.10~5.60 d[(3.65±0.38)d];FAR程度:中度77例(60.16%),重度51例(39.84%)。所有患者均符合《慢性阻塞性肺疾病诊断指南》[4]中的诊断标准,并经血气分析诊断为2型FAR。纳入标准:符合《无创正压通气临床应用专家共识》[5]标准;对本研究药物不过敏;知情同意。排除标准:呼吸停止或抑制者;意识障碍者;易误吸者;鼻咽部结构异常者;气道存在大量分泌物或痰液黏稠者;胃肠重症胀气者;肝肾功能障碍者;近期行胃食管或面部手术者。按随机数字表法分为研究组与对照组各64例,两组一般资料比较,差异无统计学意义(P> 0.05),见表1。本研究经我院伦理委员会批准并备案。
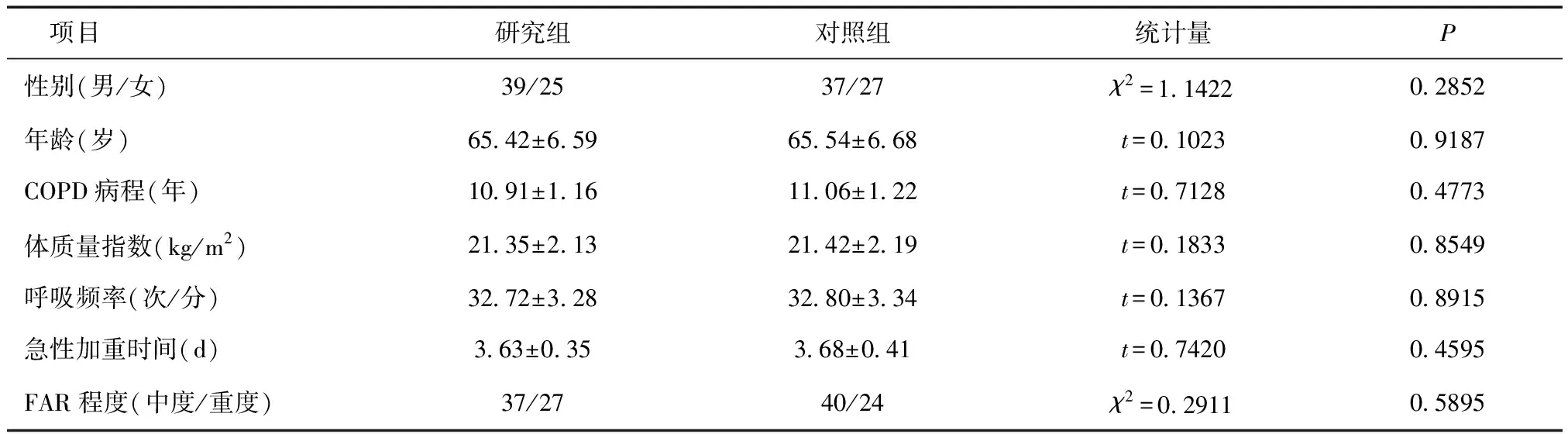
表1 两组一般资料比较
1.2方法两组均给予吸氧、解痉、平喘、祛痰、抗感染、纠正酸碱及电解质平衡等常规治疗。对照组行常规治疗+无创正压通气治疗。通气模式S/T;呼吸频率12~20次/分;氧流量5~8 L/min;呼气压力4~8 cmH2O;吸气压力10~25 cmH2O;通气时间3~4 h,2次/天。研究组行常规治疗+无创正压通气+盐酸纳洛酮治疗。无创正压通气同对照组。盐酸纳洛酮(生产企业:江苏吴中医药集团有限公司;国药准字:H20103564;规格:2 ml:2 mg)2 mg+生理盐水100 ml静脉滴注,2次/天,连续治疗3天。
1.3观察指标观察两组治疗前后pH、动脉血氧分压(PaO2)、动脉血二氧化碳分压(PaCO2)等血气分析指标;1秒用力呼气量(FEV1)、最大肺活量(PEF)、1秒用力呼气量/用力肺活量(FEV1/FVC)等肺功能指标;血清白介素-13(IL-13)、IL-18、高敏C反应蛋白(hs-CRP)、前列腺素E2(PGE2)、可溶性细胞间黏附分子-1(sICAM-1)等炎性因子;血清超氧化物歧化酶(SOD)、丙二醛(MDA)等指标。以血气分析仪(GEM3000)进行血气分析;肺功能指标以肺功能仪(Chest)检测;血清炎性因子以ELISA法检测;SOD以黄嘌呤氧化酶法检测;MDA以巴比妥酸法检测。检测严格按照试剂盒规定进行。
1.4统计学方法采用SPSS 19.0统计软件分析数据。计量资料比较采用t检验;计数资料比较采用χ2检验。P< 0.05为差异有统计学意义。
2 结果
2.1两组血气分析指标比较治疗前,两组pH、PaO2、PaCO2比较,差异无统计学意义(P> 0.05);治疗后,两组PaO2较治疗前升高,PaCO2较治疗前降低;且研究组PaO2高于对照组,PaCO2低于对照组(P< 0.05)。治疗后两组pH与治疗前比较,差异无统计学意义(P> 0.05),见表2。

表2 两组血气分析指标比较
a与治疗前比较,P< 0.05
2.2两组肺功能指标比较治疗前,两组FEV1、PEF、FEV1/FVC比较,差异无统计学意义(P> 0.05);治疗后,两组FEV1、PEF、FEV1/FVC较治疗前升高,且研究组高于对照组(P< 0.05),见表3。
2.3两组炎性因子比较治疗前,两组IL-13、IL-18、hs-CRP、PGE2、sICAM-1比较,差异无统计学意义(P> 0.05);治疗后,两组IL-13、IL-18、hs-CRP、PGE2、sICAM-1较治疗前降低,且研究组低于对照组(P< 0.05),见表4。
2.4两组MDA、SOD比较治疗前,两组MDA、SOD比较,差异无统计学意义(P> 0.05);治疗后,两组MDA较治疗前降低,SOD较治疗前升高,且研究组MDA低于对照组,SOD高于对照组(P< 0.05),见表5。
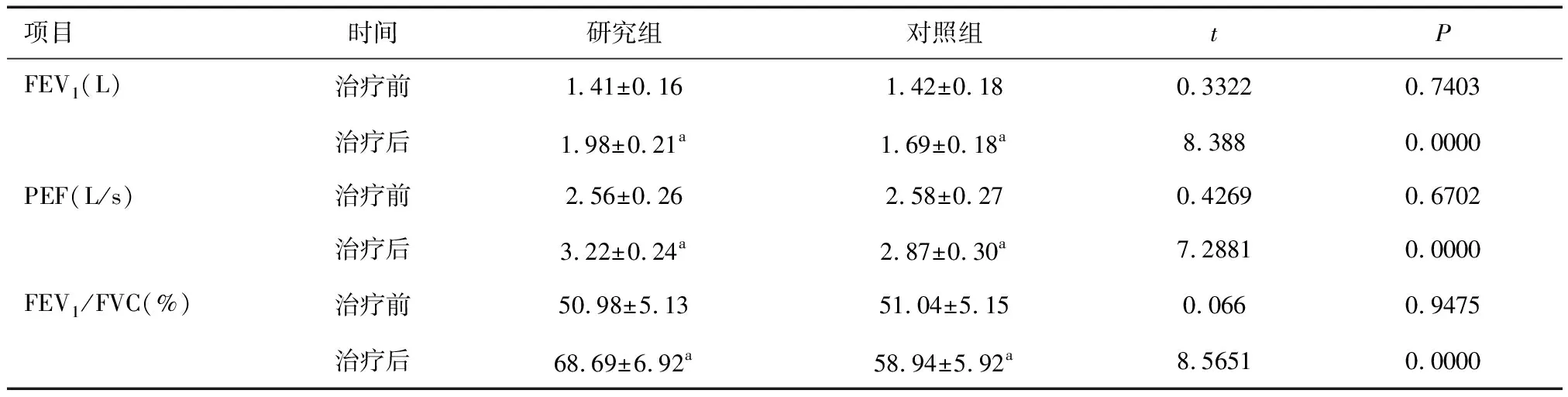
表3 两组肺功能指标比较
a与治疗前比较,P< 0.05
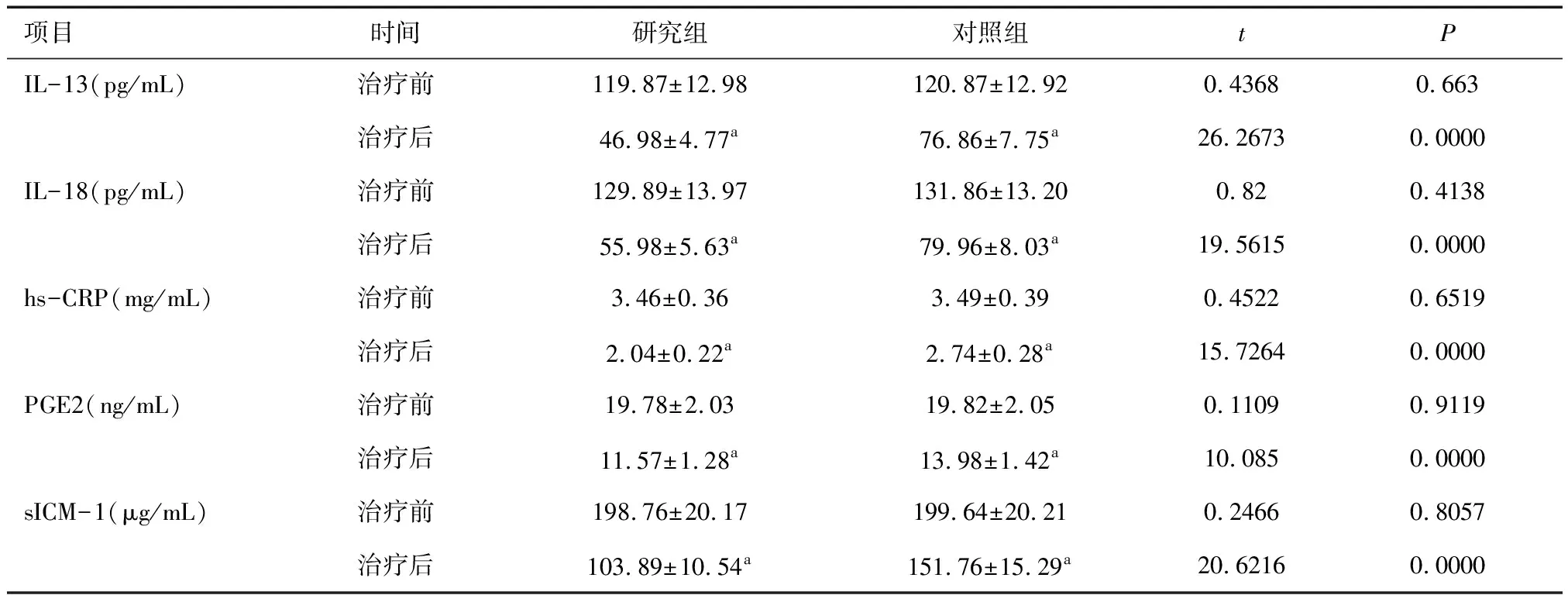
表4 两组炎性因子比较
a与治疗前比较,P< 0.05
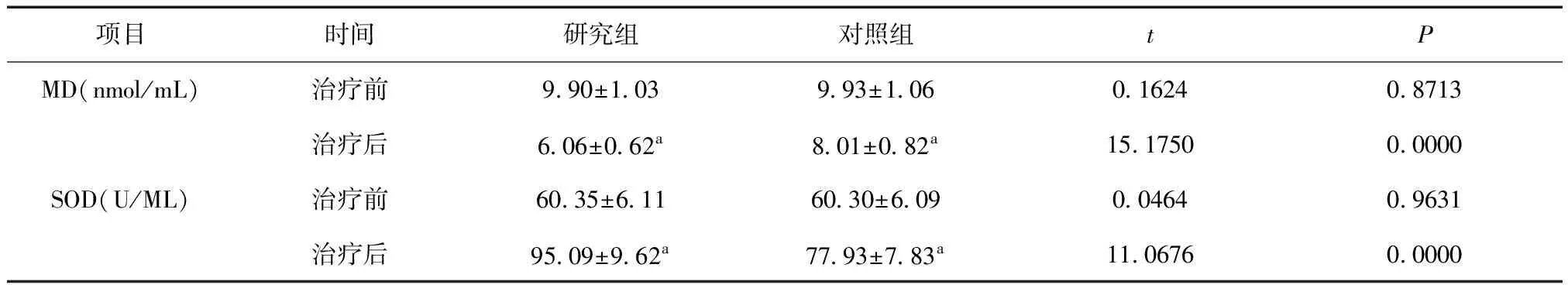
表5 两组MDA、SOD比较
a与治疗前比较,P< 0.05
3 讨论
研究证明,COPD不但病程长,且呈进行性发展,若急性加重可引发气道上皮细胞变性、坏死,气道发生炎性改变,致使肺泡通气量严重降低,CO2潴留,最终导致FAR[6]。因COPD-FAR患者呼吸功能严重受限,故临床需快速降低其气道阻力,提高肺泡通气量,促进CO2排出,提高血氧含量[7]。无创正压通气可促进支气管机械性扩张,提高肺通气水平,缓解呼吸肌疲劳,纠正通气/血流比,改善FAR症状,促进患者转归[8]。资料显示,尽管无创正压通气有益于COPD-FAR患者康复,但仍存在着一定的死亡率[9]。研究证明,β-内啡肽为呼吸抑制剂,在呼吸系统功能调节中具有重要作用。β-内啡肽水平可反映FAR的严重程度,高水平 β-内啡肽可降低脑干对CO2的敏感性,抑制呼吸[10]。盐酸纳洛酮为阿片受体拮抗剂,能够通过血脑屏障,竞争性结合β-内啡肽,快速解除呼吸抑制,兴奋呼吸中枢,抑制痰液分泌,提高肺通气水平[11]。盐酸纳洛酮还具有中枢促醒作用,可促进患者恢复意识,保护脑细胞,缓解脑水肿,为抗感染治疗争取时间[12]。在本研究中,治疗后研究组血气分析及肺功能指标均优于对照组,提示盐酸纳洛酮治疗COPD-FAR具有一定的优势。
炎性因子是促进COPD-FAR发生进展的重要因素。IL-13和机体免疫调节、及炎性反应密切相关[13]。资料显示,IL-13水平升高可增大肺容积,促进黏液分泌,导致肺气肿[14]。IL-18可提高中性粒细胞活性,释放活性物质,引发局部炎性反应。IL-18可激活NF-κB,促进TH1细胞生成TNF-α、IFN-γ、IL-8等炎性因子,加重炎性反应。IL-18可导致Th1/Th2失衡,诱导血管内皮损伤,促进肺部病变进展[15]。hs-CRP为生成于炎性反应急性期,可准确反映机体炎性反应水平[16]。PGE2是环氧化酶作用于气道上皮细胞生成的炎性因子,可抑制生成炎性因子、扩张支气管,在气道炎性反应中具有重要作用[17]。sICAM-1可竞争性结合ICAM-1受体,干预白细胞膜上的活性分子,参与免疫调节。ICAM-1可损伤血管内皮,促进气道重塑[18]。在本研究中,治疗前两组患者各炎性因子水平高于常规,提示机体处于严重炎性反应状态。治疗后,研究组炎性因子水平低于对照组,说明盐酸纳洛酮有助于改善机体免疫,降低炎性因子水平。
MDA可作用于细胞膜、酶蛋白、DNA,导致脂质过氧化损伤,引发各种疾病[19]。MDA水平可准确反映自由基对组织的损伤程度,是评价组织损伤的重要指标[20]。SOD可有效清除机体内超氧阴离子,减少其对机体的伤害。SOD还可降低自由基及趋向性因子的活性,抑制炎性反应的发生[21]。本研究治疗后研究组MDA低于对照组,SOD高于对照组,提示盐酸纳洛酮可有效清除MDA,提高SOD水平,保护肺组织,避免其损伤。
总之,在常规治疗及无创正压通气基础上应用盐酸纳洛酮治疗COPD-FAR可有效改善患者血气指标及肺功能,清除炎性因子,保护肺组织,疗效显著,值得临床应用。

