人乳头瘤病毒16和52型双荧光等温多自配引发扩增的检测方法
崔玉伟, 牟 颖, 马 莉, 丁 雄, 方宗宇, 王 焰, 吴青青
(1. 贵州医科大学附属医院 中心实验室, 贵阳 550004;2. 浙江大学 工业控制技术国家重点实验室, 智能系统与控制研究所, 分析仪器研究中心, 杭州 310058)
宫颈癌是最常见的妇科恶性肿瘤之一, 高危型人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)的持续感染是导致宫颈癌的关键因素[1-4]. 目前, 检测HPV的方法主要有: Ⅱ代杂交捕获技术(HC Ⅱ试验)[5-6], PCR(多聚酶链式反应)-反向点杂交技术[7], 实时荧光定量PCR技术[8]等. 但上述方法均存在无法对HPV分型, 实验步骤繁琐、耗时长、存在交叉式污染以及试剂盒造价高等缺点. 因此, 开发一种操作简单、快速且价格低廉的HPV基因分型检测方法具有重要意义.
等温多自配引发扩增(IMSA)技术[9]是一种新型等温核酸扩增技术. IMSA技术使用6条特异性引物识别靶序列中7个基因区段, 在等温(60~65 ℃)条件下进行扩增反应, 整个检测反应仅需1 h. 该技术较PCR具有灵敏度高、特异性强、无需温度循环、检测时间短、成本低以及结果易判读等优点[10-11]. 浙江大学微流控制研究组开发的一种羟基萘酚蓝(HNB)和SYBR GreenⅠ混合双荧光指示剂已被证明可用于IMSA检测, 且比单一金属离子指示剂或单一DNA染料具有更好的指示性能, 并已成功检测乙肝病毒[10,12]. 在双荧光指示剂中, HNB和SYBR GreenⅠ的合理配比是实现等温扩增及结果明确判断的前提. 本文应用IMSA技术, 针对HPV的16和52型基因序列设计6条特异性引物, 通过在检测体系中加入HNB和SYBR双荧光指示剂, 优化控制条件, 进行闭管检测, 以减少气溶胶污染, 用微量IMSA检测体系以降低试剂成本. 结果表明, 该方法适用于检测中国人常见的高危HPV16和HPV52型人乳头瘤病毒.
1 材料与方法
1.1 主要仪器与试剂
ABI 7900HT型定量PCR仪(美国ThermoFisher公司); 小动物体内荧光成像系统(美国CRI Maestro公司). Bst WarmStart2.0 DNA聚合酶(8 U/μL, 1 U=1 μmol/min)、dNTPs(10 mmol/L)、MgSO4(100 mmol/L)和10×Isothermal buffer(20 mmol/L Tris-HCl, 2 mmol/L MgSO4, 50 mmol/L KCl, 10 mmol/L (NH4)2SO4, 0.1%Tween-20)均购自NEB(北京)有限公司; SYBR GreenⅠ和去核酸酶无菌水购自美国Life Technologies Ltd公司; 羟基萘酚蓝购自Lemongreen(上海)公司; 甜菜碱购自英国Sigma-Aldrich 公司; 21种HPV分型检测试剂盒和DNA提取试剂盒购自广东凯普生物化学有限公司.
1.2 IMSA引物的设计
从GenBank中下载HPV16E7和HPV52E6基因序列, 并用MEGA7软件进行分析, 定位差异明显的序列片段, 先用在线引物设计软件Primerexplorer V5(http://primerexplorer.jp/lampv5e/index.html)进行引物设计, 再根据IMSA引物设计原则[13]进行适合IMSA技术的改进, 筛选出最优引物组. IMSA包含6条引物, 分别为DsF,DsR,FIT,RIT,SteF和SteR. DsF和DsR为外引物, DsF由SteR和F3组成, DsR由SteF和R3组成; FIT和RIT为内引物, FIT由Tc和F2组成, RIT由T和R2组成; SteF和SteR为茎引物; SteRc与SteR、T与Tc、R2c与R2是反向互补序列. 引物由生工生物工程(上海)公司合成. HPV16和HPV52目的基因序列及引物识别靶点如图1所示. 引物序列组成列于表1.

表1 IMSA引物序列
1.3 HPV质粒的构建
HPV16和HPV52的DNA标准品是克隆含有HPV16型E7基因和HPV52型E6基因部分序列的pUC57质粒, 由南京金斯瑞生物科技有限公司合成并验证. 克隆后质粒全长3 100 bp, 其中目标序列长为390 bp. 测定克隆质粒在260 nm处的吸光度(OD260 nm)值, 并根据
按凯普DNA提取试剂盒说明书提取7份已知单重感染HPV6,HPV16,HPV18,HPV39,HPV52,HPV58,HPV59的宫颈刮片标本DNA. 将1 μL提取的DNA加入已优化的双荧光IMSA反应体系, 轻轻振荡混匀, 利用实时荧光PCR仪进行扩增(63 ℃, 60 min), 并记录实时扩增曲线. 反应结束后用荧光成像系统采集图像(激发波长为455 nm的蓝光), 根据反应管的颜色判断是否扩增, 阳性管呈黄绿色, 阴性管呈橘红色.
纯化和定量后的HPV16和HPV52质粒进行系列稀释至1.2×105,1.2×104,1.2×103,600,120,60,6拷贝/μL, 将1 μL系列稀释的质粒加入已优化的双荧光IMSA检测体系, 利用实时荧光PCR仪进行扩增(63 ℃, 60 min)并记录扩增曲线, 灵敏度实验重复3次. 反应结束后, 进行荧光图像采集.
1.4 双荧光IMSA检测方法的建立
建立如下10 μL反应体系: 1 μL DNA模板, 1 μL 10×Isothermal buffer, 0.2 μL 10μmol/L的外引物DsF和DsR, 0.4 μL 20 μmol/L的内引物FIT和RIT, 0.4 μL 40 μmol/L1的茎引物SteF和SteR, 1.4 μL的dNTPs, 0.4 μL的Bst 2.0 WarmStart DNA聚合酶, 1.6 μL 5 mol/L的甜菜碱, 0.6 μL的硫酸镁, 0.2 μL SYBR GreenⅠ(1∶200), 0.2 μL HNB, 剩余体积用去核酸酶无菌水补足.
103份疑似HPV感染病人的宫颈刮片标本由贵州医科大学附属医院提供, 按凯普DNA提取试剂盒说明书提取宫颈刮片标本DNA, 同时用本文建立的双荧光IMSA方法与HPV分型试剂盒检测.
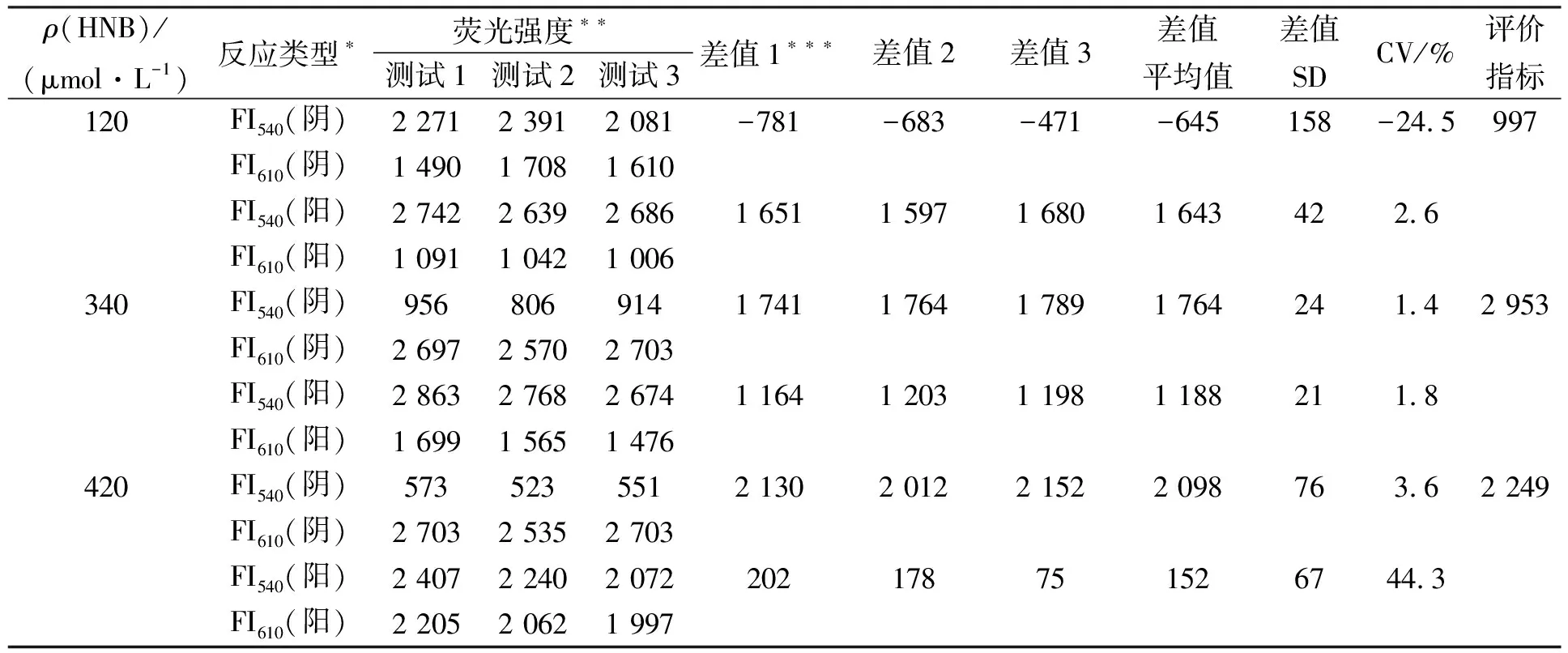
图2为不同浓度HNB与1∶10 000 SYBR GreenⅠ组成混合双荧光指示剂在IMSA反应液中的荧光光谱和双荧光显色结果. 由图2可见, 含有双荧光指示剂的阳性和阴性IMSA反应液荧光光谱在500~650 nm内存在明显的两个荧光强度峰, 分别在540,610 nm处. 其中, 340 μmol/L HNB与SYBR GreenⅠ混合时阴阳性反应间的荧光颜色变化最清晰, 表现为阳性反应管双荧光显色为黄绿色, 阴性反应管为橘红色. 表2为不同浓度HNB组成的双荧光指示剂评价结果. 由表2可见, 340 μmol/L HNB的评价指标值为2 953, 明显大于120,420 μmol/L HNB的值, 表明340 μmol/L HNB为最优浓度. 该结果与文献[10]的优化结果及肉眼观察结果一致.
玉米种植过程中发生的病虫害需要及时治理,以免影响其他植株的正常生长,农户应尽量采用物理、化学及生物相结合的方式来处理。针对玉米的叶茎根等的病虫害要及时的喷洒适量的农药,缓解植株的病变情况。另外及时将病变的较为严重的植株从根清理掉,避免腐烂的植株通过土壤、空气等途径将细菌传播至其他健康的植株。最后通过在玉米植株上放置赤眼蜂、苏云金菌及苏云金杆菌乳剂等来达到防治病虫害的目的。
1.5 IMSA特异性验证
计算克隆质粒的DNA拷贝浓度(拷贝/μL), 将克隆质粒进行系列稀释备用.
1.6 IMSA灵敏度检验
第三个“1”是指以100万吨工业级、食品级磷酸为基础,做100万吨精细化工产品,包括饲料添加剂、食品和医疗产品、电子材料等,把磷产业链向价值高端延伸。
1.7 临床标本的检测及比对
根据原因制定组合干预措施,包括:①开展全院手卫生培训,强化手卫生意识。②走廊、床旁等地方增设手卫生设施。③科主任及护士长每周一晨会亲自演练七步洗手法,强调手卫生。④将手卫生依从率纳入到院感质控中单独立项。
2 结果与分析
2.1 双荧光指示剂优化
在反应体系中, HNB和SYBR GreenⅠ构成双荧光指示剂. 为优化双荧光检测体系中指示剂的质量浓度, 将终浓度为1∶10 000的SYBR GreenⅠ分别与不同浓度的HNB(终浓度分别为120,340,420 μmol/L)进行组合, 以确定指示剂最佳配比. 优化双荧光指示剂使用的DNA模板为1.2×104拷贝/μL的HPV52质粒; 反应管置于ABI 7900 HT型实时荧光定量PCR仪中, 63 ℃恒温反应60 min. 每浓度组设3个平行管, 同时设置阴性对照(以等体积的去核酸酶无菌水代替DNA模板在相同条件下反应). 反应结束后用荧光成像系统进行发射光谱分析, 设定激发波长为455 nm的蓝光, 曝光时间5 s, 分别对阳性和阴性反应液进行荧光成像, 并分析其500~650 nm步长为10 nm的发射光谱特征, 重复测试3次. 使用最优HNB浓度评价标准[10], 并将其简化为一个评价指标; 记录并分析阳性和阴性反应液于540,610 nm的荧光强度, 分别记为FI540(阳性)、FI610(阳性)、FI540(阴性)和FI610(阴性); 简化的评价指标为两组数据之差, 第一组数据等于平行3次测试阳性反应液(FI540-FI610)的均值, 第二组数据等于平行的3次测试阴性反应液(FI610-FI540)的均值. 评价指标值越大, 阴性和阳性反应管区别越明显.
本文基于多源数据,采用假设检验方法实证研究了我国两化融合绩效情况,并探索性地分析了两化融合在加强企业价值创造能力、推动行业综合发展、提升经济发展质量等方面绩效产生的机理,得出以下3点结论:
“好运”(Fortuna buona)是“坐着的女子,右臂靠在轮毂上——天球的替代物,左手拿着丰饶角。 ”(图 5)而“厄运”(Fortuna infelice)展现的场景则是:“好在一艘没有舵的船上,帆与树都已被风摧折。”

阳性反应: IMSA对1.2×104拷贝/μL HPV52质粒DNA分子扩增; 阴性反应: IMSA对去核酸酶无菌水(代替DNA模板)扩增.图2 双荧光指示剂在IMSA反应液中的荧光光谱和双荧光显色结果Fig.2 Fluorescence spectra and dual fluorescence chromogenic results of dual fluorescence indicator
ρ(HNB)/(μmol·L-1)反应类型∗荧光强度∗∗测试1测试2测试3差值1∗∗∗差值2差值3差值平均值差值SDCV/%评价指标120FI540(阴)2 2712 3912 081-781-683-471-645158-24.5997FI610(阴)1 4901 7081 610FI540(阳)2 7422 6392 6861 6511 5971 6801 643422.6FI610(阳)1 0911 0421 006340FI540(阴)9568069141 7411 7641 7891 764241.42 953FI610(阴)2 6972 5702 703FI540(阳)2 8632 7682 6741 1641 2031 1981 188211.8FI610(阳)1 6991 5651 476420FI540(阴)5735235512 1302 0122 1522 098763.62 249FI610(阴)2 7032 5352 703FI540(阳)2 4072 2402 072202178751526744.3FI610(阳)2 2052 0621 997
*阳性反应: IMSA对1.2×104拷贝/μL HPV52质粒DNA分子扩增; 阴性反应: IMSA对去核酸酶无菌水(代替模板)进行扩增; **FI540和FI610为蓝光激发5 s时在540,610 nm处荧光强度值; ***差值: 阴性反应=FI610-FI540, 阳性反应=FI540-FI610.
2.2 IMSA检测HPV16和HPV52型的特异性
对7份已知单重感染HPV6,16,18,39,52,58,59亚型的样品DNA进行IMSA特异性分析, 结果如图3所示. 其中: 图3(A)和(C)分别为HPV16检测结果的双荧光显色图和实时荧光曲线; 图3(B)和(D)分别为HPV52检测结果的双荧光显色图和实时荧光曲线. 反应管内橘红色表示检测阴性, 黄绿色表示检测阳性. 由图3(A)可见, 仅添加HPV16 DNA模板的反应管出现阳性扩增(第3孔, 黄绿色); 由图3(B)可见, 仅添加HPV52 DNA模板的反应管出现阳性扩增(第6孔, 黄绿色). 图3(A)和(B)颜色改变反映的扩增情况与图3(C)和(D)实时荧光曲线结果一致.

1. 阴性对照(模板为去核酸酶无菌水); 2. HPV6 ; 3. HPV16; 4. HPV18; 5. HPV39; 6. HPV52; 7. HPV58; 8. HPV 59.图3 IMSA检测HPV16和HPV52型特异性的双荧光显色结果及实时荧光曲线Fig.3 Specificities of dual fluorescence chromogenic results and real-time fluorescence curves of IMSA detection of HPV16 and HPV52
2.3 IMSA检测HPV16和HPV52型的灵敏度

1~8: 1.2×105,1.2×104,1.2×103,600,120,60,6,0拷贝/μL.图4 IMSA检测HPV16和HPV52型灵敏度的双荧光显色结果及实时荧光曲线Fig.4 Sensitivities of dual fluorescence chromogenic results and real-time fluorescence curves of IMSA detection of HPV16 and HPV52
对系列稀释的HPV16和HPV52模板质粒进行IMSA检测, 质粒浓度依次为6,60,120,600,1.2×103,1.2×104,1.2×105拷贝/μL, 结果如图4所示. 由图4(A)可见, DNA拷贝数为6拷贝的反应管及阴性对照管呈橘红色, DNA拷贝数大于等于60拷贝时反应管为黄绿色, 与图4(C)实时荧光曲线记录的结果一致. 由图4(B)可见, 每反应管病毒DNA拷贝数小于等于120拷贝时反应管为橘红色, 每反应管病毒DNA拷贝数大于等于600拷贝时反应管为黄绿色, 与图4(D)实时荧光曲线记录的结果一致. 上述结果表明, 双荧光IMSA方法对HPV16和HPV52检测具有较高的灵敏度, 对HPV16和HPV52的检测下限分别为60拷贝/μL和600拷贝/μL.
2.4 临床标本检测
对103份宫颈刮片标本DNA进行特异性IMSA检测, 结果表明, 17份为HPV阴性, 45份为HPV16阳性(检出率43.69%), 41份为HPV52阳性(检出率39.81%). 采用凯普21种HPV分型试剂盒(PCR+膜杂交法)对103份临床HPV样本检测, 结果表明, 12份为HPV阴性, 45份为HPV16阳性, 41份为HPV52阳性, 5份为其他亚型样本. 可见, 本文检测HPV16和HPV52型的双荧光IMSA方法与临床现有方法相比, 具有极高的符合率.
3 讨 论
高危型HPV的持续感染是引发宫颈癌的关键因素, 因此早期发现HPV感染是预防宫颈癌的关键. HPV16和HPV52是中国人常见的高危HPV亚型, 90%的宫颈癌与HPV16的持续感染有关[14-15]. 本文建立的基于双荧光IMSA方法检测HPV16和HPV52型分别针对HPV16E7基因和HPV52E6基因设计6条特异性引物识别靶序列7个基因位点, 特异性显著高于普通PCR(两条引物与靶序列结合). 同时, 在链置换DNA聚合酶的作用下, 恒温条件下完成反应, 对实验设备的要求较低, 与PCR相比, 反应时间缩短一倍以上. 等温扩增反应极易受气溶胶污染, 导致假阳性[13], 而双荧光指示剂可在反应前加入反应体系, 实验操作简单, 无需开盖检测, 避免了气溶胶污染(若PCR管气密性欠佳, 则可在反应液上方加2 μL石蜡油), 灵敏度比文献[16]用钙黄绿素或单一HNB指示剂方法的提高10倍以上. 这种双荧光指示剂的机理是HNB与 SYBR GreenⅠ介导的荧光均可被455 nm蓝光激发; SYBR GreenⅠ可嵌入双链DNA小沟发出绿色荧光; HNB是一种良好的金属离子指示剂, 与镁离子结合后发出红色荧光. 在IMSA反应过程中不断产生的DNA双链使SYBR GreenⅠ介导的绿色荧光不断增强, 同时IMSA反应过程中不断产生焦磷酸镁的沉淀, 使HNB介导的红色荧光不断减弱. 这种双重荧光信号放大的机制使阴性管和阳性管颜色的差异显著大于基于自然光颜色变化的可视化检测[10], 由于采用稳定的蓝光作为激发光源, 因此受环境因素(如结果读取时周围光线强弱)及主观因素的影响较小. 经优化后双荧光指示剂的终浓度为340 μmol/L HNB和1∶10 000 SYBR GreenⅠ, 双荧光的复合效应使阳性反应管显色为黄绿色, 阴性反应管为橘红色. 本文将繁琐的双荧光评价标准简化为一个评价指标, 有利于双荧光指示剂检测其他病原体或微生物. 由于IMSA反应在60~65 ℃恒温下均可发生, 因此一般的水浴锅即可满足实验要求, 操作简单, 便于推广. 本文建立反应体系的总体积为10 μL, 比常见的25 μL等温反应体系[17]减少试剂消耗60%, 大幅度降低了诊断试剂成本. IMSA方法的灵敏度较高, 对HPV16和HPV52型的检测限分别达60,600拷贝/μL, 基本与实时PCR灵敏度相当[8], 比其他等温扩增方法的灵敏度约高10~20倍[18]. 对已知单重感染HPV6,16,18,39,52,58,59型的临床样本进行特异性分析及对103例临床标本的检测结果与商品化试剂盒检测结果无差异, 表明此方法的特异性高, 未发生交叉反应.
综上所述, 本文建立的应用于HPV16和HPV52分型检测的双荧光IMSA方法为HPV基因分型检测提供了一种敏感、特异、快速、廉价的新方法, 具有推广价值.

