土壤有机质分解的温度敏感性:培养与测定模式
何念鹏,刘 远,徐 丽,温学发,于贵瑞,孙晓敏
1 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室,北京 100101 2 中国科学院大学资源与环境学院, 北京 100049
1 土壤有机质分解及其对温度变化的响应
土壤有机质是陆地生态系统最大的碳库,储存了约1500 Pg有机碳(1 Pg=1015g)[1]。土壤有机质分解所释放的CO2是陆地生态系统与大气间最大的气体交换通量之一(60 Pg C a-1),约为化石燃料燃烧的10倍[2]。大量研究表明:土壤有机质分解速率(R或土壤呼吸速率)与环境温度关系非常密切;在未超过土壤微生物活性最适温度的情况下,R与温度整体呈正相关关系,并可用直线方程、指数方程或幂函数方程等来描述[3]。土壤有机质分解速率及其对温度的响应,长期以来一直是生态学和土壤学研究的核心问题之一。在全球变暖背景下,土壤有机质分解对温度变化的响应很大程度影响着陆地生态系统对全球气候变化反馈效应,成为近二十年研究的热点[4-5]。目前,世界各地的科学家,采用室内培养、野外控制实验、模型模拟等多种途径,揭示土壤有机质分解对温度变化的响应。受篇幅的限制,本文主要聚焦在土壤有机质分解的室内培养方法与测定模式。
2 土壤有机质分解温度敏感性的定义、理论基础与主要计算方法
2.1 土壤温度敏感性定义及其重要性
土壤有机质分解速率(R)对温度变化的响应非常敏感。长期以来,科学家广泛地采用指数方程描述温度对有机质分解的影响,并形成了简单的经验模型,这些模型都主要是从Hoff和Lehfeldt[6]提出的化学反应的温度指数模型中派生而来。在具体操作上,科研人员采用温度敏感性参数(Temperature sensitivity,Q10)来刻画土壤有机质分解对温度变化的响应程度[3,7-8]。通常,Q10是指温度每升高10 ℃状况下,R所增加的倍数;Q10值越大,表明土壤有机质分解对温度变化就越敏感。Q10不仅取决于有机质分子的固有动力学属性,也受到环境条件的限制。
Q10能抽象地描述土壤有机质分解对温度变化的响应,在不同生态类型系统、不同研究间架起了一个规范的和可比较的参数。因此,Q10一经提出就广受关注,并成为过去几十年土壤学和生态学研究的核心内容之一。科学家围绕Q10时空变异和影响机制等开展了大量研究工作[3-4],Q10也成为了绝大多数机理模型的重要参数。然而,由于不同传统培养模式与测试方法的可比性较弱,科学家在短期内难以给机理模型(尤其是大尺度模型)提供一套兼顾时空变异特征的Q10参数,许多模型仍是依据土壤酶动力学特征推导而将Q10设定为2.0或1.5[9-10]。根据IPCC第五次评估报告,过去130年全球气温升高约0.85 ℃,并且全球气温升高的趋势仍会继续[5]。因此,气候变暖如何影响土壤有机质分解,以及陆地生态系统如何响应气候变暖就倍受关注。鉴于科学家已经对Q10影响因素、控制机制和区域变异等进行了多方面的综述[3-4],本文重点探讨室内培养与测试方法对Q10的影响。
2.2 Q10时空变异与影响机制研究中的重要理论基础
为了更好地理解培养模式和测试方法的影响,首先回顾一下在Q10时空变异与影响机制研究的理论基础;其中,两个非常重要的理论基础是Arrhenius方程和Michaelis-Menten方程。
(1)Arrhenius方程
早期,人们采用从经典化学反应中衍生出来的指数方程来描述土壤有机质分解与温度变化之间的关系,但后来Arrhenius指出即使放热的化学反应,也需要一点“推力”来促使反应发生,这个“推力”叫做“活化能”。因此,Arrhenius[11]于1889年根据动力学原理发展了Arrhenius方程:
(1)
式中,k是反应速率常数,A是拟合参数,Ea是反应所需要的活化能(J-1mol-1),R是气体常数(8.314 K-1mol-1),T是开氏温度[3]。
Arrhenius方程的内涵: 具有复杂分子特性的有机质(如:难分解有机质、复杂有机质,以及矿物吸附有机质)具有较低的分解速率,分解过程需要更高的活化能,因此具有更大的Q10值。换句话说:随着温度增加,具有足够能量参与反应的分子增加相对减少,导致温度敏感性降低[3]。此外,Arrhenius方程表明温度敏感性随着有机质稳定性的增加而增加,因为稳定的底物需要更高的活化能而变得不活跃。这也意味着稳定的碳库比易分解的碳库对温度变化更加敏感。
Arrhenius方程的局限性:虽然Arrhenius方程在许多研究中都被应用或证明,但是只有在底物有效性不受限制的条件下最为适用,此时获得的温度敏感性被称为土壤的固有温度敏感性[3]。然而,土壤有机质分解还经常受到土壤水分和底物有效性等因素的影响,当土壤底物有效性较低或底物严重受限制的条件下,Arrhenius方程不再适用,此时的温度敏感性被称为表观温度敏感性[3];随着研究的深入,科研人员提出米氏方程(Michaelis-Menten equation)来补充解释该现象。
(2)Michaelis-Menten方程
RS=Vmax×[S]/(Km+[S])
(2)
式中,[S]是底物有效性,也是在酶活性位点处的底物浓度;Vmax是给定温度下的最大反应速率;Km是米氏常数[11],代表酶与底物的亲和能力,用最大速率一半(Vmax/2)时的底物浓度表示,也是反映温度敏感性的重要参数[12-13]。
米氏方程的理论基础:Km和Vmax均是对温度变化敏感的参数,当底物浓度[S]充足,并且温度没有超过酶活性的最适温度时,Km对反应的影响不重要,这时Vmax对温度的响应决定了反应速率的温度敏感性。这一过程只取决于基于Arrhenius方程的酶催化作用。Vmax随着温度升高逐渐升高。然而,当底物有效性较低时(当S与Km大致相当或远低于Km),Km成为一个重要影响因子,这时分解速率取决于酶和底物的浓度。由于Km和Vmax均随着温度升高而增加,因此Km和Vmax的温度敏感性会相互抵消[3]。这种“抵消作用”在底物浓度很低的时候尤为明显。Michaelis-Menten方程可以更好地解释外来物质输入或底物消耗情景下的Q10变化。
2.3 Q10主要计算方法
Q10计算方法主要有以下几种:
(1)指数方程推算法
经验模型认为土壤有机质分解速率随温度增加呈指数上升。
RS=A×ebT
(3)
Q10=e10b
(4)
式中,RS是土壤有机质分解速率,A是指数方程拟合参数,b是温度敏感性系数,T是培养温度。
(2)直接定义法
根据Q10定义,在相同的培养时间计算不同培养温度下土壤有机质分解速率的比值。
(5)
式中,T1和T2是培养温度,R1和R2分别是温度T1和T2下土壤有机质的分解速率。
(3)等碳库法
在长期培养条件下,高温会促进土壤快速分解,底物消耗较大;因此,在相同培养时间下,不同培养温度下的底物质量存在较大差异。为了克服等时间方法造成的底物消耗问题,Conant等[14]提出利用不同培养温度下分解相同比例的碳所用时间的比值来表示Q10。
(6)
式中,T1和T2是培养温度,t1和t2分别是在温度T1和T2下分解相同土壤有机碳所需要的时间。该方法有两个重要的前提假设:1)在不同培养温度下,参与反应的微生物类群理论上是相同的;2)在不同培养温度下,参与分解的有机质组分的化学特性在时间序列上都是从易分解到难分解。
(4)模型方法
利用一阶动力学的单库或多库模型拟合土壤有机质分解累积曲线,得到拟合的温度敏感性参数k,然后根据公式7计算Q10[15]。
(7)
式中,Ccum是累积分解释放的CO2量,C0是土壤初始有机碳含量,t是培养时间,Q10和k是模型拟合的参数,T1和T2是培养温度。
3 Q10研究的传统室内培养与测试模式及其优缺点
科研人员以土壤有机质分解对温度变化的响应特征、Q10计算方法和基本理论为基础,设计并发展了一系列经典的室内培养与测试模式,并被广泛应用。
3.1 恒温培养+间断测定模式(模式A)
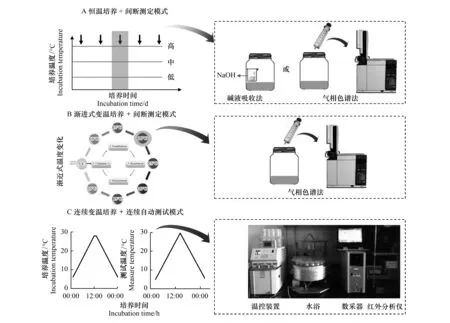
图1 土壤有机质温度敏感性研究的3种主要培养与测试模式Fig.1 Three models of incubation and measurement modes for the studies of the temperature sensitivity of soil organic matter (SOM) decomposition
室内培养实验中,传统的Q10研究大多采用了恒温培养+间断测试模式[4,14](图1A)。例如,Conant等采用这种模式测定了不同土地利用方式下土壤有机质的温度敏感性的变化,结果发现温度敏感性与土壤有机质质量密切相关[4]。通常,根据不同实验目的或实验室条件,研究人员先设置3—6个恒定温度对土壤进行培养(如5、10、15、20、25、30 ℃等),然后在天、周、月间隔,测定RS;在测试方法上,大多采用碱液吸收法或气相色谱法进行测定,然后再利用所测定的RS和对应温度计算Q10。该模式最大优点是操作简单、对仪器要求不高,几乎所有实验室均具备该模式所需条件。
然而,从理论和实践角度来看,模式A存在明显缺陷,一定程度上会影响实验结论的准确性和可靠性。具体概括如下:1)在恒定温度下培养,土壤微生物可能会对特定温度产生适应性,从而对实验结果产生影响。研究发现,在不同恒定温度培养下,土壤微生物的结构和功能具有明显的分化和差异[16]。2)恒定培养温度会导致不同处理样品间的底物消耗不一致,尤其是高温vs.低温和短期vs.长期,可通过改变底物有效性而对实验结果产生明显影响。例如,将土壤样品分别在5、15、25 ℃培养一段时间,25℃培养会导致土壤样品中易分解组分的快速消耗,甚至引起活性底物供应不足;由于长期高温培养时会导致土壤底物消耗很大,从而低估Q10。3)由于模式A方法本身的限制,使得大多数研究只能采用较少的温度系列(3—5个),导致用于计算Q10的不同温度的数据偏少。由于计算过程中大多是采用曲线拟合,较少的温度处理水平会影响Q10拟合精度。4)模式A测试过程比较费时费力,难以同时或对大批样品进行测试。
3.2 渐近式变温培养+间断测定模式(模式B)
为了弥补模式A的不足,特别是克服模式A从方法及机理上难以准确估算Q10的问题,近年来科研人员发展了渐进式变温培养+间断测定模式[8](图1B)。例如,Fang等采用这种渐近式变温培养模式研究了不同有机质组分温度敏感性的差异,发现易分解有机质和难分解有机质对温度变化具有相同的敏感性[8]。另外,Ding等也采用该方式研究了不同高寒草地生态系统土壤有机质分解温度敏感性的区域变异及其控制机制[17]。简单而言,该模式对同一批土壤样品采用逐渐升温,然后再降温的培养方式,同时配套低频度的间断测定模式测定土壤有机质分解速率。首先,将土壤样品在适宜的温度下培养3—7 d,实现土壤样品活化并防止脉冲式效应对实验结果的干扰。随后,采用气象色谱或者CO2红外气体分析仪的方法测定土壤样品的分解速率,在完成特定温度的测试任务后,将培养温度升高到预先设定的温度,并在土壤样品适应和稳定一段时间后,测定该温度状况下的土壤有机质分解速率;依序升温直到预定的最高温度,随后再采用逆向降温模式进行随后的培养与测试[17-19]。
该模式较好地克服了模式A的前两个缺陷,即土壤微生物对恒定培养温度的适应性以及不同培养温度底物消耗不均的缺点,是对传统方法学的重要改进。然而,在实际操作过程中,模式B仍然存在一些问题:1)该方法更适用于短期的培养实验,难以开展长期测试。例如,对同一批样品,我们很难准确确定底物消耗成为限制性条件时的培养时间,我们只能凭借经验假设短期内(如1—7d)不会出现底物供应受限;因此,模式B难以适用于底物贫瘠或长期培养样品。2)在测定方法上,模式B依然采用传统气相色谱法(CO2红外分析法)的手动测试模式;同时,由于这种变温过程较为繁琐,导致一般温度处理系列约为4—6个,难以克服因数据量不足而引起的Q10误差。3)变温培养及测试过程较为繁琐、费时费力,难以同时对大量样品进行测试。
4 Q10研究的新一代培养与测试模式(模式C)
毋庸置疑,近年来有关Q10研究的蓬勃发展,模式A和模式B起到了非常大的推动作用。如第3节中的讨论,它们在理论和操作上仍然存在缺陷,有待进一步改进。因此,改进和发展新Q10的培养和测试模式,不仅有助于推动Q10研究朝着精准化方向发展,还有助于拓展和深化Q10的机理研究。
在Cheng和Virginia[20]和He等[21]研究的基础上,我们发展了连续变温培养结合连续-高频土壤微生物呼吸速率的测定装置与技术,催生了Q10研究的连续变温培养+连续自动测试的新模式(图1, 模式C)[22-25]。模式C充分利用连续变温培养+连续-高频土壤微生物呼吸测定装置联用的优势,实现了对土壤样品连续变温培养,基本克服了恒温培养模式(模式A)土壤微生物对特定培养温度的适应性和底物消耗不均的重要缺陷。模式C通过开发连续-高频土壤微生物呼吸测定系统,可结合培养过程的温度特征,在升/降温过程中对每个样品进行连续的、高频度的测试(2—20min/次),通过测定更多温度下土壤微生物呼吸速率来提高Q10的拟合精度。同时,模式的培养与测试过程非常简单快捷,有利于开展大量样品测试或大尺度联网研究。然而,模式C对实验设备投入要求较高,亟需开发成套的商业设备来推动其广泛的应用。目前,基于He等[21]原型机的基础上,已经开发了商业化的定型产品并公开销售(Pri- 8800, 原生态有限公司, 北京),为大面积推广模式C提供了设备和技术保障。通过上述分析,不论是从基本理论还是操作角度,模式C均优于模式A和B,具有非常广泛的应用前景。
5 连续变温培养+连续自动测试模式的应用前景展望
连续变温培养+连续自动测试模式(模式C)基本克服了传统的Q10研究的主要缺陷(注:它仍然无法解决室内培养与野外状况的差异,但该问题不属于本文讨论范畴),并具有连续变温培养+连续自动测试的特点,具备自动、连续、快速的特点。首先,模式C能为大多数实验室提供一种快速测试土壤微生物呼吸速率的通用途径和设备,可替代传统的碱液吸收法和气相色谱法[26- 27]。
此外,模式C也能在如下方面开展一系列创新性研究:1)利用其自动、连续、快速的特点,开展区域尺度的联网研究,揭示不同区域或植被类型的Q10变异及其控制机制[25]。受传统培养和测试方法的影响,研究人员很难开展类似的研究,虽然整合分析能一定程度解决这个问题,但也存在不同实验处理条件和实验测定方法造成的高不确定性问题。2)开展Q10对连续温度变化过程响应研究,更真实的模拟温度变化情况,从而揭示土壤微生物呼吸对温度变化的响应机制[24]。受传统方法的限制,当前大多数研究均在小时、天、周尺度来开展,并没有揭示真实的温度日动态。3)更好地开展土壤微生物对水分或资源快速变化情景下的研究[23]。例如,降水脉冲是干旱-半干旱区的常见现象,土壤微生物活性(碳矿化速率或氮矿化速率)对水分可获得性的响应一直是非常重要又极具挑战性的科学问题;类似的,土壤微生物对外界资源脉冲式供应的响应或激发效应也是近期研究热点。随着模式C的广泛使用与进一步改进,尤其是与13C分析设备相结合,相信会具有更多的应用前景。
6 结论
本文结合Q10定义、基本理论和计算方法,探讨了当前有关Q10研究培养和测定模式的优缺点;尤其是结合最近新发展的连续变温培养+连续自动测试模式,前瞻性地提出了一系列应用前景。此外,本文希望能呼吁更多国内年轻科研人员对基本方法、设备改进的重视,更好更快地推动原创性研究。

