酚酸类物质对苜蓿种子萌发的化感作用研究
陶 茸,尹国丽,师尚礼
(甘肃农业大学草业学院/草业生态系统教育部重点实验室/甘肃省草业工程实验室/中-美 草地畜牧业可持续发展研究中心,甘肃 兰州 730070)
苜蓿(Medicagosativa)做为优质多年生豆科牧草,具有一次种植、多年收获、产草量高、营养丰富、适口性好等特点,是优质蛋白质饲料的重要来源,有“牧草之王”的美称。但种植过苜蓿的土壤很难重茬种植[1]。化感作用(allelopathy) 是植物将其在代谢活动中所产生的化感物质,通过茎叶挥发、茎叶淋溶、根系分泌以及植物残株的腐败降解等途径释放到环境中,进而对周围其他植物或微生物造成有利或不利的影响[2]。酚酸是一类重要的化感物质,由于其相对分子质量小,结构稳定,因不易降解而累积在土壤中,进而影响作物生长,是引起苜蓿连作障碍的一类主要化合物[3-6]。Abdul 等[7]研究发现,苜蓿根系和残茬能够分泌酚酸类物质,如咖啡酸、绿原酸、香豆酸、羟基苯甲酸和阿魏酸。也有研究表明,苜蓿的自毒物质主要是香豆素、绿原酸、水杨酸等酚类物质和皂甙两大类[8]。
近几年,主要对紫花苜蓿生长部位及残茬的浸提液对紫花苜蓿自毒效应及对杂草、作物、土壤等化感作用方面进行了研究[9-12]。通过研究外源酚酸对莴苣幼苗、人参种子萌发和三七、小麦的化感作用,揭示了酚酸类物质对部分植物生长发育的影响[6,13-14],但紫花苜蓿中的主要酚酸类物质—对羟基苯甲酸、绿原酸、香豆素、阿魏酸和咖啡酸对其种子萌发及幼苗生长的影响系统报道较少。试验以紫花苜蓿为受体材料,评价对羟基苯甲酸、绿原酸、香豆素等5种酚酸类化合物对其种子萌发及幼苗的化感作用,初步筛选出对苜蓿化感抑制作用较强的酚酸类物质,以期为酚酸类化合物对紫花苜蓿的化感作用机理研究奠定基础。
1 材料和方法
1.1 材料
供试的甘农9号紫花苜蓿(Medicagosativacv.Gannong No.9),由甘肃农业大学草业学院草业生态系统教育部重点实验室提供。
药剂为(A)对羟基苯甲酸、(B)绿原酸、(C)香豆素、(D)阿魏酸、(E)咖啡酸均为分析纯品,购于上海阿拉丁生化科技股份有限公司。
1.2 方法
称取(A)对羟基苯甲酸、(B)绿原酸、(C)香豆素、(D)阿魏酸、(E)咖啡酸各1 g分别溶于4 mL无水乙醇中,定容至1 L,配制成1.00 mg/mL 母液,放入4℃冰箱备用(分别以A、B、C、D、E表示)。将母液稀释至500、50、5、0.5 mg/L的溶液(分别以A4、A3、A2、A1;B4、B3、B2、B1;C4…E1表示,表1),采用玻璃培养皿法。在直径9 cm 的玻璃培养皿底部铺两层灭菌滤纸,分别均匀摆放灭菌(用75%酒精消毒3~5 min 后再用蒸馏水冲洗种子4~6次)处理的苜蓿种子30粒,加入5 mL不同浓度的酚酸溶液(500、50、5、0.5 mg/L),每个处理重复3次,置于光周期25℃、12 h,暗周期20℃、12 h的人工气候箱中发芽。种子发芽的标准为胚根突破种皮1~2 mm[15-17],每两天补充相应的酚酸溶液,对照添加蒸馏水2 mL,每天定时记录发芽种子数。第7 d统计苜蓿的发芽率、发芽势(经预试验,在该试验条件下,培养3 d时苜蓿达到发芽高峰期,培养至4 d后不再萌发,故采用培养3 d的数据测定其发芽势)、胚根长和胚轴长。5 d 后切取主根根端1 cm根段,在ZEISS Observer D1体式显微镜下,Axio Cam MRC5型显微数码摄影仪系统10倍放大视野下观察苜蓿根毛形态并拍照,用显微测量软件测量根毛长度。每组处理测量5个根段,每根段上测量10根根毛,计算根毛的平均长度,重复3 次[18]。

表1 外源酚酸处理浓度梯度
1.3 数据统计与分析
发芽率(GR,%)=发芽种子数/供试种子总数×100%
发芽势(GP,%)=发芽初期(3d)发芽的种子数/供试种子数×100%
苜蓿种子简易活力指数(SVI,%)=发芽率×幼苗长度×100%
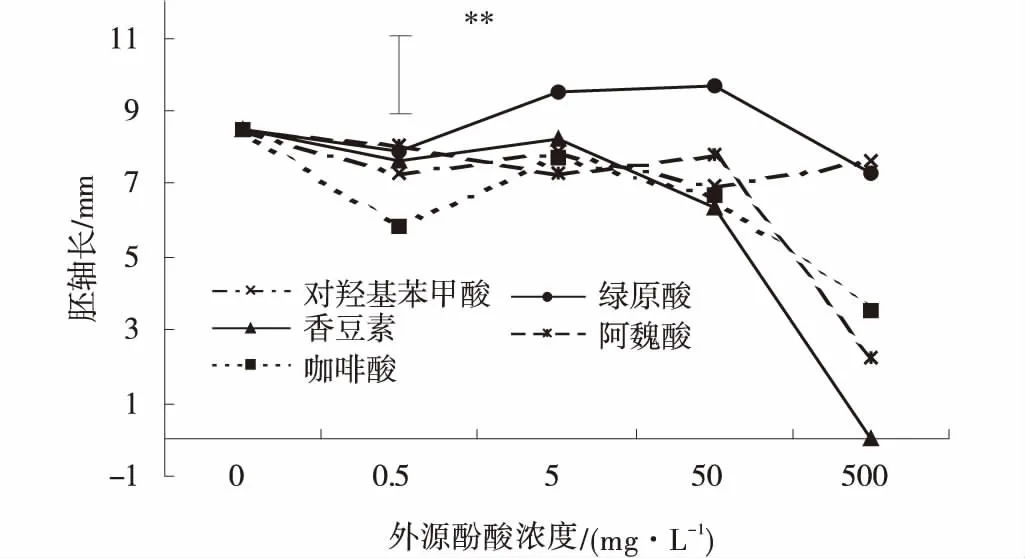
化感效应指数(RI)=(T-C)/T(T≥C)或RI=(T-C)/C(T 式中:C为对照值,T为处理值。当RI≥0时,为促进作用;当RI≤0时,为抑制作用,RI绝对值的大小表示化感作用强度。利用化感综合效应指数(SE)表示化感自毒作用的综合效应,SE 是供体对同一受体多个测试项目的化感效应敏感指数RI的算术平均值[19-20]。 数据采用GENSTAT 12.1 统计分析软件进行数据统计分析,采用GNOVA方法进行多重比较。用Office 2010应用软件处理数据,并制作图表[21]。 不同处理之间,苜蓿种子发芽率、发芽势和种子简易活力均差异性显著(P<0.05)。5种酚酸对苜蓿种子简易活力指数作用呈现出低浓度促进、高浓度抑制的效应,在苜蓿种子发芽率和发芽势的指标中,对羟基苯甲酸、绿原酸和香豆素处理表现出低浓度促进、高浓度抑制。其中香豆素处理的低促高抑现象最为明显,当其浓度为0.5 mg/L时,种子发芽率、发芽势分别为96.67%、95.56%,比对照分别高3.34%、4.45%,随着香豆素处理剂量的增加,苜蓿种子的各项指标均呈下降趋势,当浓度增大至500 mg/L,种子基本不萌发,表面发黑、腐烂严重,表明C处理对苜蓿种子萌发具有较强的抑制作用,且抑制效应随处理浓度的升高而显著增强。咖啡酸对苜蓿种子活力的影响与香豆素相似,也表现出显著的抑制效应,但抑制幅度较为平缓,添加5 mg/L剂量的咖啡酸,苜蓿种子的发芽率和简易活力指数均达到最大,分别为93.33%和824.89%,低于或高于此浓度均表现出抑制现象。 根毛是植物体吸收水分和养分的主要部位,同时也是根环境胁迫信号传递的起始部位,其在逆境下的形态、特征和表现是植物根系有效吸收和利用土壤水分及养分的直接适应特征[18]。结果表明,不同处理之间,苜蓿根毛生长均差异性显著(P<0.05),咖啡酸处理对苜蓿根毛生长明显受抑,0.5 mg/L(低剂量)处理时根毛短且细,同时出现弯曲、缠结等现象(图1-B),随着处理浓度的增加,该现象更为明显,在500 mg/L(高剂量)处理时,苜蓿根腐烂严重,根毛几乎未发育(图1-C)。对羟基苯甲酸、香豆素、阿魏酸处理对苜蓿根毛生长均呈现低浓度促进、高浓度抑制的效应,其中香豆素处理表现尤为明显,当其处理浓度低于5 mg/L时,根毛长度最长,达到729.33 μm,明显促进苜蓿根毛的生长发育,不仅数量有所增加,且长度增长,直径增大;高于5 mg/L时明显抑制根毛生长,数量少,长度短,且呈丝状,缠结现象严重。综上,5种酚酸处理对根毛生长发育的抑制效应从强到弱依次为咖啡酸、阿魏酸、香豆素、绿原酸、对羟基苯甲酸(表2)。 表2 外源酚酸处理下苜蓿种子的活力及根毛发育 注:s.e.m为平均值的标准误,**P<0.01,ns表示不显著,下同 图1 外源酚酸处理下苜蓿根毛的发育Fig.1 The effects of exogenous phenolic acid on the root hair development of alfalfa 注:A.发育正常的根毛;B.缠结严重的根毛;C.根毛几乎未发育 不同处理之间,苜蓿种子胚根的生长均差异显著(P<0.05),同种酚酸类物质对苜蓿种子胚根生长的化感作用强度与浓度有密切的关系,其中香豆素处理呈现出明显的高浓度抑制趋势。高于0.5 mg/L的香豆素处理,苜蓿种子胚根长度呈现急剧下降趋势,其处理浓度增至500 mg/L时,胚根几乎没有萌发,长度为0。50 mg/L的对羟基苯甲酸处理明显促进了苜蓿胚根生长,长度最长。高于50 mg/L的对羟基苯甲酸、咖啡酸和阿魏酸处理与对照相比明显抑制苜蓿种子胚根的生长,胚根长度明显降低(图2)。综上,香豆素处理对苜蓿胚根生长的抑制效应最强,其次是阿魏酸处理,对羟基苯甲酸处理最弱。 图2 外源酚酸处理下紫花苜蓿的胚根长Fig.2 The effects of exogenous phenolic acid on hypocotyl growth of alfalfa 不同处理之间,苜蓿种子胚轴的生长均差异显著(P<0.05),5 mg/L和50 mg/L绿原酸处理的苜蓿胚轴长度高于对照,其余酚酸类物质处理对紫花苜蓿胚轴生长的影响主要表现为抑制效应,高浓度抑制作用更明显。0.5 mg/L处理下,咖啡酸对苜蓿胚轴生长的抑制效应最强,其余处理基本一致。处理浓度高于50 mg/L时,香豆素、阿魏酸和咖啡酸处理的苜蓿种子胚轴长度急剧降低,处理浓度增至500 mg/L时,香豆素处理的种子未萌发,胚轴长度为0。对羟基苯甲酸处理对苜蓿种子胚轴生长的影响效应较弱(图3)。 图3 外源酚酸处理下紫花苜蓿种子的胚轴长Fig.3 The effects of exogenous phenolic acid on radicle growth of alfalfa 5种酚酸类物质对苜蓿种子萌发的化感综合效应总体表现为抑制,香豆素处理的化感综合效应SE值为-0.356,抑制效应最强,其次是咖啡酸处理,对羟基苯甲酸抑制效应最弱。除根毛长度外,香豆素处理对苜蓿种子发芽率、发芽势、种子简易活力和胚轴、胚根长度抑制作用均最强,咖啡酸对苜蓿种子根毛生长抑制作用最强,化感综合效应达-0.587;对羟基苯甲酸处理对苜蓿种子的发芽率、发芽势和种子简易活力在一定程度上呈现促进作用,阿魏酸对苜蓿种子胚轴长度和简易活力在一定程度上呈现促进作用。各酚酸类物质对苜蓿种子萌发化感抑制效应从强至弱依次为:香豆素、咖啡酸、阿魏酸、绿原酸、对羟基苯甲酸(表3)。 表3 酚酸类物质对苜蓿种子萌发的化感效应指数 化感物质的处理浓度不同,对受体发芽的抑制作用不同[7],研究表明,酚酸类化感物质能够影响植物生长,是引起农业生产中连作障碍的主要因素之一[5-6]。选取了苜蓿中的主要5种酚酸类物质为试验处理,证实了这些酚酸类化合物对苜蓿种子的生长均具有化感自毒作用,其化感作用总体表现为抑制的趋势。白丽荣等[4]研究了紫花苜蓿提取液显著抑制黄顶菊种子的萌发和幼苗的发育,浓度越高其化感抑制作用越强;王希等[12]研究了苜蓿水浸液对芽长和根长的抑制作用大于对发芽率的抑制作用,与本研究的对羟基苯甲酸、香豆素、阿魏酸和咖啡酸处理结果一致。另外试验明确了香豆素处理对苜蓿种子萌发具有较强的抑制作用,而对羟基苯甲酸对苜蓿种子萌发的抑制作用较弱,这与赵瑞林[10]研究的对羟基苯甲酸对苜蓿种子萌发具有显著的抑制作用,与对照差异显著等结果不同,可能是由于本实验材料及处理浓度不同所导致。 根毛对外界环境中影响因子的响应十分敏感,化感物质同样也会影响到植物根毛的生长,如黄花蒿(Artemisiaannua)水浸提液对小麦根毛的生长具有抑制[22],土荆芥挥发油对玉米根毛发育有显著的抑制[19]。试验中咖啡酸处理明显抑制苜蓿根毛的生长,该处理苜蓿根毛短且细,弯曲、缠结现象严重,随着处理浓度的增加,苜蓿根不能正常生长,腐烂严重,根毛几乎完全消失,与对照呈显著差异,5组处理对根毛长度的抑制效应强弱顺序依次是E>D>C>B>A,即咖啡酸对苜蓿根毛生长的化感抑制作用最强。研究发现,不同酚酸类物质对苜蓿胚根和胚轴的生长存在差异,香豆素处理对苜蓿胚根生长的抑制作用最强,其次是阿魏酸,对羟基苯甲酸最弱,绿原酸对苜蓿种子胚轴生长有一定程度的促进作用,其余4种酚酸对其有不同程度的抑制作用。而且不同浓度下各酚酸类物质的化感效应指数的强度顺序也存在差异,这可能是不同酚酸类物质在苜蓿细胞中的作用机理存在差异或是苜蓿在不同酚酸类物质的作用下产生其他次生物质所致。莴苣幼苗在高浓度酚酸的胁迫下,其体内活性氧大量积累,高浓度的活性氧对莴苣幼苗细胞膜结构等具有显著的破坏作用,进而导致细胞活力降低甚至凋亡,最终抑制植物生长[6]。苯甲酸、对羟基苯甲酸和水杨酸对烟苗根系发育、光合作用有抑制作用[23]。苯甲酸和肉桂酸的施用打破了番茄根部保护酶系统原有的平衡,造成了根系的膜质过氧化[24]。 在0~500 mg/L的浓度处理范围内,随着5种外源酚酸处理浓度的不断增加,对苜蓿种子萌发及幼苗生长的抑制作用不断增强。其中香豆素和咖啡酸处理对苜蓿种子萌发的化感综合效应指数分别为-0.356和-0.240,具有较强的抑制作用,高于50 mg/L的香豆素与咖啡酸处理和500 mg/L的阿魏酸显著抑制苜蓿种子萌发。对羟基苯甲酸对苜蓿种子萌发的化感综合效应指数为-0.026,与其他4种酚酸相比抑制作用最弱。5种酚酸类物质对苜蓿种子萌发的化感抑制效应强弱顺序为:香豆素>咖啡酸>阿魏酸>绿原酸>对羟基苯甲酸。笔者仅从不同浓度的5种酚酸处理对苜蓿种子萌发的各项指标呈现出的不同受抑规律进行研究,他们对苜蓿的其他作用潜力及化感自毒作用机理还有待进一步深入研究,以便为消除苜蓿连作障碍提供新思路。2 结果与分析
2.1 外源酚酸对苜蓿种子活力和根毛发育的影响


2.2 酚酸类物质对苜蓿种子胚根生长的影响

2.3 酚酸类物质对苜蓿种子胚轴生长的影响
2.4 酚酸类物质对苜蓿种子萌发的化感综合效应

3 讨论
4 结论

