施氮对武功山山地草甸土壤氮素含量、根系生长及氮素吸收的影响
侯晓娟,余 飞,崔 诚,李 凯,李 志,张学玲,郭晓敏,牛德奎
(江西农业大学园林与艺术学院,江西 南昌 330045)
氮素不仅是土壤肥力的重要表征,同时也是影响植物生长发育的关键因素。大量施用氮肥超出了土壤固氮容量以及植物氮素吸收能力,氮素会大量淋溶从而污染地下水源和威胁人类健康,同时也造成资源浪费[1]。
根系是植物吸收水分和养分的主要器官,其形态特征及时空分布会对植物的生长产生重要影响[2],也是影响植物氮素吸收的重要因素[3]。已有研究表明[4],较大的根系生物量及穿插较深的根系获取土壤氮素的能力也较强。提高植物根系对氮素的截获和吸收能力,不仅可以促进植物的生长,同时也能够提高氮肥利用效率,避免地下水源的污染。此外,根系的生长发育及形态特征也会随土壤生态因子如土壤水分、土壤养分状况的变化而变化[5]。在养分胁迫条件下根系形态的小型化会导致植物地上部变弱小,削弱了优势种的优势作用,从而发生退化演替并且被其他物种所替代[6]。Bahman和Jerry[7]的研究指出,氮素缺乏情况下,植物根系会吸收利用较多的同化产物来形成较大的根系从而吸收较多的氮素营养。在高氮供应情况下,根系生物量减少,同时其向深层土壤穿插的能力也减弱,从而降低对氮素的吸收利用能力[8]。
武功山山地草甸作为南方陆地生态系统分布最广的草地生态系统类型之一,在调节物质与能量循环,维护生态平衡方面起着重要作用[9]。近年来由于旅游业等人为干扰的不断增加使武功山山地草甸受到严重破坏,退化和破碎化态势日趋严重[10]。目前,对武功山退化草甸的研究主要集中在植物多样性、土壤养分时空变异、土壤碳氮循环、土壤水文等方面[11-14],而对武功山草甸植被根系生长动态、分布规律对氮素添加的响应及其与土壤氮素运移之间关系的研究鲜有报道。本研究以武功山草甸为研究对象,拟探讨不同施氮水平下土壤氮素在植被生育期内变化规律和施氮对草甸植被根系生长及其氮素吸收利用的影响,以期为武功山草甸保护及恢复提供理论依据。
1 材料与方法
1.1 研究区概况
本研究于2016年4-11月在武功山主峰金顶(平地)进行。武功山地处江西西部,主峰金顶(27°27′24″ N, 114°10′24″ E)海拔1 900 m。由于旅游业的开发,金顶草甸被严重践踏,是草甸退化严重发展的区域之一。该区属于亚热带季风湿润性气候,四季分明,年均降水量1 700 mm,主要集中在1-4月,空气相对湿度80%左右,年均气温14~16 ℃[15]。
研究区草地类型属于亚热带山地草甸,植被覆盖率达90%,草地上分布着优势种芒(Miscanthussinensis)以及伴生种刺芒野古草(Arundinellasetosa)、两歧飘拂草(Fimbristylisdichotoma)、中华薹草(Carexchinensis)等草种,其中芒相对盖度占85%左右。土壤是花岗岩和片麻岩发育而来的山地草甸土,质地为砂壤土,有机质含量为79.1 g·kg-1,全氮含量为2.64 g·kg-1,碱解氮含量为146 g·kg-1。
1.2 研究方法
1.2.1试验设计试验小区面积为20 m×20 m,随机区组设计,设不施肥(N0)及施氮量75 kg·hm-2(N1)、150 kg·hm-2(N2)、300 kg·hm-2(N3)4个处理,3次重复,各小区间有3 m的缓冲带,小区四角用木桩进行标记。在2016年4月15日用缺口重耙对草地进行松土处理,耙深4 cm左右,然后将尿素一次性施入土壤中。
1.2.2微根管安装于2015年10月将长度80 cm、内径5 cm的微根管以45°倾斜角埋入地下,垂直深度为40 cm,每小区安装3根,共计36根。安装时用与微根管直径相当的钢钻打好孔,将微根管插入,在空隙处填好土壤,防止管壁凝结水汽造成扫描图像不清晰。为减少光和热量对微根管的影响,安装后将露出地面的微根管部分用锡箔纸缠绕,顶端加盖密封,防止灰尘和小动物进入。在微根管外壁进行标记,确保每次都能对同一位置根系进行图像扫描。
1.2.3根系参数测定根长的测定采用微根管法。2016年5-11月的每月中旬用BTC微根窗根系生态监测系统(BTC I-CAP3.0产地:美国 Bartz公司)对根系进行拍摄,然后通过WinRHIZOTRON MF 2012软件进行根长分析。同时,进行植被地上部与地下部取样,测定植被生物量。根系生物量测定:分0-20和20-40 cm两土层用根钻(根钻直径为5 cm)钻取根样,每小区按“S”型均匀布设5点,相同土层的根样混合为一个样,共计取样168个(4个处理×3次重复×2个土层×7个月=168个土样)。将钻取的土样编号后放入自封袋带回实验室进行根系清洗,用孔径0.1 mm的土筛反复冲洗直至清洗干净,放入80 ℃烘箱中,烘干24 h到恒重,测定根系生物量。地上植被生物量的测定:每个小区随机选取3个0.25 m×0.25 m的样方,然后齐地面刈割样方内草甸植被,每小区3个样方植株样混合为一个植株样,共计取样84个(4个处理×3次重复×7个月=84个植株样)。将所取植株样编号带回实验室105 ℃下杀青0.5 h,70 ℃烘干至恒重,测定地上部生物量。植株与根系样品粉碎后采用半微量开氏法测定植株与根系全氮含量[16]。
1.2.4土样采集及测定土壤采样方法与根系采集方法相同,共计取样168个,同时测定土壤容重。将所取土样带回实验室风干,研磨过0.25 mm筛用于壤养分的测定。全氮采用半微量开氏法测定,碱解氮采用碱解氮扩散法测定,土壤容重采用环刀法测定[16]。
1.3 数据处理
根系氮积累量=根系干重×根系含氮量;
氮素利用率=(施氮区植株氮素含量-不施氮区植株氮素含量)/施氮量。
根据土壤容重及施氮量计算出各个处理每立方米土壤中施氮量,进行根系参数(生物量密度与根长密度)与不同施氮水平的相关性分析。
所有数据通过Microsoft Excel 2016作图,用SPSS 19.0统计软件对土壤氮素、根系及地上部生物量、根长、氮素积累量、氮素利用率进行方差分析,对施氮量与根系生物量、根长进行回归分析。
2 结果与分析
2.1 施氮量对草甸土壤氮素含量时空变化的影响
在0-20 cm土层,各施氮处理土壤全氮含量随时间的变化均呈先降低后升高的趋势。土壤全氮含量在整个生育期内随着施氮量的增加而增加(图1),N0、N1、N2、N3处理全生育期内土壤全氮的平均含量分别为2.87、2.89、2.93和2.94 g·kg-1,各处理在整个生育期内全氮含量均无显著差异(P>0.05)。在20-40 cm土层,各施氮处理土壤全氮含量随时间的变化呈轻微的波动趋势。N0、N1、N2、N3处理全生育期内土壤全氮的平均含量分别为2.35、2.39、2.42和2.41 g·kg-1。与0-20 cm土层相同,各施氮处理在整个生育期内全氮含量也均无显著差异。
0-20 cm土层范围内,各处理碱解氮含量在全生育期内变化趋势与0-20 cm土层全氮相似,即随着时间的推移碱解氮呈现先降低后升高的“凹”型趋势。在整个生育期内随着施氮量的增加碱解氮含量呈现递增趋势,其中处理N3>N2>N1>N0(P<0.05)。N0、N1、N2、N3处理全生育期内土壤碱解氮的平均含量分别为130、161、178和187 mg·kg-1。在20-40 cm土层范围内,整个生育期内同0-20 cm土层内碱解氮变化规律相似,即随着施氮水平的提高,碱解氮含量也在逐渐升高,其中N3>N2(P<0.05),N1>N0(P<0.05),除11月份外,其余月份N2处理碱解氮含量均显著高于N1处理。N0、N1、N2、N3处理全生育期内20-40 cm土层土壤碱解氮的平均含量分别为159、190、221和261 mg·kg-1。
2.2 施氮量对根系生物量密度和根长密度的影响
根系生物量密度随生育期的推进而升高,最高值出现在旺盛生长期(7-9月),然后又逐渐下降(图2)。0-20 cm土层,植被根系生物量密度在整个生育期内总体上随着施氮量的增加而增加,除了5月外,施氮肥处理植被根系生物量密度显著高于不施氮处理(P<0.05)。N0、N1、N2、N3处理全生育期内植被根系生物量密度的平均值分别为6.28、7.97、10.02和10.27 mg·cm-3,其中N2>N1>N0,3个处理间差异显著(P<0.05),N2处理与N3处理差异不显著。20-40 cm土层中,根系生物量仅占总根系生物量的17.8%,各处理根系生物量密度极显著低于0-20 cm土层(P<0.01),说明根系主要分布在0-20 cm土层中,4个处理全生育期内植被根系生物量密度平均值依次为N3(1.98 mg·cm-3)>N2(1.92 mg·cm-3)>N1(1.86 mg·cm-3)>N0(1.75 mg·cm-3),各处理间差异不显著(P>0.05)。
根长密度呈现出与生物量密度相似的变化趋势(图2),即随着时间的变化,根长密度呈先升高后降低的趋势,最高值出现在7~10月。0-20 cm土层范围内,植被根长密度在整个生育期内总体上随着施氮量的增加而增加,N0、N1、N2处理中,整个生育期除了5月份外,根长密度随着施氮量的增加显著升高(P<0.05),N2与N3处理在整个生育期内根长密度都没有差异(P>0.05)。20-40 cm土层各处理根长密度均极显著低于0-20 cm土层(P<0.01),且此土层范围内根长密度较小且各处理间均无显著差异,说明施氮对0-20 cm土层根系影响较大。
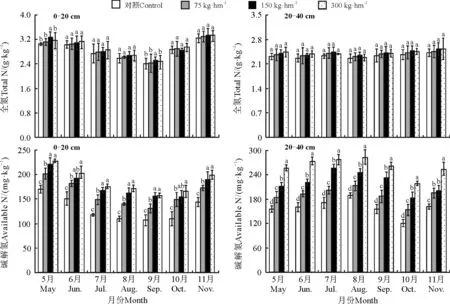
图1 不同施氮量对土壤氮素含量时空分布的影响Fig. 1 Effect of nitrogen application on distribution of spatial and temporal distribution of soil nitrogen content
不同小写字母表示相同月份不同处理间差异显著(P<0.05)。下同。
Different lowercase letters indicate significant difference among different treatments of same month at the 0.05 level; similarly for the following figures and tables.

图2 不同施氮量对根系生物量密度和根长密度的影响 Fig. 2 Effect of nitrogen application on biomass density and root length density
2.3 施氮量对草甸植被根系氮素积累及氮素利用的影响
各施氮处理随着生育期的推进,根系氮素积累量均呈先升高后降低的趋势,其中最高值均出现在旺盛生长期(7-9月)。在整个生育期内,随着施氮量的增加,氮素积累量均呈升高趋势。N0、N1、N2、N3处理全生育期内植被根系氮素累积量的平均值依次表现为N3(28.59 kg·hm-2)>N2(27.46 kg·hm-2)>N1(23.32 kg·hm-2)>N0(13.69 kg·hm-2),其中N0、N1、N23个处理间差异显著(P<0.05),N2与N3处理间差异不显著(表1)。
各处理随着生育期的推进,植被地上生物量均呈先升高后降低的趋势(表2、表3)。在整个生育期内,随着施氮量的增加,地上生物量呈升高的趋势。N0、N1、N2、N3处理全生育期内植被地上生物量的平均值依次为N3(1 113.1 g·m-2)>N2(1 086.0 g·m-2)>N1(893.7 g·m-2)>N0(729.2 g·m-2),其中N0、N1、N23个处理间差异显著(P<0.05)。各处理在生育期内氮素利用率呈现出先上升后降低的趋势,N1、N2、N3处理7、8、9月的氮素平均利用率分别43.6%、40.5%39.0%,显著高于其他月份(P<0.05)。

表1 不同施氮量对草甸植被根系生育期氮素积累的影响Table 1 Effect of nitrogen application on nitrogen accumulation of meadow root during growing season kg·hm-2

表3 不同施氮量对草甸植被地上氮素利用率的影响Table 3 Effect of nitrogen application on N use efficiency of meadow %
2.4 根系生物量、根长与施氮量的关系
为了探讨不同施氮量对武功山草甸植被根系生长的影响,本研究采用了线性、对数、二次项、复合、幂、指数等多种函数模型,分别对武功山草甸植被根系参数(生物量、根长)与施氮量进行方程拟合,发现根系参数与供氮量呈非线性一元二次回归关系,且均达显著水平(P<0.05)(表4)。 根系生物量(y)与施氮量(x)的一元二次回归方程为y=-5.96x2-88.61x+524.14(R2=0.43),根长(y)与施氮量(x)的一元二次回归方程为y=-2.20x2-76.17x+840.58(R2=0.37)。由方程可知,随着施氮量的增加,根系生物量及根长均呈先升高后降低的抛物线趋势。表明在一定施氮范围(0-150 kg·hm-2)内,氮素能够促进根系生长;超出一定范围,氮素可能不影响或者抑制根系的生长。

表4 根系生物量、根长与不同供氮量回归分析Table 4 Regression analysis between different application levels of nitrogen and root biomass/root length
“*”表示差异达到显著水平(P<0.05)。
“*” indicate significant difference at 0.05 level.
3 讨论
3.1 施氮对土壤氮素的影响
随着草甸的退化,草甸土壤养分也会存在不同程度的流失[17],在土壤中施加氮肥能够补充流失的氮素,有利于维持土壤肥力,防止草甸土壤退化[18-20]。高中超等[21]在施肥对退化草原土壤理化性质影响的研究中指出,施用氮肥后,土壤全量养分有所提高,草地生产力也随之提高。郭永盛等[22]研究发现,施用氮肥,可以增加土壤中的速效养分,提高了严重退化草地的土壤肥力[20]。本研究结果表明,施用氮肥后,土壤中碱解氮含量显著增加。此外,许多研究[23-26]表明,根系的存在会影响养分在土壤中的分布情况。本研究中,各处理土壤碱解氮含量在0-20 cm土层内随着时间的推移均呈现出先降低后升高的“凹”型趋势,7-9月降到最低,显著低于其他月份(P<0.05),可能是由于植被在该时期处于旺盛生长期,根系需从土壤中吸收大量的养分供给地上植被,从而导致土壤中氮素的减少。在20-40 cm土层,各处理土壤全氮及碱解氮含量月份间差异不显著,可能有两方面原因:一是地表枯落物输入土壤中的有机质及氮素等营养主要集中在表土层(0-20 cm),对更深土层(20-40 cm)养分积累与分配影响不大;二是根系主要分布在0-20 cm土层,根系分泌物以及根系通过周转进入到土壤中的养分主要集中在该土层,而对20-40 cm土层影响较小。
3.2 施氮对草甸植被根系的影响
根系与土壤是一个相互作用的共同体,根系参数的变化与土壤养分的变化是相辅相成的[27]。研究表明,氮素对植物根系生长的影响可能表现为两方面的作用:促进或者抑制作用,研究对象、研究方法、研究条件的不同使研究结果各异[28]。刘晓静等[29]研究氮素对紫花苜蓿(Medicagosativa)根系形态的影响时发现,施氮能够显著增加紫花苜蓿苗期根系生物量,并且与所施氮肥浓度正相关。秦洁等[30]的研究表明,随着氮素供应浓度的增加,退化草地大针茅(Stipagrandis)根系根长、根表面积、根体积以及根系深度均明显增加。姜琳琳等[31]研究氮素对玉米(Zeamays)根系形态及吸收的影响时发现,低氮(0.08~0.8 mol·L-1)水平下氮素对根系生长有促进作用,随着氮素水平的进一步提高,反而会抑制根系的生长。曹文侠等[32]研究施氮对高寒草甸草原植物根系的影响时发现,施氮增加了0-20 cm土层根系生物量,而对20 cm以下土层根系生物量没有显著影响,这与本研究结果一致。本研究表明,0-20 cm土层根系生物量密度与根长密度均随着施肥量的增加而增加,即N3>N2>N1>N0,其中,N0、N1、N23个处理间差异显著(P<0.05),N3与N2间差异不显著,说明在0-150 kg·hm-2施氮范围内,氮素对根系的生长有促进作用,超过了这个施氮范围,对根系的生长就不会产生显著影响。20-40 cm土层中整个生育期内各处理根系参数差异不显著,说明施氮肥主要对0-20 cm土层根系的影响较大。
3.3 施氮对草甸植被根系氮素吸收的影响
根系是植被营养元素吸收和存储以及物质与能量转化的重要器官。施氮不仅影响了根系形态特征及在土壤中的分布情况,同时也影响了根系对养分的吸收能力。在适宜的范围内施加氮肥能够促进根系发育,增加根系与土壤的接触面积,有利于根系对氮素的高效吸收[31]。刘晓静等[29]的研究表明,紫花苜蓿苗期施氮能够增加根系对养分的吸收能力。王树起等[33]在研究施氮对大豆(Glycinemax)根系形态及氮素吸收累积的影响中表明,适量施氮对大豆根系氮素积累有明显的促进作用。石祖梁等[34]在不同施氮量对小麦(Triticumaestivum)根系生长及对氮素利用的影响研究中发现,在小麦全生育期随着施氮量的增加小麦氮素累积量也随之增加。本研究结果表明,在整个生育期内草甸植被根系氮素积累量随着施氮量的增加而升高,其中N0、N1、N2处理间差异显著(P<0.05),N2与N3处理差异不显著,说明在0~150 kg·hm-2的施氮范围,增施氮肥有利于根系对氮素营养的吸收,一旦超出了根系对氮素的固持能力,施氮并不能起到促进根系吸收的作用,这与王树起等[33]对大豆根系的研究结果类似。在整个生育期内各处理氮素累积量最大值出现在7~9月,可能与草甸植被在这段时间处在旺盛生长阶段需吸收大量养分来满足地上部对养分的需求有关。
作为氮素吸收的主要器官,根系的形态特征和时空分布是植物能否高效利用氮素营养的关键因素[35]。Sattelmacher[36]的刺激模型表明,在低氮胁迫下,根系的形态及分布将成为其吸收氮素的限制因子,在极低氮浓度下,根系通过扩大在土层中的分布来满足植物对氮素的需求。Ladha等[37]认为,根系形态是水稻高效吸收的物质基础,水稻通过发育良好的根系形态来提高植被氮素含量及累积量,从而实现了对氮素的高效利用。根系参数是植被根系形态特征及在土层中分布状况的重要表征,因此这些参数对施氮量变化的响应非常重要。本研究对根系生物量、根长与供氮量的相关性研究表明,根系生物量及根长与供氮量能够很好的进行一元二次非线性方程拟合(P<0.05),方程表明,随着施氮量的增加,根系参数呈先升高后降低的抛物线趋势,可以推断在适宜施氮范围内,氮素能够促进根系生长,超出此范围,氮素可能不影响或者抑制根系的生长。
4 结论
1)土壤碱解氮含量随着施氮量的增加而增加,各处理土壤碱解氮含量随时间呈先升高后降低的趋势,在7-9月降到最低值。2)施氮主要对0-20 cm土层根系产生影响,随着施氮量的增加,根系生物量密度、根长密度呈升高的趋势。3)在0~150 kg·hm-2施氮范围内,根系对氮素的吸收随着施氮量的增加而显著增加(P<0.05),超出此阈值,施加氮素不会对根系吸收产生显著影响。

