玉蝉花愈伤组织的诱导及植株再生研究
, , ,
(东北林业大学园林学院, 黑龙江 哈尔滨 150040)
鸢尾属(Iris)植物种类丰富,可根据其营养器官的不同将其分为两大类群,即球根鸢尾(BulbousIrises)和根茎鸢尾(RhizomatousIrises)[1]。其作为观赏花卉应用较广范,可用做园林绿化材料[2-6],也可以做切花应用[7-9]。
鸢尾属植物通过无性繁殖和有性繁殖均可,其中无性繁殖技术中最常用的是分株繁殖,分株繁殖能够很好的保持植物的优良性征,而且成活率较高、繁殖速度较快,被广泛地应用;而无性繁殖中的组织培养快繁是非常有效的实现资源保护的方法,该方法比分株繁殖要快几百倍[10],近些年不断有不同种鸢尾的组织培养快繁技术研究报导。在鸢尾属植物中,不同种在组培快繁外植体的选择上存在明显差异[11-14],其中愈伤途径的再生体系研究中常用外植体有茎尖[15-16]、嫩叶[17]、花茎[18]、花瓣[19]等。但是,以花器官为外植体的取材不仅受到季节限制,还受株龄限制(鸢尾属植物多数种类2年才开花;相比之下,以茎尖和嫩叶作为诱导愈伤的外植体,取材方便、消毒容易,是鸢尾属植物组培快繁最常用的外植体材料。
玉蝉花(IrisensataThunb.)是鸢尾属中的根茎类花卉,性喜水湿,也适应旱生环境,耐寒性较强,是我国东北地区比较珍贵的夏花类、紫色大花野生观赏花卉资源。目前玉蝉花在我国并没有得到很好的开发利用,而且随着湿地开垦和环境的破坏,野生资源受到极大的破坏,数量越来越少,有效的快繁技术研究对于资源有效保护基础上的开发利用十分重要。目前,对玉蝉花的研究工作主要集中在开花生物学[20]、种子萌发特性[21]、种质超低温保存[22-23]、种胚[24]及花器官[25]直接诱导不定芽再生体系的建立等方面。随着鸢尾属植物生物工程育种的开展,玉蝉花愈伤途径再生体系的建立也是构建植物基因遗传转化体系的基础,因此高诱导率的愈伤途径的再生体系建立也尤为重要。本试验在前期通过种胚获得无菌丛生芽的基础上[24],尝试利用其无菌茎尖和嫩叶研究其愈伤组织的诱导及再分化,进一步完善玉蝉花植株再生体系,为资源有效开发利用及其转基因工程育种提供材料。
1 试验材料和方法
1.1 试验材料
本试验将玉蝉花(IrisensataThunb.)的种子消毒后(种子于2015年9月采摘自东北林业大学帽儿山实验基地,在室内阴干保存)切取种胚诱导萌发得到实生苗,于无菌条件下培养1个月后获得丛生芽[24],选取丛生芽上单个生长健壮的组培苗茎尖及叶片为外植体材料。
1.2 试验方法
1.2.1外植体处理
茎尖处理,选择健壮的无菌组培苗进行无菌操作,先剪掉距植株根基部1 cm上的叶片,用刀片切去基部外层组织及外层叶片(保留茎顶端2~3片叶),在解剖镜下用解剖针将外植体的剩余叶片去掉(注意保留茎尖组织的完整性),切取约2 mm3的茎尖备用。
叶片处理,在超净工作台内用消毒的刀片将组培苗的外层叶片切掉,将其内层嫩叶(茎顶端起第4~6片叶)切成0.5 cm2的块状备用。
1.2.2诱导愈伤组织
试验选用MS培养基,加入6.0 g/L的琼脂粉和30 g/L的蔗糖作为基础培养基,添加不同浓度的6-BA、NAA和2,4-D,调pH值5.8,进行L9(34)正交试验(见表1)。每个处理分别接种20个外植体,重复3次。培养室的培养温度(25±1)℃,光照强度25μmol/(m2·s),光照时间14 h/d(培养条件下同)。
1.2.3不定芽的分化
试验选用MS培养基,加入6.0 g/L的琼脂粉和30 g/L的蔗糖作为基础培养基,添加不同浓度的6-BA、NAA和KT,调pH值5.8,进行L9(34)正交试验(见表3)。每个培养基配方中接种20个约0.5 cm3的愈伤团,重复3次。
1.2.4生根培养
从丛生芽中选取单个生长旺盛的不定芽,接种于生根培养基上(见表5),每个处理接种20株苗,重复3次,观察并统计其生根的情况。
1.3 数据处理分析[14,24]
诱导率(%)=诱导形成愈伤组织的外植体个数/接种外植体个数×100%;
分化率(%)=诱导分化出不定芽的愈伤数量/接种愈伤数×100%;
平均分化不定芽数=愈伤分化产生的不定芽总数/接种的愈伤组织总块数;
生根率(%)=生根的不定芽数/接种不定芽的总数×100%;
生根数=苗生根总数/接种不定芽的总数。
采用Excel软件对原始数据进行整理,SPSS 19.0软件进行数据分析,包括多重比较分析(Duncan’s)和方差分析及显著性检验。
2 结果与分析
2.1 玉蝉花不同外植体愈伤组织的诱导结果
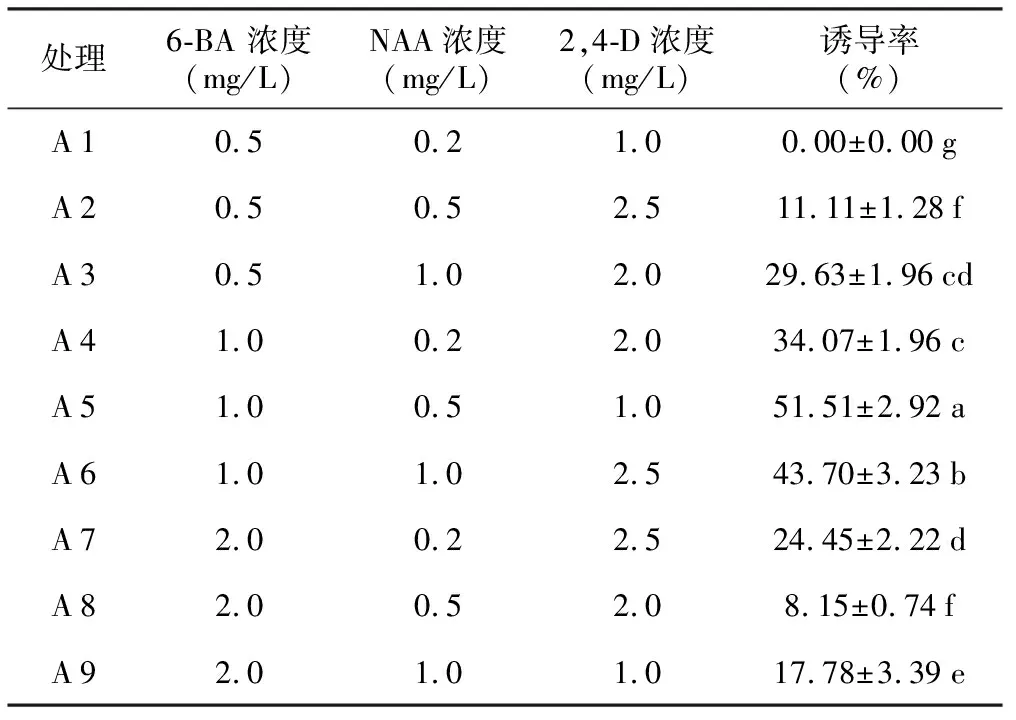
由表1可知,以茎尖为外植体除了A 1号培养基未能诱导出愈伤组织外,其余各处理都能诱导出愈伤组织;以嫩叶作为外植体时,各处理均未能成功诱导出愈伤组织,说明玉蝉花的茎尖适合作为外植体诱导愈伤组织。
表1不同培养基处理对愈伤组织诱导的影响
处理6-BA 浓度(mg/L)NAA浓度(mg/L)2,4-D浓度(mg/L)诱导率(%)A10.50.21.00.00±0.00gA20.50.52.511.11±1.28fA30.51.02.029.63±1.96cdA41.00.22.034.07±1.96cA51.00.51.051.51±2.92aA61.01.02.543.70±3.23bA72.00.22.524.45±2.22dA82.00.52.08.15±0.74fA92.01.01.017.78±3.39e
注:表中数据为平均值±SD。同列不同小写字母表示差异显著(p<0.05)。下同。
2.2 不同培养基处理对愈伤组织诱导的结果
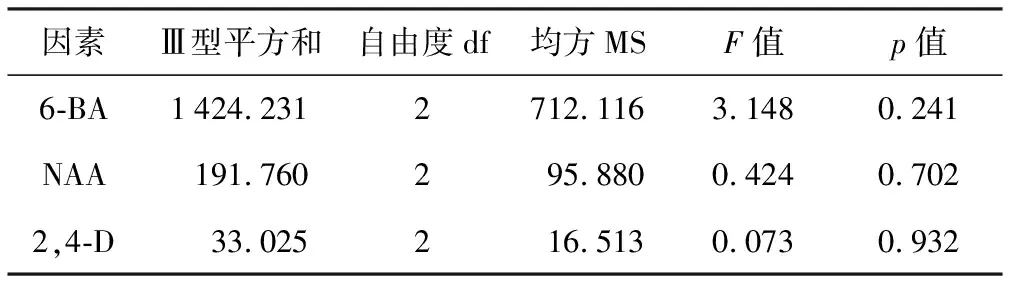
由表1可见,6-BA、NAA、2,4-D 3种激素不同浓度的组合对玉蝉花茎尖愈伤组织的诱导起到良好的作用,各处理间愈伤组织的获得率差异显著。经过约40 d的培养,A 5号培养基平均诱导率达到51.51%,显著高于其他处理,其表面干燥且颗粒性明显呈黄色,生长状态良好。通过比较各因素的Ⅲ型平方和(见表2),确定影响茎尖愈伤组织诱导的激素条件由大到小顺序为6-BA>NAA>2,4-D,从诱导结果可看出,低浓度(0.5 mg/L)和高浓度(2.0 mg/L)的6-BA组合均不利于愈伤组织的诱导,A 1处理外植体直接形成苗而未能诱导出愈伤组织,可能与激素配比有关。综合试验结果,从中选出玉蝉花茎尖诱导愈伤组织较优的培养基组合为MS+6-BA 1.0 mg/L +NAA 0.5 mg/L+2,4-D 1.0 mg/L,诱导率为(51.51±2.92)%。
表2不同培养基处理对愈伤组织诱导的影响的单因素方差分析
因素Ⅲ型平方和自由度df均方MSF值p值6-BA1424.2312712.1163.1480.241NAA191.760295.8800.4240.7022,4-D33.025216.5130.0730.932
2.3 不同培养基处理对愈伤分化不定芽的结果
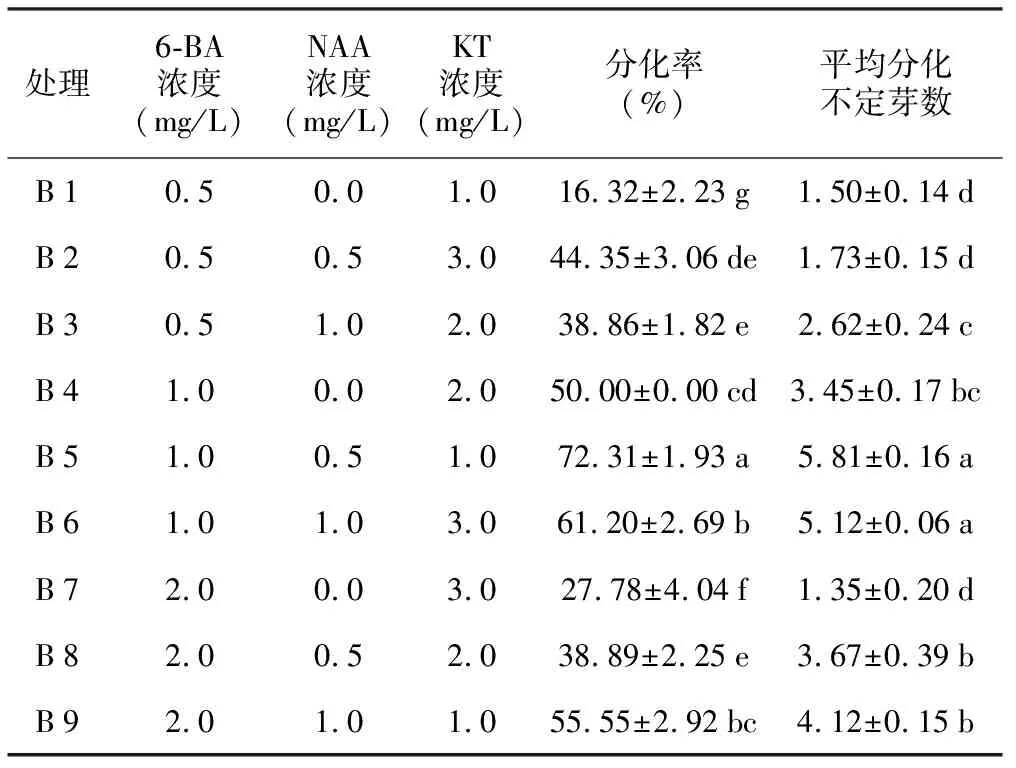
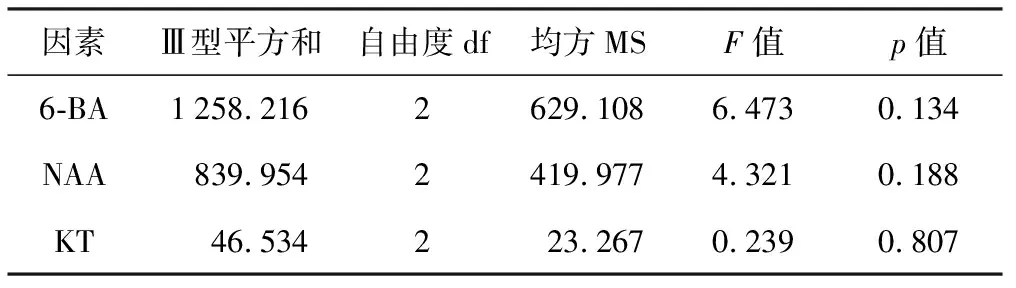
对茎尖诱导出的愈伤组织进行增殖继代培养30 d,取生长状态良好的约0.5 cm3的愈伤团,在分化培养基上培养30 d时统计不定芽诱导情况,不同处理均能分化出不定芽(见表3),其中B 5组合愈伤组织平均分化率最高,达72.31%,平均分化不定芽数为5.81,与其它处理差异显著,不定芽颜色深绿、生长粗壮。通过比较各因素的Ⅲ型平方和(见表4),确定影响愈伤组织分化不定芽的激素条件由大到小顺序为6-BA>NAA>KT,低浓度6-BA(0.5 mg/L)不利于愈伤组织诱导不定芽;浓度为0.5 mg/L的NAA有利于不定芽的诱导。综合比较筛选出较优培养基组合为MS+6-BA 1.0 mg/L+NAA 0.5 mg/L+KT 1.0 mg/L。
表3不同培养基处理对愈伤分化不定芽的影响
处理6-BA浓度(mg/L)NAA浓度(mg/L)KT浓度(mg/L)分化率(%)平均分化不定芽数 B10.50.01.016.32±2.23g1.50±0.14dB20.50.53.044.35±3.06de1.73±0.15dB30.51.02.038.86±1.82e2.62±0.24cB41.00.02.050.00±0.00cd3.45±0.17bcB51.00.51.072.31±1.93a5.81±0.16aB61.01.03.061.20±2.69b5.12±0.06aB72.00.03.027.78±4.04f1.35±0.20dB82.00.52.038.89±2.25e3.67±0.39bB92.01.01.055.55±2.92bc4.12±0.15b
2.4 不同培养基处理对不定芽诱导生根的影响
诱导出的不定芽均采用庄春慧[24]的方法,以最佳增殖培养基(MS+6-BA 1.0 mg/L+NAA 0.6 mg/L+KT 2.0 mg/L)进行增殖培养,选择生长高约5 cm健壮的不定芽丛,切取不定芽进行生根诱导。培养7 d左右可以看到,在不定芽的基部出现白色生根点,培养至20 d时根粗壮且密集。由表5可以看出,各处理间有一定的差异,其中C 2和C 3组合不定芽生根率达到100.00%,平均生根数分别为7.33、9.80;C 4处理虽然生根数显著高于其它处理,但生根率不高,仅为79.00%,与C 2和C 3结果相比差异显著;综合比较选择出较优的生根培养基为:MS+NAA 1.5 mg/L。
表4不同培养基处理对愈伤分化不定芽的影响的单因素方差分析
因素Ⅲ型平方和自由度df均方MSF值p值6-BA1258.2162629.1086.4730.134NAA839.9542419.9774.3210.188KT46.534223.2670.2390.807
表5不同培养基处理对不定芽生根的影响
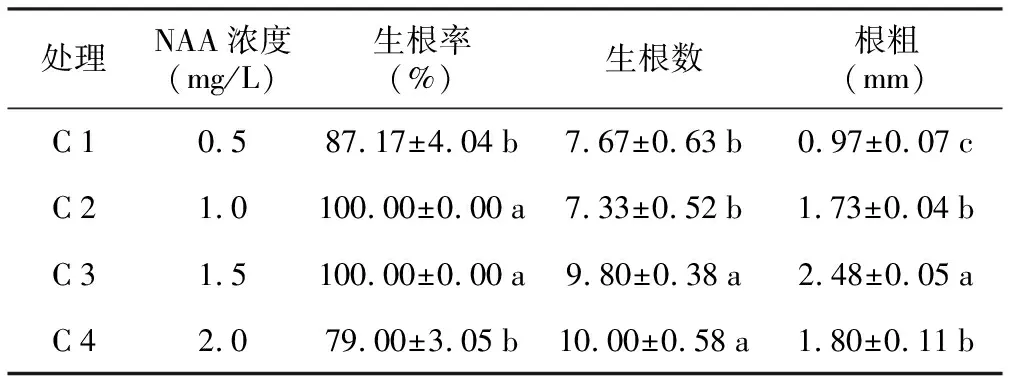
处理NAA浓度(mg/L)生根率(%)生根数根粗(mm)C10.587.17±4.04b7.67±0.63b0.97±0.07cC21.0100.00±0.00a7.33±0.52b1.73±0.04bC31.5100.00±0.00a9.80±0.38a2.48±0.05aC42.079.00±3.05b10.00±0.58a1.80±0.11b
本试验中接种的茎尖外植体在愈伤诱导培养基上经约40 d诱导形成愈伤组织,在分化培养基的作用下约30 d诱导形成不定芽,在分化培养基上继续继代培养60 d,将生长健壮的芽分离出来进行生根诱导,生根苗按照庄春慧等[24]的方法进行移栽(见图1),成活率在85%左右。
3 讨 论
以往研究发现,激素在鸢尾属植物组织培养过程中对细胞的分化起到了重要的调节作用,其茎尖愈伤诱导培养基、分化培养基的激素种类和浓度又因种不同而存在一定差异;已有的研究中鸢尾属植物的茎尖诱导愈伤的诱导率、不定芽分化率都不高。如西伯利亚鸢尾(Irissibirica)茎尖的愈伤诱导最适培养基为MS+KT 1.0 mg/L+2,4-D 1.0 mg/L,诱导率为62.37%,不定芽分化培养基为MS+6-BA 1.0 mg/L+NAA 0.2 mg/L,分化率为60.24%[16];杂种鸢尾(Irishybrids)茎尖的愈伤诱导最佳培养基为MS+6-BA1.5 mg/L+NAA 0.1 mg/L,不定芽分化培养基为MS+6-BA 1.0 mg/L+NAA 0.5 mg/L[26]。本研究中,玉蝉花茎尖为外植体的愈伤组织诱导最佳培养基为MS+6-BA 1.0 mg/L+NAA 0.5 mg/L+2,4-D 1.0 mg/L,最高诱导率为51.51%,不定芽诱导培养基为MS+6-BA 1.0 mg/L+NAA 0.5 mg/L+KT 1.0 mg/L,分化率为72.31%;而Boltenkov等[27-28]以玉蝉花离体的胚胎组织诱导愈伤组织,最适诱导培养基为MS+KT 0.5 mg/L+2,4-D 2.0 mg/L,不定芽分化培养基为MS+KT1.0 mg/L+IAA 2.0 mg/L,获得了较高的诱导率(90%)和分化率(75%),这可能与不同外植体器官自身的分生能力有关。鸢尾属植物有一些种类以花茎为外植体的诱导分化率通常较高[19],但王文元等以玉蝉花的2个品种Irisensata‘Rose Frappe’和Irisensata‘Hougyoku’ 的花茎为外植体进行愈伤组织的诱导及不定芽的分化研究,结果表明,平均诱导率也仅50.09%,不定芽分化率也仅为50%[18]。本研究过程中获得的愈伤多数较松软或呈水渍状,一般情况下这不利于愈伤的增殖与分化,王杰等[29]对麝香百合的这种愈伤组织状态进行调整,通过在培养基中添加0.05μmol/L氯化钴和60 g/L蔗糖并在光照条件下进行愈伤培养,对其胚性愈伤组织的比例和颗粒性都有较好的改善,从而促进了愈伤的增殖与分化。今后可以借鉴以往研究经验,通过调整玉蝉花愈伤的生长状态,进一步提高愈伤的分化率。玉蝉花茎尖愈伤诱导及植株再生体系成功的建立,进一步完善了玉蝉花植株多途径的再生体系,可以更有效的促进优质野生资源繁殖开发利用,也满足了基因工程育种的材料需求。
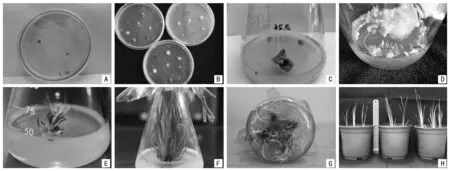
注:A~C为愈伤诱导;D为愈伤分化不定芽;E为诱导30 d所得不定芽;F为从生芽;G为丛生芽诱导生根;H为移栽20 d的植株。图1 玉蝉花愈伤组织诱导不同阶段的培养情况
在本试验中,以嫩叶为外植体未能实现愈伤组织的诱导,但同属的短旗鸢尾(Irispumila)却通过嫩叶诱导获得了愈伤[17],今后可以进一步通过激素的调整来研究玉蝉花嫩叶的愈伤途径再生体系。
研究过程中发现,玉蝉花不定芽诱导生根时受培养基中NAA激素浓度的影响,当培养基中仅加入NAA(0.5,1.0,1.5 mg/L)时,在一定浓度范围内不定芽的生根率及生根系数会随着NAA浓度升高而升高,根多且粗壮,组培苗长势良好,但当浓度达到2.0 mg/L时对生根起到一定的抑制作用,生根率降低。

