趋化因子CCL2对STEMI患者残余血小板活化的影响
曹禹,于淼,乔锐,童芳念,程茗慧,李春辉,刘丹
急性心肌梗死(acute myocardial infarction,AMI)是严重威胁人类健康并影响人类生存的主要疾病之一[1]。AMI是在冠脉粥样硬化不稳定斑块破裂的基础上继发了血栓形成,导致冠脉变窄甚至完全闭塞引起的心肌缺血甚至坏死。炎症反应及血小板的聚集和激活在冠脉血栓形成过程中扮演着重要角色[2]。目前,AMI的主要治疗策略是经皮冠状动脉介入(percutaneous coronary intervention,PCI)治疗及围术期开始的长期双联抗血小板治疗。氯吡格雷和阿司匹林是常用的抗血小板药物,主要作用是抑制血小板ADP受体和血栓素A2的生成,在一定程度上缓解患者的临床症状并改善患者预后,但仍有部分患者再次发生缺血性事件,部分原因归咎于氯吡格雷抵抗[3]。
新型抗血小板药物替格瑞洛(商品名:倍林达)为非前体药,不需要肝脏代谢,具有可与P2Y12 ADP受体可逆性结合,抑制血小板作用较强,可降低急性冠脉综合征(acute coronary syndrome,ACS)患者不良心血管事件风险等优势。心血管临床医生及相关临床研究人员在很长一段时间内认为ACS患者服用替格瑞洛后不会发生残余血小板高反应,且可以完全改善患者因服用氯吡格雷带来的不良后果。但是,随着研究的不断深入,诸多研究证实ACS患者即使服用替格瑞洛,仍然不能避免血栓事件的发生[4-5],说明仍有一定程度的残余血小板聚集和活化。因此,寻找参与残余血小板聚集和活化的关键调控分子至关重要。
趋化因子CCL2在动脉粥样硬化(atherosclerosis,AS)和ACS的发生发展过程中具有重要作用[6-9]。CCL2通过与其特异性受体CCR2结合而发挥生物学效应,可以趋化血液循环中的单核细胞至动脉粥样病变区域[10-11]。本研究探讨CCL2对STEMI患者服用替格瑞洛后残余血小板活化的影响。
1 资料与方法
1.1 研究对象 连续入选自2015年4-9月沈阳军区总医院CCU收治的STEMI患者80例。入选患者均为汉族,年龄35~75岁,均有持续30min以上的典型胸痛,发病时间<12h;心电图显示ST段呈弓背向上型抬高及动态演变过程;冠脉造影显示冠脉左前降支、左回旋支及右冠状动脉中有1处或多处血管狭窄程度超过75%。排除近期患有严重肝肾疾病、血液系统疾病、肿瘤性疾病、先天性心脏病、心脏瓣膜疾病、自身免疫病、活动性炎性疾病、血流动力学不稳定、严重心衰等疾病及既往行PCI或冠状动脉搭桥手术的患者。本研究经沈阳军区总医院伦理委员会同意,入选的研究对象均签署知情同意书。
1.2 临床资料采集 详细记录入选患者的入院时间、年龄、性别等一般情况;冠心病的常见危险因素:吸烟史、糖尿病病史、高血压病史;实验室检查结果:空腹血糖(fasting plasma glucose,FPG)、总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、脑尿钠肽(brain natriuretic peptide,BNP)、肌酸激酶(creatine kinase,CK)、肌酸激酶同工酶(creatine kinase isoenzyme,CK-MB)和肌钙蛋白T(Troponin T,TnT)等。
1.3 样本采集及分组 入选的80例患者均服用180mg替格瑞洛,300mg阿司匹林肠溶片(商品名:拜阿司匹林),随后进行PCI治疗,术中应用肝素或比伐芦定抗凝,均未应用替罗非班等ⅡbⅢa受体拮抗药。术后规律服用90mg替格瑞洛,2次/d,100mg阿司匹林肠溶片,1次/d。连续抽取80例服用替格瑞洛患者的静脉血,采血时间点为服药后
2、4、6h,每个时间点用含EDTA的真空抗凝管采集3ml静脉血,用含枸橼酸钠的真空抗凝管采集3ml静脉血。按照文献[12]报道,根据光比浊法检测的残余血小板聚集率(residual platelet aggregation rate,RPA)数值不同将患者分为两组,RPA≥59%为残余血小板高反应组(高反应组),RPA<59%为残余血小板正常反应组(正常反应组)。
1.4 ELISA检测血浆CCL2水平 制备CCL2标准品,每孔先加入50μl稀释液RD1-83,再加入200μl标准品或待测样品,室温孵育2h;弃去液体,加入400μl冲洗缓冲液,洗3次后拍干;加入200μl CCL2结合溶液,室温孵育2h;加入200μl底物溶液,避光孵育30min;加入50μl终止液,在酶标仪上检测。绘制标准曲线,根据公式计算出每个待测样品的浓度。
1.5 光比浊法检测ADP诱导的人RPA值 采用含枸橼酸钠的真空抗凝管采集人静脉血3ml,室温下800r/min离心10min,上清为富含血小板血浆(platelet-rich plasma,PRP)。将PRP移至新的EP管,余下的血标本于室温下3000r/min离心10min,上清为贫血小板血浆(platelet-poor plasma,PPP)。打开光比浊检测仪(光透射仪),取250μl PPP加入到血小板反应杯中,再将血小板反应杯插入检测仪的检测孔中调零。取225μl PRP加入血小板反应杯中,放入磁珠,将带有磁珠的血小板反应杯插入检测仪的检测孔中。将25μl ADP(20μmol/L)作为血小板诱导剂迅速加入检测孔,37℃条件下1000r/min开始检测,电脑显示血小板聚集率情况,共记录10min。待反应结束后,记录人RPA最大值。
1.6 统计学处理 采用SPSS 21.0软件进行统计分析。计量资料以±s表示,两组间比较采用独立样本t检验;两组分类变量的比较采用χ2检验;患者RPA值与血浆CCL2浓度之间的关系应用Pearson相关分析。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者临床基线资料及RPA比较 服药后2、4、6h时间点正常反应组患者分别为45例、57例、66例,高反应组患者分别为35例、23例、14例,残余血小板高反应比例分别为43.8%、28.8%、17.5%。服药后各时间点,两组临床基线资料比较差异均无统计学意义(P>0.05)。各时间点高反应组的RPA值均明显高于正常反应组,差异有统计学意义(P=0.000,表1)。
2.2 患者血浆中CCL2浓度的差异及其与RPA的相关性
2.2.1 两组患者血浆CCL2浓度比较 服药后2、4、6h,高反应组患者血浆CCL2浓度分别为209.72±84.09、195.54±63.66、184.29±56.74pg/ml,明显高于正常反应组(分别为167.52±36.92、160.63±42.31、152.43±42.48pg/ml),差异均有统计学意义(P<0.01、P<0.01、P<0.05,图1)。
2.2.2 患者RPA值与血浆中CCL2浓度的相关性Pearson相关分析结果显示,服药后2、4、6h,患者RPA值与血浆CCL2浓度均存在线性关系(r=0.474、r=0.622、r=0.425,P<0.01,图2)。
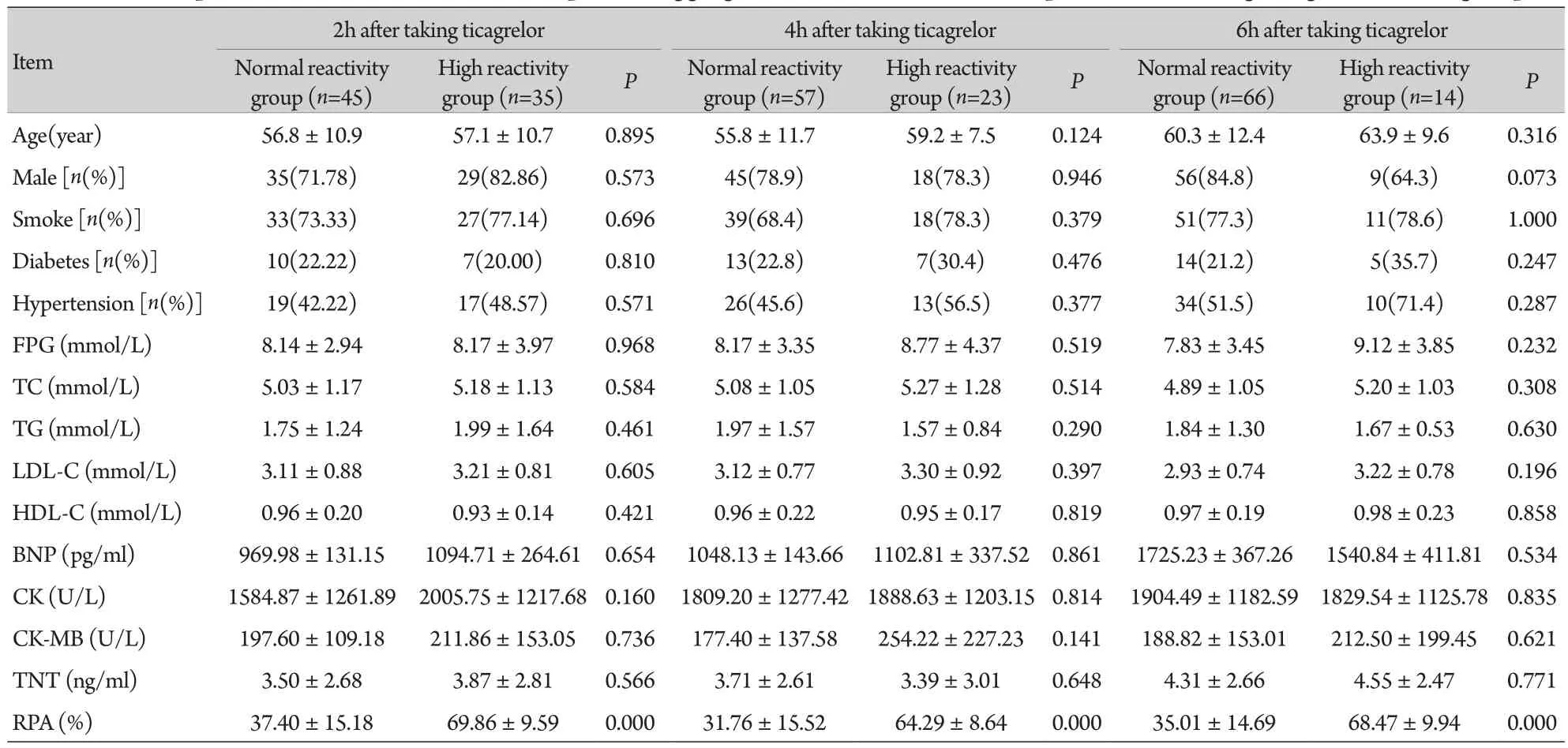
表1 两组各时间点服用替格瑞洛的STEMI患者基线资料及血小板聚集率比较Tab. 1 Comparison of the baseline data and platelet aggregation rate at different time points after taking ticagrelor in two groups
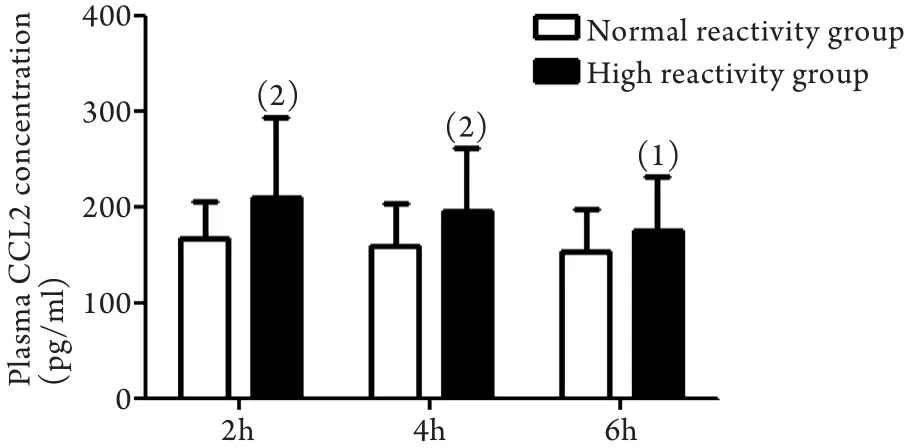
图1 服用替格瑞洛后不同时间点两组血浆CCL2浓度比较Fig. 1 Comparison of the plasma CCL2 concentration at different time points after taking ticagrelor in two group(ELISA)
3 讨 论
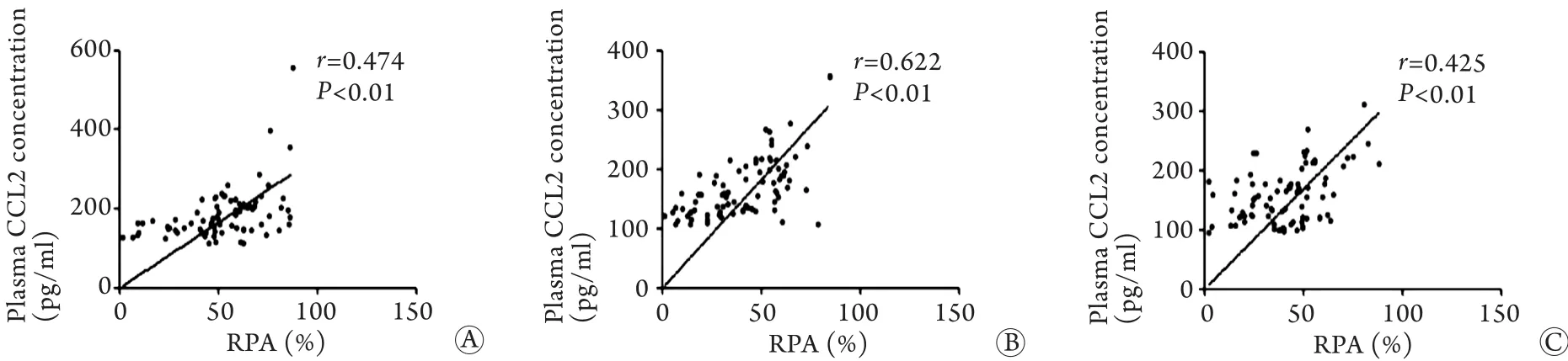
图2 不同时间点患者RPA与血浆CCL2浓度的相关性分析Fig. 2 The correlation of RPA and plasma CCL2 concentration at different time points
血小板没有细胞核,但其内部含有多种细胞器及散在分布的颗粒成分,具有完整的转录组并可以翻译蛋白质。血小板在止血、伤口愈合、炎症反应、血栓形成及器官移植排斥等生理及病理过程中均发挥着重要作用[13]。血小板是构架血管炎症和血栓形成之间必不可少的成分。当血管内皮损伤并且内皮下胶原暴露后,血小板与受损的内皮及暴露的胶原结合,促使血小板迅速发生活化,释放血小板颗粒内的细胞因子、趋化因子等成分,这些颗粒分泌物进一步促进血小板的活化和聚集,形成正反馈;同时,这些颗粒分泌物还能与血小板膜上的G蛋白偶联受体结合,诱导血小板内第二波激活信号,进而促使血小板颗粒分泌增加[14]。血小板活化、聚集和颗粒分泌在AS等炎症性疾病中至关重要,主要表现为血小板与趋化因子共同作用并参与AS等炎症性疾病的发生发展[15]。AS斑块破裂后血小板黏附、聚集和激活不仅在冠脉血栓形成中发挥重要作用,在斑块破裂处形成的血管阻塞中也同样起作用,是缺血性疾病如AMI的主要病理基础[16]。每个个体的血小板反应性不尽相同,其发生心血管终点事件的概率和严重程度也不尽相同,具有血小板高反应性的个体更容易发生血小板聚集及激活,发生缺血性事件的概率也要明显高于血小板反应正常的个体[17]。因此,明确与血小板高反应相关的信号分子至关重要。
近年来,随着人们生活方式的改变,心血管疾病患者日益增多,AMI是严重威胁人类健康的常见的重大疾病之一。AMI发病急,发病率和病死率呈持续升高趋势,其中冠脉粥样硬化病变部位的炎症反应及粥样硬化斑块的破裂发挥着关键作用[18]。积极抗血小板治疗是目前主要的治疗手段之一,然而,由于大部分抗血小板药物作用机制单一,无法完全拮抗血小板,引起残余血小板的再次活化和聚集,导致一部分患者发生主要心脑血管不良事件。RAPID研究[19]报道了25例STEMI患者服用180mg负荷剂量的替格瑞洛后,2h和4h的残余血小板高反应比例分别为60%和35%。RAPID2研究[20]报道即使增加替格瑞洛负荷剂量至360mg,25例STEMI患者服药后2h的残余血小板高反应比例仍有32%。本研究发现,80例服用替格瑞洛的STEMI患者,应用光比浊法检测患者服药后2、4、6h的RPA值,均有一定比例的残余血小板高反应。可见,探寻发生残余血小板高反应的原因或者发现调控血小板聚集和活化的关键因子尤为重要。
趋化因子CCL2除了可趋化血液循环中的单核细胞至AS损伤部位,还可以作为始动因子诱导其他炎症因子和组织因子的产生和释放,促使AS的进展以及不稳定斑块破裂所致的血栓形成[21]。本课题组前期应用荧光定量PCR、Western blotting、免疫组织化学等方法检测经导管抽吸获得的STEMI患者冠脉血栓组织中CCL2和CCR2的表达,发现无论在RNA或是蛋白水平,其表达均增高,且免疫荧光染色观察发现CCL2和CCR2均可以与血小板标记物CD62p共定位,提示CCL2/CCR2可能通过对血小板的调控参与冠脉血栓形成。本课题组前期研究还发现,STEMI患者服用氯吡格雷4~6h后,通过光比浊法检测患者RPA,高反应组患者血浆中CCL2的浓度明显高于正常反应组,而且RPA与血浆中的CCL2浓度存在线性相关[22]。本研究发现,80例服用替格瑞洛的STEMI患者服药后2、4、6h,高反应组患者血浆中CCL2的浓度仍明显高于正常反应组,而且各时间点检测的RPA值与血浆中CCL2浓度之间均存在线性关系。然而,按照患者服药后不同时间点检测的RPA值分组,高反应组患者临床基线资料中各项指标均与正常反应组患者相匹配,与各时间点应用光比浊法检测的RPA值及血浆中CCL2浓度均无相关性,说明RPA值与血浆中CCL2表达水平的相关性未受基线指标等因素的干扰,提示CCL2可能参与了残余血小板的活化和聚集。
[1] Chen C, Huang Y, Zhou S, et al. Influencial factors for in-hospital patients with ST segment elevation myocardial infarction after emergency percutaneous coronary intervention[J]. J Cent South Univ (Med Sci), 2016, 41(11): 1186-1192.
[2] Avecilla ST, Hattori K, Heissig B, et al. Chemokine-mediated interaction of hematopoietic progenitors with the bone marrow vascular niche is required for thrombopoiesis[J]. Nat Med, 2004,10(1): 64-71.
[3] Lev EI, Patel RT, Maresh KJ, et al. Aspirin and clopidogrel drug response in patients undergoing percutaneous coronary intervention: the role of dual drug resistance[J]. J Am Coll Cardiol, 2006, 47(1): 27-33.
[4] Steg PG, Harrington RA, Emanuelsson H, et al. Stent thrombosis with ticagrelor versus clopidogrel in patients with acute coronary syndromes: an analysis from the prospective, randomized PLATO trial[J]. Circulation, 2013, 128(10): 1055-1065.
[5] Dinicolantonio JJ, Biondi-Zoccai G. Challenging ticagrelor's claimed reduction in the rate of definite stent thrombosis versus clopidogrel: insights from the FDA reports[J]. Int J Cardiol,2013, 168(2): 633-635.
[6] Ma S, Tian XY, Zhang Y, et al. E-selectin-targeting delivery of microRNAs by microparticles ameliorates endothelial inflammation and atherosclerosis[J]. Sci Rep, 2016, 6(3):22910.
[7] Naya N, Fukao K, Nakamura A, et al. A selective peroxisome proliferator-activated receptor δ agonist PYPEP suppresses atherosclerosis in association with improvement of the serum lipoprotein profiles in human apolipoprotein B100 and cholesteryl ester transfer protein double transgenic mice[J].Metabolism, 2016, 65(1): 16-25.
[8] Gao L, Xu Z, Yin Z, et al. Association of hydrogen sulfide with alterations of monocyte chemokine receptors, CCR2 and CX3CR1 in patients with coronary artery disease[J]. Inflamm Res, 2015, 64 (8): 627-635.
[9] Caruso R, Rocchiccioli S, Gori AM, et al. Inflammatory and antioxidant pattern unbalance in "clopidogrel-resistant" patients during acute coronary syndrome[J]. Mediators Inflamm, 2015,2015: 710123.
[10] O'Connor T, Borsig L, Heikenwalder M. CCL2-CCR2 signaling in disease pathogenesis[J]. Endocr Metab Immune Disord Drug Targets, 2015, 15(2): 105-118.
[11] Chen PL, Guo Y, Jiang L, et al. Serum expression and significance of CCL19 in rheumatoid arthritis[J]. Chin J Pract Intern Med,2017, 37(3): 238-241. [陈鹏路, 郭韵, 蒋莉, 等. 类风湿关节炎血清CCL19的表达及意义研究[J]. 中国实用内科杂志,2017, 37(3): 238-241.]
[12] Gurbel PA, Antonino MJ, Bliden KP, et al. Platelet reactivity to adenosine diphosphate and long-term ischemic event occurrence following percutaneous coronary intervention: a potential antiplatelet therapeutic target[J]. Platelets, 2008, 19(8): 595-604.
[13] von Hundelshausen P, Weber C. Platelets as immune cells:bridging inflammation and cardiovascular disease[J]. Circ Res,2007, 100(1): 27-40.
[14] Shattil SJ, Newman PJ. Integrins: dynamic scaffolds for adhesion and signaling in platelets[J]. Blood, 2004, 104(6): 1606-1615.
[15] Ruggeri ZM. Platelets in atherothrombosis[J]. Nat Med, 2002,8(11): 1227-1234.
[16] Bonecchi R, Galliera E, Borroni EM, et al. Chemokines and chemokine receptors: an overview[J]. Front Biosci (Landmark Ed), 2009, 14: 540-551.
[17] Yee DL, Bergeron AL, Sun CW, et al. Platelet hyperreactivity generalizes to multiple forms of stimulation[J]. J Thromb Haemost, 2006, 4(9): 2043-2050.
[18] Oesterle A, Bowman MA. S100A12 and the S100/calgranulins:emerging biomarkers for atherosclerosis and possibly therapeutic targets[J]. Arterioscler Thromb Vasc Biol, 2015, 35(12): 2496-2507.
[19] Parodi G, Valenti R, Bellandi B, et al. Comparison of prasugrel and ticagrelor loading doses in ST-segment elevation myocardial infarction patients: RAPID (rapid activity of platelet inhibitor drugs) primary PCI study[J]. J Am Coll Cardiol, 2013, 61(15):1601-1606.
[20] Parodi G, Bellandi B, Valenti R, et al. Comparison of double (360 mg) ticagrelor loading dose with standard (60 mg) prasugrel loading dose in ST-elevation myocardial infarction patients: the rapid activity of platelet inhibitor drugs (RAPID) primary PCI 2 study[J]. Am Heart J, 2014, 167(6): 909-914.
[21] Cao Y, Zhang XL, Liu D, et al. Effects of chemokine CCL2 on the p38MAPK-HSP27 pathway in the platelets[J]. Med J Chin PLA, 2017, 42(5): 407-412. [曹禹, 张效林, 刘丹, 等. 趋化因子CCL2对血小板p38MAPK-HSP27通路的影响[J]. 解放军医学杂志, 2017, 42(5): 407-412.]
[22] Cao Y, Zhang XL, Liu D, et al. Correlation between residual platelet agglutination and chemokine CCL2 in patients with ST elevated myocardial infarction after clopidogrel treatment[J].Chin Heart J, 2017, 29(2): 164-167, 175. [曹禹, 张效林, 刘丹,等. STEMI患者残余血小板聚集率与趋化因子CCL2的相关性[J]. 心脏杂志, 2017, 29(2): 164-167, 175.]

