扩散峰度成像及直方图分析在直肠癌术前T分期中的应用价值
谢辉,吴光耀
直肠癌是胃肠道最常见的恶性肿瘤之一,在结直肠癌中占比约50%~70%,随着经济社会发展及人们饮食结构的改变,直肠癌在我国的发病率逐年增高[1-2]。对直肠癌早期的精准分期有助于临床选择合适的治疗手段,降低肿瘤复发率。磁共振检查在直肠癌术前分期中有较高的准确性,其无创、多参数、多序列的特点逐渐成为临床首选影像学手段。近年来,磁共振功能成像序列得到迅猛发展,其定量参数相较传统形态学磁共振参数能更精准评估肿瘤直肠癌术前分期,并可在一定程度上预测肿瘤的生物侵犯性信息。扩散峰度成像由Jensen等[3]于2005年首次提出,可反映组织微观结构及病理生理学信息,既往多用于前列腺癌、乳腺癌及神经胶质瘤等疾病研究,而在直肠癌术前分期研究中的文献尚不多,笔者旨在研究DKI及全体积直方图参数在直肠癌术前T分期中的应用价值。
1 材料与方法
1.1 一般资料
搜集2016年3月至2017年4月我院肠镜或手术活检证实的直肠腺癌患者。其纳入标准包括:(1)经肠镜活检或手术病理证实为直肠腺癌;(2)有完整多b值DKI扫描及常规T1WI、T2WI磁共振扫描数据;(3)进行了直肠癌根治手术,并有病理学分期(参考标准AJCC第七版TNM分期)[4]。排除标准:(1)MRI检查前进行了新辅助放化疗;(2)磁共振检查与手术治疗的时间间隔超过两周[5],或未行手术治疗;(3)病人行局部手术治疗而未行彻底根治术;(4) DKI图像质量不佳无法达到诊断要求。最终50例患者纳入分析研究,其中男27例(占54%),女23例(46%),平均年龄为57.7岁(29~86岁)。
1.2 磁共振扫描参数
所有的磁共振检查均在3.0 T机器(Magnetom Prisma;Siemens Healthcare,Erlangen,Germany)上用32通道体部相控阵线圈并行采集。病人检查前均进行了常规清洁肠道准备。扫描序列包括直肠斜轴位(垂直肠管) T2WI、斜轴位T1WI以及DKI (5个b值分别为200、500、1000、1500、2000 s/mm2),具体参数如下:斜轴位T2WI:TR 3770 ms,TE 101ms,PAT (parallel acquisition technique)为2,FOV 200 mm×200 mm,矩阵128×128,层厚4 mm,层数20;斜轴位T1WI:TR 700 ms,TE 12 ms,PAT为2,FOV 280 mm×280 mm,矩阵128×128,层厚4 mm,层数20;DKI:TR 4900 ms,TE 87 ms,Flip angle 90°,PAT为4,FOV 280 mm×280 mm,矩阵128×128,体素1.1 mm ×1.1 mm×5.0 mm,层厚4 mm,层数20,扫描时间260 s。其中DKI最大b值设置为2000 s/mm2[6],具体见表1。
1.3 影像分析
DKI图像采用基于Matlab2013 (Mathworks,Mass,USA)的内部开发软件来分析,ADC值、D值及K值均由多b值DKI序列以线性最小二乘法计算得到。ADC值由单指数模型计算,公式如下:ln (S)=ln (S0)-b·ADC[7-8];其中S0为b=0时的信号强度值,S为计算b值下的信号强度。D值、K值由双指数非高斯模型计算得到,公式如下:ln (S)=ln(S0)-b·D+1/6b2D2K[7,9];其中S为不同b值下的信号强度,S0为b=0时的信号强度值,D (diffusivity)为考虑非高斯扩散因素后的真实扩散系数,K(kurtosis)反映了偏离高斯分布的程度[3,10]。影像图像由两位胃肠影像医师(吴和谢,具有多年直肠病变影像诊断经验)独立分析判断,分析时隐藏病例临床和病理信息。感兴趣区(regions of interest,ROI)由2名医师参考T2WI,在b=1000 s/mm2时的DKI扩散加权图上独立徒手画取,然后复制到其他参数图,画时沿病灶边界尽可能包含实体成分并排除明显坏死囊变区及病灶周围大血管、脂肪等。所有病灶层面均画ROI,进行以体素为最小单位全体积直方图分析。对阳性淋巴结判断由2名医师结合常规MRI和DKI图像综合判断,判断标准参考其他文献[11-12]包括淋巴结大小、边界及信号等。
1.4 统计学分析
各参数以2名医师所测值的平均值纳入统计学分析,统计软件为SPSS 23.0 (SPSS,Chicago,Ⅲ),以P<0.05为差异有统计学意义。所有参数首先行正态性检验(Kolmogorov-Smirnovtest)和方差齐性检验(Levene'stest);两独立样本t检验(Independent-Samples ttest )用于T1-2和T3-4两组间比较;参数诊断效能用ROC曲线(receiver operating curve)评估,包括最大曲线下面积(AUC)、敏感性(sensitivity)和特异性(specificity),临界值以最大化约登指数计算得到;组内相关系数(intraclass correlation coefficient,ICC)用来评价两观察者间参数测量的稳定性。
2 结果
2.1 患者临床病理结果
50例患者中,T1-2期有19例(38%),T3-4期有31例(62%);所有50例患者中,手术病理结果显示阳性淋巴结53个,其中MRI (DKI序列+常规序列)发现阳性淋巴结36个,准确率为68%。具体结果见表2。
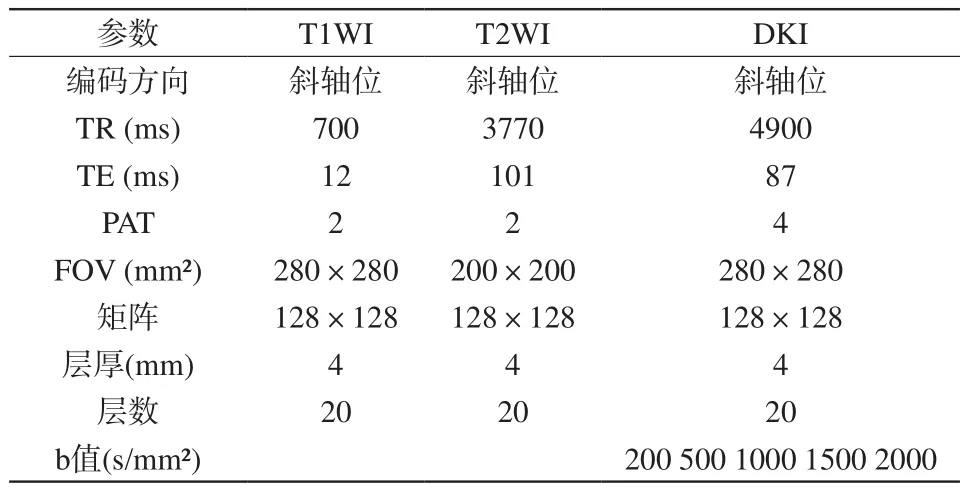
表1 磁共振扫描系列参数表Tab. 1 Imaging protocol parameters and sequences
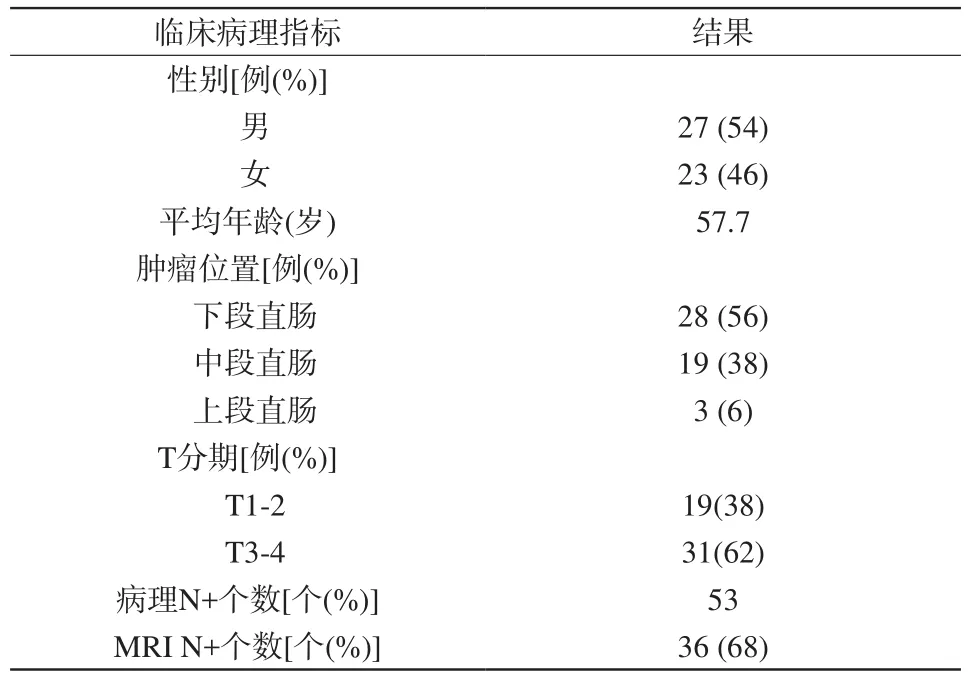
表2 患者临床病理信息Tab. 2 Demographic and clinicopathological characteristics
2.2 各参数在区分早中晚期直肠癌中的价值
ADC值各百分位数及均数中,ADC值10%百分位数及25% 百分位数在早期直肠癌(T1-2)中高于中晚期直肠癌(T3-4),差异有统计学意义[ADC值分别为(0.65±0.08)×10-3mm2/s和(0.58±0.11)×10-3mm2/s,(0.73±0.11)×10-3mm2/s和(0.65±0.11)×10-3mm2/s,P值分别为0.035、0.024]。D值各百分位数及均数中,D值10%百分位数及25% 百分位数在早期直肠癌中高于中晚期直肠癌,差异有统计学意义[D值分别为(0.96±0.19)×10-3mm2/s和(0.84±0.16)×10-3mm2/s,(1.15±0.27)×10-3mm2/s和(0.99±0.18)×10-3mm2/s,P值分别为0.017、0.044]。K值各百分位数值及均值在早中晚期直肠癌中无统计学差异。直方图参数偏度及峰度在早中晚期直肠癌中无统计学差异(表3;图1,2)。
2.3 各参数区分早中晚期直肠癌的诊断效能
ADC值10%百分位数、25%百分位数,D值10%百分位数及25%百分位数在区分早中晚期直肠癌中有统计学差异,其中D值10%百分位数的AUC为0.799,其临界值、敏感性及特异性分别为0.875、84.2%、61.3%;D值10%百分位数有最大敏感性84.2%;ADC值25%百分位数有最大特异性80.6% (表4;图3)。
表3 各参数在区分早中晚期直肠癌(T1-2 vs T3-4)中的价值(mm2/s,±s)Tab. 3 Comparison of histogram imaging indices between T1-2 and T3-4 (mm2/s, ±s)
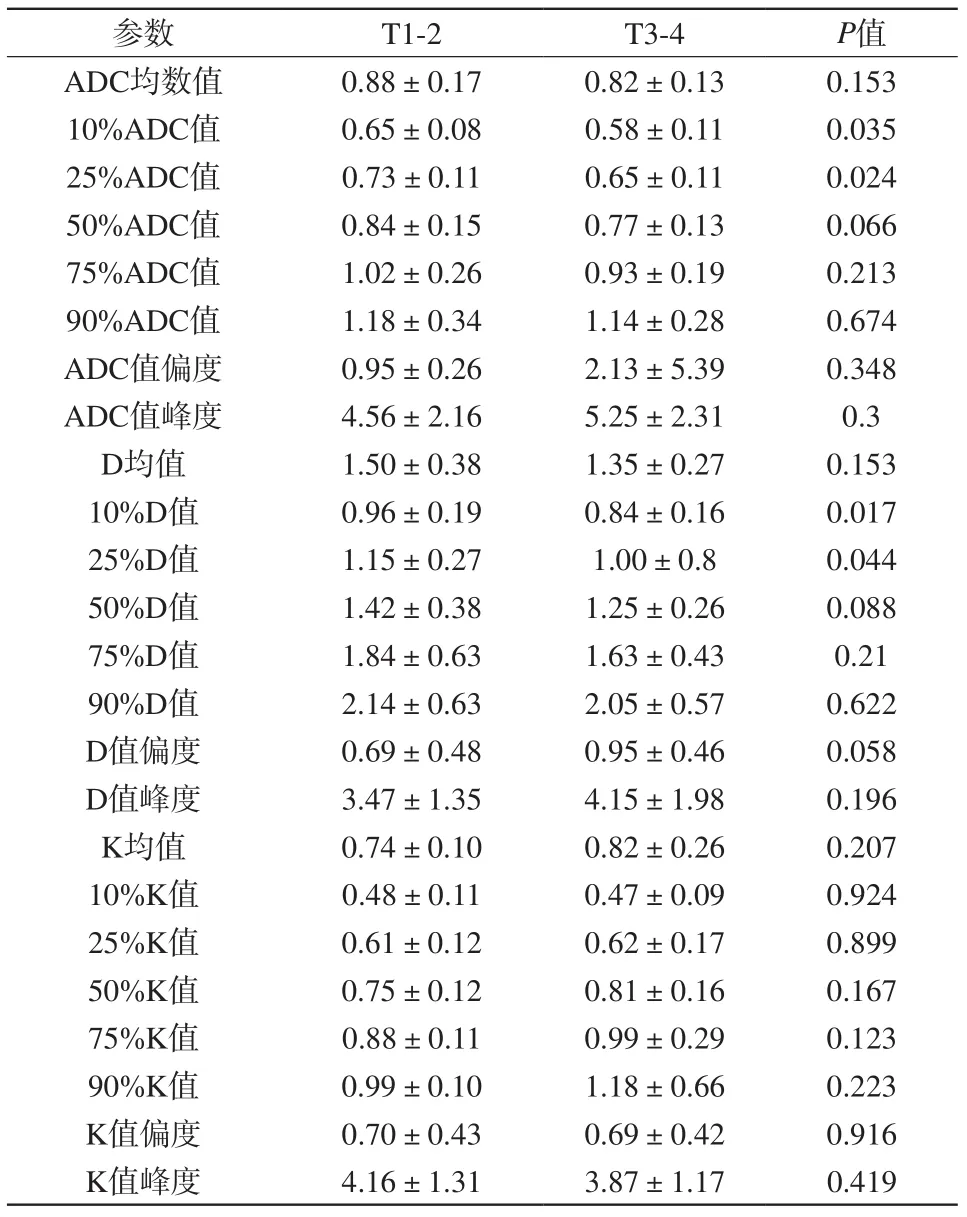
表3 各参数在区分早中晚期直肠癌(T1-2 vs T3-4)中的价值(mm2/s,±s)Tab. 3 Comparison of histogram imaging indices between T1-2 and T3-4 (mm2/s, ±s)
参数 T1-2 T3-4 P值ADC均数值 0.88±0.17 0.82±0.13 0.153 10%ADC值 0.65±0.08 0.58±0.11 0.035 25%ADC值 0.73±0.11 0.65±0.11 0.024 50%ADC值 0.84±0.15 0.77±0.13 0.066 75%ADC值 1.02±0.26 0.93±0.19 0.213 90%ADC值 1.18±0.34 1.14±0.28 0.674 ADC值偏度 0.95±0.26 2.13±5.39 0.348 ADC值峰度 4.56±2.16 5.25±2.31 0.3 D均值 1.50±0.38 1.35±0.27 0.153 10%D值 0.96±0.19 0.84±0.16 0.017 25%D值 1.15±0.27 1.00±0.8 0.044 50%D值 1.42±0.38 1.25±0.26 0.088 75%D值 1.84±0.63 1.63±0.43 0.21 90%D值 2.14±0.63 2.05±0.57 0.622 D值偏度 0.69±0.48 0.95±0.46 0.058 D值峰度 3.47±1.35 4.15±1.98 0.196 K均值 0.74±0.10 0.82±0.26 0.207 10%K值 0.48±0.11 0.47±0.09 0.924 25%K值 0.61±0.12 0.62±0.17 0.899 50%K值 0.75±0.12 0.81±0.16 0.167 75%K值 0.88±0.11 0.99±0.29 0.123 90%K值 0.99±0.10 1.18±0.66 0.223 K 0.700.43 0.690.42 0.916
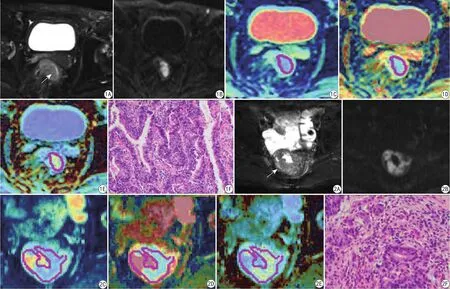
图1 65岁男性直肠腺癌患者图片,病理分期为T2期。A:轴位T2WI,白箭示增厚的直肠管壁;B:DKI图像,增厚直肠管壁呈扩散受限高信号表现;C:ADC图,10%百分位数ADC值为0.52×10-3 mm2/s;D:D值图,10%百分位数D值为0.72×10-3 mm2/s;E:K值图,10%百分位数K值为0.54;F:病理示直肠中分化腺癌(HE ×40) 图2 61岁男性直肠腺癌患者图片,病理分期为T4期。A:轴位T2WI,白箭示环形增厚的直肠肿块;B:DKI图像,增厚直肠肿块呈扩散受限高信号表现;C:ADC图,10%百分位数ADC值为0.48×10-3 mm2/s;D:D值图,10%百分位数D值为0.67×10-3 mm2/s;E:K值图,10%百分位数K值为0.64;F:病理示直肠中分化腺癌(HE ×100)Fig.1 Images in a 65-year-old male show T2 stage in pathology. A: Oblique axis T2WI, the white arrow shows the thickened rectal wall. B: DKI shows a high signal of the thickened rectal wall. C: ADC map, ADC-10th percentile value is 0.52×10-3 mm2/s. D: Diffusivity map, D-10th percentile value is 0.72×10-3 mm2/s. E: Kurtosis map, K-10th percentile value is 0.54. F: The histological specimen shows moderately differentiated rectal adenocarcinoma (HE×40). Fig.2 Images in a 61-year-old male show T2 stage in pathology. A: Oblique axis T2WI, the white arrow shows the annular thickening mass of rectum. B: DKI (b=2000 s/mm2) shows a high signal of the thickened mass of rectal wall. C: ADC map, ADC-10th percentile value is 0.48×10-3 mm2/s.D: Diffusivity map, D- 10th percentile value is 0.67×10-3 mm2/s. E: Kurtosis map, K-10th percentile value is 0.64. F: The histological specimen shows moderately differentiated rectal adenocarcinoma (HE ×100).
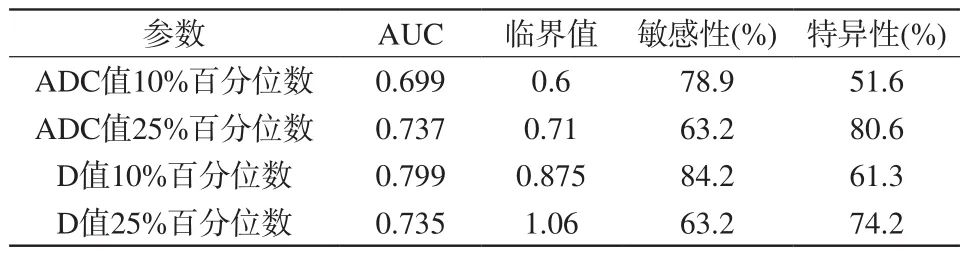
表4 各参数ROC曲线分析Tab. 4 ROC analysis results of parameters
2.4 各参数组内相关系数
ADC值、D值、K值及相应直方图参数在两测量者间重复性好。各参数组内相关系数(ICC)见表5。
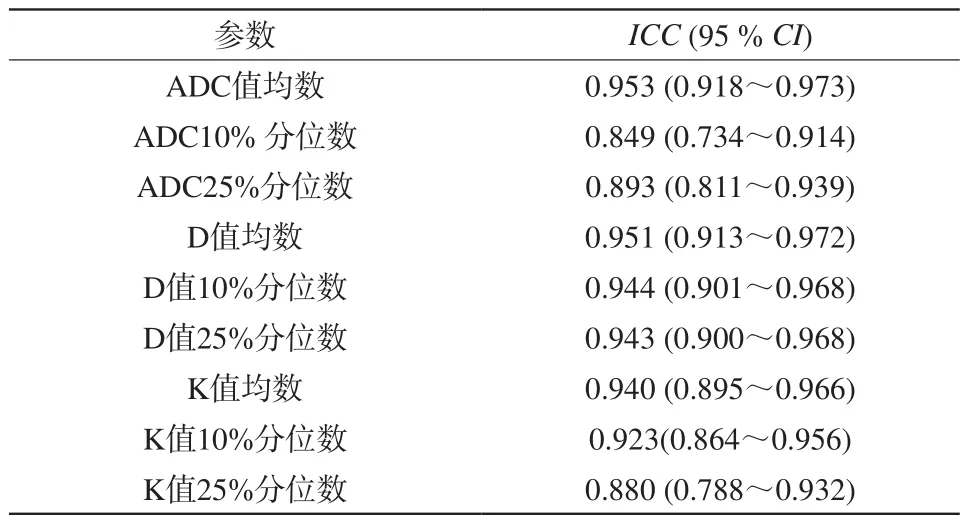
表5 各参数组内相关系数(ICC)Tab. 5 Interobserver agreement (ICC) for variable measurement
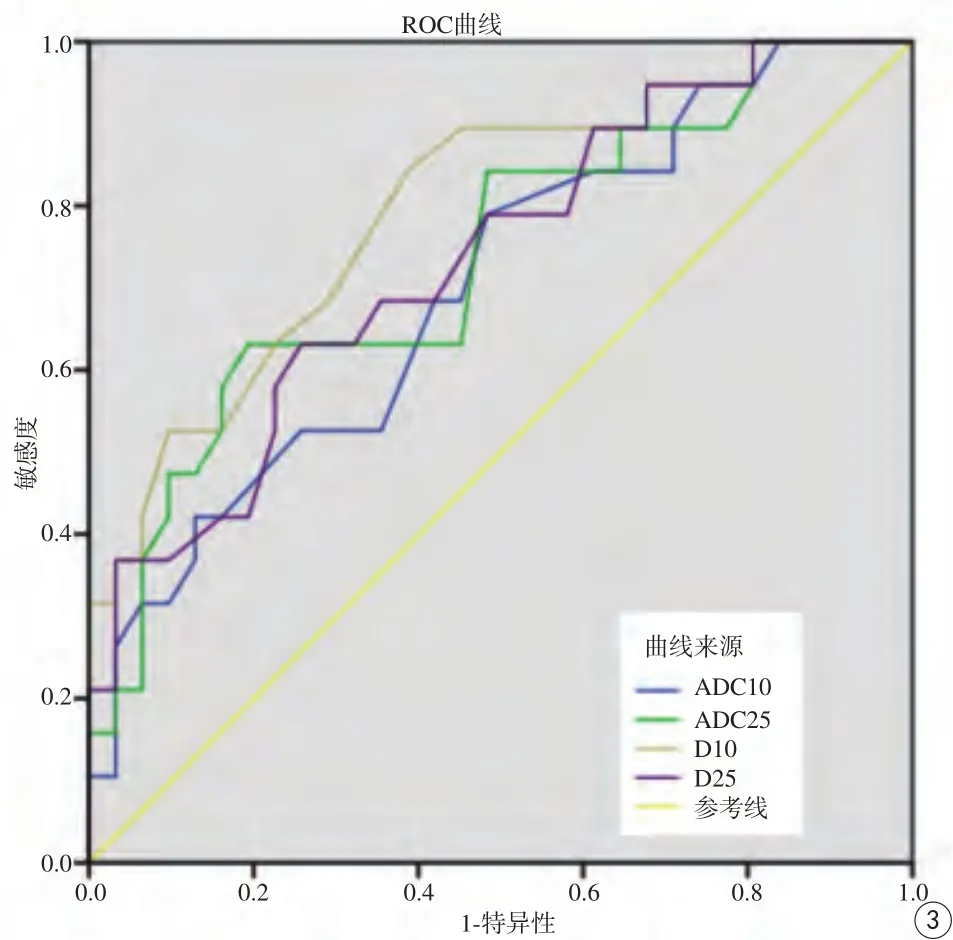
图3 DKI参数ROC曲线图,10%分位D值在区分早中晚期直肠癌时的AUC为0.799,其临界值、敏感性及特异性分别为0.875、84.2% 、61.3%Fig.3 The ROC map of DKI parameters. D-10th percentile value had the largest area under the ROC curve (AUC 0.799), and the cut-off value,sensitivity, and specificity were 0.875, 84.2%, and 61.3%, respectively.
3 讨论
3.1 DKI参数与常规ADC值在直肠癌T分期中的价值
DKI由Jensen等[3]于2005年首次提出,可以反映组织微观结构中的水分子运动的非高斯扩散。传统扩散加权成像(diffusion weighted imaging,DWI)是假设体内水分子基于高斯扩散且扩散不受任何限制,然而实体组织内水分子扩散是受细胞膜等组织微结构限制而呈现非高斯扩散,特别是肿瘤组织内部,组织微结构更复杂且不均一。对直肠癌进行准确分期对临床选择治疗方式至关重要,传统形态学MRI在直肠癌TNM分期中有较大价值,但实际应用过程中其诊断准确性仍然不高。有关DKI定量参数对直肠癌进行分期研究报道甚少。笔者旨在探讨DKI及直方图分析参数在直肠癌术前T分期中的应用价值。结果显示,D值10%百分位数的AUC为0.799,敏感性、特异性分别为84.2%、61.3%,诊断效能优于ADC值及其他参数,证实基于非高斯分布扩散模型的D参数更能反映肿瘤内部水分子真实扩散情况。中晚期直肠癌瘤病灶通常较大,浸润程度更深,其内实体成分较多,其内部肿瘤细胞密度、微血管等组织微结构更复杂,瘤内可并存囊变坏死区域,导致肿瘤组织不均一性增高,微结构更复杂,内部水分子扩散受到限制越严重,从而D值、ADC值越低,K值越高。本文结果显示,D值、ADC值灶在早期直肠癌中高于中晚期直肠癌,K值在早期直肠癌中低于中晚期直肠癌,符合上述变化趋势。本文ADC值与以往研究结果相似[13-14],直肠癌T分期越高其ADC值越低,在不同T分期中差异具有统计学意义。但也有研究报道结果相反,显示ADC值无法区分早中晚期直肠癌。本文结果显示,中晚期直肠癌与早期直肠癌K值比较,虽然差异无统计学意义,但呈现随着直肠癌T分期越高K值越高的变化趋势,这与其他报道结果类似[7]。
3.2 DKI全体积分析及直方图分析在直肠癌T分期中的价值
本文采用全体积直方图分析,对所有有病灶的层面均画取ROI,以体素点为最小单位进行直方图分析,得到各参数10%、25%、50%、75%、90%及偏度、峰度值。结果显示,D值和ADC值的10%及25%百分位数在早期直肠癌低于中晚期直肠癌,差异有统计学意义。对于中晚期直肠癌,肿瘤组织体积较大,容易出现坏死囊变,且位置多在肿瘤的中心区域,坏死区域其肿瘤细胞膜失去完整性,水分子扩散受限程度轻,D值、ADC值相对较高;而周边瘤组织增生更为活跃,细胞密度更高,组织微结构较为复杂,水分子扩散方式也复杂,扩散受限明显,因而周边瘤组织D值、ADC值相对较低,正好对应了直方图分析中参数的10%、25%百分位数值。有研究报道D值25%百分位数代表了不均一瘤灶中较低D值区域[15]。在直肠癌TNM分期中,以肿瘤组织对肠壁的浸润深度进行T分期,而瘤周组织增生活跃,从而解释了D值、ADC值直方图参数(10%、25%百分位数)在早中晚期直肠癌中呈现差异。
3.3 DKI在直肠癌阳性淋巴结判断中的价值
受到侵犯的淋巴结其内部正常组织结构遭到破坏,被瘤细胞取代,其内部组织细胞密度增大,微结构更复杂,扩散受限更明显,在DKI扩散图中表现为高信号。对淋巴结的准确分期直接影响到临床治疗方式的选择,因而提高对淋巴结分期准确性显得尤为重要。现有检查手段中,磁共振对淋巴结的分期优势较大,包括传统形态学磁共振、扩散加权成像及动态增强序列,然而其准确性仍无法满足临床要求。Doyon等[16]研究结果显示,传统形态学MRI对直肠癌淋巴结分期诊断敏感性、特异性和准确性分别为94%、13%、34%;一些学者的研究对淋巴结分期的准确性分别为43%、69%、72%[17-19]。可见,传统磁共振对淋巴结的分期准确性都不高,且结果差异较大。扩散加权成像在近几年应用较多,但传统DWI序列判断淋巴结分期研究结果也存在差异。Curvo-Semedo等[20]及Cho等[21]的研究显示ADC值可用于直肠癌淋巴结分期,后者结果显示准确性可达70%;而另外一些研究结果则相反,认为ADC值无法区分淋巴结是否受侵犯[11,16,22]。在本研究中,DKI序列结合常规磁共振序列对直肠癌淋巴结分期准确性为68%。但标准未对淋巴结进行DKI相关参数定量值测定,有待进一步研究。总之,目前检查手段对直肠癌淋巴结分期准确性不高且较为困难,而多b值DKI序列对淋巴结分期显示了一定的价值,其对淋巴结的准确分期有待定量参数及更多大样本多中心的研究来证实。
标准用全体积直方图分析来研究DKI参数在直肠癌分期中的价值,结果显示D值10%百分位数区分早中晚期直肠癌中有最高的诊断效能,说明D值可作为直肠癌术前分期的有效生物学指标。但本研究也存在一些不足:属于回顾性分析,存在一定的选择性偏倚,需更多大样本多中心的研究来证实DKI的价值。
参考文献 [References]
[1] Yu J, Huang DY, Li Y, et al. Correlation of standard diffusion weighted imaging and diffusion kurtosis imaging with distant metastases of rectal carcinoma. J Magn Reson Imaging, 2016, 44(1):221-229.
[2] Rebecca L, Siegel MP, Kimberly D, et al. Cancer statistics, 2016. CA Cancer J Clin, 2016, 66(1): 7-30.
[3] Jensen JH, Helpern JA, Ramani A, et al. Diffusional kurtosis imaging: the quantification of non-gaussian water diffusion by means of magnetic resonance imaging. Magn Reson Med, 2005,53(6): 1432-1440.
[4] Hari DM, Leung AM, Lee JH, et al. AJCC Cancer Staging Manual 7th edition criteria for colon cancer: do the complex modifications improve prognostic assessment? J Am Coll Surg, 2013, 217(2): 181-190.
[5] Hu F, Tang W, Sun Y, et al. The value of diffusion kurtosis imaging in assessing pathological complete response to neoadjuvant chemoradiation therapy in rectal cancer: a comparison with conventional diffusion-weighted imaging. Oncotarget, 2017, 8(4):75597-75606.
[6] Huang L, Li XH, Huang SY, et al. Application and advances of diffusion kurtosis imaging in abdomen. Internat J Med Radiol,2016(05): 527-530.黄丽, 李雪华, 黄斯韵, 等. MR扩散峰度成像在腹部的研究现状.国际医学放射学杂志, 2016(5): 527-530.
[7] Zhu L, Pan Z, Ma Q, et al. Diffusion kurtosis imaging study of rectal adenocarcinoma associated with histopathologic prognostic factors:preliminary findings. Radiology, 2017, 284(1): 66-76.
[8] Rosenkrantz AB, Padhani AR, Chenevert TL, et al. Body diffusion kurtosis imaging: Basic principles, applications, and considerations for clinical practice. J Magn Reson Imaging, 2015, 42(5): 1190-1202.
[9] Yu J, Xu Q, Song JC, et al. The value of diffusion kurtosis magnetic resonance imaging for assessing treatment response of neoadjuvant chemoradiotherapy in locally advanced rectal cancer. Eur Radiol,2017, 27(5): 1848-1857.
[10] Jensen JH, Helpern JA. MRI quantification of non-Gaussian water diffusion by kurtosis analysis. NMR Biomed, 2010,23(7): 698-710.
[11] Heijnen LA, Lambregts DM, Mondal D, et al. Diffusion-weighted MR imaging in primary rectal cancer staging demonstrates but does not characterise lymph nodes. Eur Radiol, 2013, 23(12): 3354-3360.
[12] Kim CK, Kim SH, Chun HK, et al. Preoperative staging of rectal cancer: accuracy of 3-Tesla magnetic resonance imaging. Eur Radiol,2006, 16(5): 972-980.
[13] Sun Y, Tong T, Cai S, et al. Apparent Diffusion Coefficient (ADC)value:a potential imaging biomarker that reflects the biological features of rectal cancer. PLoS One, 2014, 9(10): e109371.
[14] Lu Z, Qian W, Cao W, et al. Value of diffusion-weighted MRI in the diagnosis of T staging for rectal cancer. Zhonghua Wei Chang Wai Ke Za Zhi, 2015, 18(3): 257-261.
[15] Fujima N, Yoshida D, Sakashita T, et al. Prediction of the treatment outcome using intravoxel incoherent motion and diffusional kurtosis imaging in nasal or sinonasal squamous cell carcinoma patients. Eur Radiol, 2017, 27(3): 956-965.
[16] Doyon F, Attenberger UI, Dinter DJ, et al. Clinical relevance of morphologic MRI criteria for the assessment of lymph nodes in patients with rectal cancer. Int J Colorectal Dis, 2015, 30(11): 1541-1546.
[17] Maier AG, Kersting-Sommerhoff B, Reeders JW, et al. Staging of rectal cancer by double-contrast MR imaging using the rectally administered superparamagnetic iron oxide contrast agent ferristene and IV gadodiamide injection: results of a multicenter phase II trial. J Magn Reson Imaging, 2000, 12(5): 651-660.
[18] Gagliardi G, Bayar S, Smith R, et al. Preoperative staging of rectal cancer using magnetic resonance imaging with external phasearrayed coils. Arch Surg, 2002, 137(4): 447-451.
[19] Kim JH, Beets GL, Kim MJ, et al. High-resolution MR imaging for nodal staging in rectal cancer: are there any criteria in addition to the size? Eur J Radiol, 2004, 52(1): 78-83.
[20] Curvo-Semedo L, Lambregts DM, Maas M, et al. Diffusion-weighted MRI in rectal cancer: apparent diffusion coefficient as a potential noninvasive marker of tumor aggressiveness. J Magn Reson Imaging,2012, 35(6): 1365-1371.
[21] Cho EY, Kim SH, Yoon JH, et al. Apparent diffusion coefficient for discriminating metastatic from non-metastatic lymph nodes in primary rectal cancer. Eur J Radiol, 2013,82(11): e662-e668.
[22] Attenberger UI, Pilz LR, Morelli JN, et al. Multi-parametric MRI of rectal cancer: do quantitative functional MR measurements correlate with radiologic and pathologic tumor stages? Eur J Radiol, 2014,83(7): 1036-1043.

