盐胁迫下水稻孕穗期SS和SPS活性与糖积累的响应及其相关性分析
王旭明, 赵夏夏, 陈景阳, 龚茂健, 杨 善, 谢 平, 莫俊杰, 黄永相, 叶昌辉,周鸿凯
(广东海洋大学农学院,广东 湛江 524088)
水稻是中国4大主要粮食作物之一,而土壤盐渍化是全世界农业面临的严重问题。盐胁迫影响养分运输和分布,造成植物营养失衡,导致作物发育迟缓,植株矮小,严重威胁国家粮食安全[1-5]。糖是植物体内一类重要有机物,它存在的形式广泛,为植物的生长发育提供碳骨架和能量[6]。逆境胁迫下,植物还通过调节体内糖的分配,维持细胞的渗透势,增强植物抗逆性[7]。脯氨酸与可溶性糖可作为有机渗透调节物质参与细胞的渗透调节以及抗逆生理恢复和修复过程[8]。Qiu等[9]在对拟南芥幼苗的研究中发现外源蔗糖通过激活SOD、POD和CAT活性以提高拟南芥幼苗对盐胁迫的耐受性,但高浓度的糖抑制拟南芥幼苗早期的发育。拟南芥子叶、真叶、根的生长均受高浓度糖的影响[10]。
与植物蔗糖代谢密切相关的酶主要有磷酸蔗糖合成酶(SPS)、蔗糖合成酶(SS)、转化酶(Inv)[11]。其中合成蔗糖的酶类主要有SS和SPS,而分解蔗糖的酶类主要有可溶性酸性转化酶(SAI)、细胞壁结合转化酶(CIN)、中性/碱性转化酶(NI),而SS在蔗糖代谢中既参与正向合成又具有分解蔗糖的反向功能[12]。葡萄糖、果糖和蔗糖是糖积累的主要产物,而蔗糖代谢相关酶活性水平不仅影响含糖量,而且还决定“库”器官中积累糖的成分[13]。
蔗糖合成酶是蔗糖代谢关键酶中极其重要的一种可溶性酶[14],是蔗糖合成途径中的一个重要控制点,其活性反映蔗糖生物合成途径的能力[15]。蔗糖合成酶在植物体中有3种存在形式,即细胞质中的可溶性蔗糖合成酶,附着在细胞膜上的不溶性蔗糖合成酶和与细胞骨架相结合的蔗糖合成酶[16]。蔗糖合成酶也是唯一能使蔗糖参与到组织构建、物质贮藏(淀粉合成)和植物细胞新陈代谢(糖酵解)等多种路径的酶[17]。
植物光合组织(主要是叶片)和非光合组织(果实、贮藏块根、贮藏块茎等)中都广泛存在蔗糖磷酸合成酶(SPS)[18],其中植物叶肉细胞SPS的活性最大[19]。转入玉米SPS基因的烟草幼叶和老叶中SPS活性超量表达,是野生型的10倍,老叶SPS活性的提高能促进植株的生长和发育,有助于开花数目的增加[20]。Huber研究发现SPS活性与蔗糖形成量呈正相关[21],而且主要调节光合产物蔗糖和淀粉的分配[22]。SPS与植物的株高和产量等农艺性状密切相关[23],并且在抗寒、抗旱和耐盐等抗逆过程中起重要作用[24]。
陈丽芳等发现盐胁迫可以提高黄瓜幼苗可溶性总糖、蔗糖及根系可溶性总糖和蔗糖含量,降低根系淀粉含量,同时提高根系磷酸蔗糖合酶(SPS)、蔗糖合酶(SS)和淀粉水解酶活性及叶片SPS、SS活性,降低叶片淀粉水解酶活性[25]。孕穗期水稻经过不同时间的冷水胁迫后,其功能叶片中SS活性与功能叶片蔗糖和果糖含量均呈正相关,齐穗后14 d功能片中SPS活性与蔗糖、果糖含量呈现显著或极显著正相关,而SPS活性与可溶性糖含量在齐穗后 7~21 d呈正相关但不显著[26]。目前对SPS和SS活性与成熟期甘蔗、番茄、猕猴桃以及水稻籽粒糖代谢相关性的研究[27-28]较多,但是对于盐胁迫逆境中水稻孕穗期SS和SPS活性与糖类代谢的相关性研究鲜有报道。本研究旨在探究盐胁迫对孕穗期水稻SS、SPS活性与糖积累的相关性影响及它们之间的变化规律,进一步揭示盐胁迫下水稻糖代谢机制,为创新水稻栽培技术和耐盐品种的选育提供理论依据。
1 材料与方法
1.1 试验材料
3个水稻种质IR29、JX99、Pokkali均由广东海洋大学农学院提供,其中IR29是盐敏感型,JX99是耐盐型,Pokkali是强耐盐型。用广东海洋大学农学院实验田水稻土作为桶栽基土,其理化性质为有机质含量32.864 g/kg、全磷0.462 g/kg、全钾22.414 g/kg、水溶性盐总量0.854 g/kg、速效磷65.000 mg/kg、速效钾117.210 mg/kg、碱解氮177.450 mg/kg、pH6.47。土样风干碾碎后过2 mm筛,充分混匀,与不同浓度的盐混合均匀后装桶(内径30 cm,高35 cm,无渗漏),每桶装15 kg。
1.2 试验方法
1.2.1 水稻幼苗的培养 2016年7月12日,选择饱满籽粒,先用蒸馏水浸泡5 min,再用10% H2O2浸泡20 min,用去离子水冲洗干净,均匀平铺于无菌培养皿中,放置30 ℃种子培养箱中催芽48 h。催芽期间换水6次,保持培养皿湿润。待种子露白后种植于广东海洋大学农学院水稻实验田中。
1.2.2 盐胁迫处理 2016年7月27日,取过筛的风干基土添加不同质量比的盐胁迫添加剂氯化钠(分析纯,西陇化工股份有限公司生产),形成0.1%、0.2%、0.3%、0.4%、0.5% 5个氯化钠处理组,以不添加氯化钠的基土为对照。每桶施4 g复合肥作为基肥,随机区组试验设计,每组3桶,共54桶。 8月6日,选取长势均匀的3叶1心期秧苗,移栽到试验桶中,每桶6株。将试验桶放在玻璃温室内,每桶保持2 cm水层,桶中插入标尺测定水位,根据缺水情况,补水至相同刻度。生长期间早晚观察水稻生长状况,每天拍照记录,并使用土壤含盐量测试仪(台湾衡欣公司产品,Az8371型)监测桶内土壤含盐量,以保证整个生长过程中桶内土壤含盐量保持相对稳定,土壤含盐量测定结果见表1。

表1 桶栽试验土壤含盐量
处理1~5分别为在基土中添加质量比为0.1%、0.2%、0.3%、0.4%、0.5%的氯化钠。
1.2.3 生理生化指标的测定 2016年9月22日,水稻幼苗正处于孕穗期,早晨6∶30开始采样,每桶选取3株长势一致的整株,将根系清洗干净,拍照记录。株高的测定参照肇莹等[29]的方法。选取剑叶测定生理生化指标,可溶性糖含量的测定参照Bradford[30]的蒽酮比色法,蔗糖含量的提取和测定参照文献[31]的方法,SS、SPS活性的测定参照韩涛[26]、杨明[32]的方法进行。每个指标重复测定3次。
1.2.4 数据分析 运用SPSS19.0软件进行数据分析,作图通过SigmaPlot 10.0作图软件完成。
2 结果与分析
2.1 盐胁迫下3个水稻种质的株高变化
从图1可以看出,随着土壤NaCl添加量的增加,3个水稻种质的株高均呈下降趋势,但3个种质的株高对盐胁迫的响应有所差异。说明盐胁迫影响水稻植株株高,影响程度与种质的耐盐性和土壤含盐量有关。当NaCl添加量达到0.4%时,3个水稻外观特性受盐害影响较明显,具体表现为株高均明显变矮、叶面积变小、分蘖较少、心叶卷曲、叶片发黄、叶缘枯萎,其中IR29受盐害程度较严重,而Pokkali、JX99较轻(图2)。
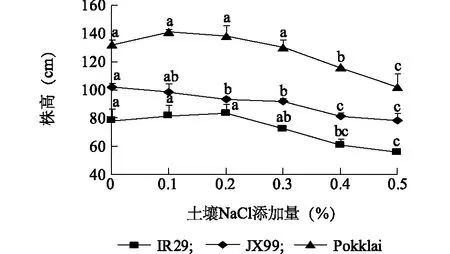
同一个种质不同小写字母表示不同质量浓度之间差异显著。图1 盐胁迫下3个水稻种质(IR29、JX99、Pokkali)的株高变化Fig.1 Change of plant height of three rice germplasms (IR29, JX99, Pokkali) under salt stress

图2 盐胁迫下水稻种质IR29、JX99、Pokkali的生长状况Fig.2 The growth status of rice germplasms IR29, JX99, Pokkali under salt stress
2.2 盐胁迫下3个水稻种质叶片蔗糖含量变化
随着盐胁迫浓度增大,3个种质的叶片蔗糖含量均呈逐渐升高的趋势,然而种质间的蔗糖含量存在显著差异,其中IR29的蔗糖含量水平较高(图3)。在5个盐胁迫水平间,同一种质的蔗糖含量呈现显著差异,其中IR29蔗糖积累量较高;同一胁迫水平,IR29与Pokkali、JX99间的蔗糖含量差异显著,但是Pokkali与JX99间差异不显著。说明盐胁迫影响植株蔗糖的合成与积累,盐敏感种质IR29积累较多的蔗糖以缓解盐胁迫伤害,而耐盐性种质的蔗糖积累对盐害的敏感性较低,受影响较小。

同一个种质不同小写字母表示不同质量比之间差异显著。图3 盐胁迫下水稻种质IR29、JX99、Pokkali叶片蔗糖含量Fig.3 The sucrose content in leaves of rice germplasms IR29, JX99, Pokkali under salt stress
2.3 盐胁迫下3个水稻种质叶片可溶性糖含量变化
由图4可知,随着盐胁迫水平的增高,3个种质叶片可溶性糖含量变化有所差异:Pokkali、JX99的可溶性糖含量逐渐升高,而IR29的可溶性糖含量保持较高的积累水平,在盐胁迫水平0.4%后又逐步降低。随着盐胁迫浓度增高,同一种质不同盐浓度间可溶性糖含量呈现显著差异,但IR29在0.4%~0.5%盐胁迫水平间差异不明显;同一胁迫水平下,3个种质间可溶性糖含量呈现显著差异,但在0.4%胁迫水平下差异不显著。说明盐胁迫影响水稻植株可溶性糖的合成与积累,耐盐性不同的种质存在较大差异。在盐胁迫下水稻种质积累较多可溶性糖,以缓解盐害胁迫。

同一个种质不同小写字母表示不同质量比之间差异显著。图4 盐胁迫下水稻种质IR29、JX99、Pokkali叶片可溶性糖含量Fig.4 The soluble sugar content in leaves of rice germplasms IR29, JX99, Pokkali under salt stress
2.4 盐胁迫下3个水稻种质叶片SS活性变化
随着盐胁迫浓度的增高,3个种质的SS活性均呈先升后降的趋势,但不同种质的响应各有差异(图5)。在0.2%胁迫水平下IR29的SS活性达到峰值,之后随盐浓度的升高而急剧降低;Pokkali、JX99在盐胁迫下SS活性明显高于IR29,在0.3%盐胁迫水平下达到峰值,而后急剧降低,但SS活性仍较高。在不同盐胁迫水平下,3个种质的SS活性均表现出显著差异,种质间的差异也较为显著。说明盐胁迫影响水稻植株SS活性,耐盐性不同的水稻种质SS活性对盐胁迫的响应有较大差异。

同一个种质不同小写字母表示不同质量比之间差异显著。图5 盐胁迫下水稻种质IR29、JX99、Pokkali叶片蔗糖合成酶(SS)活性Fig.5 The sucrose synthase (SS) activity in leaves of rice germplasms IR29, JX99, Pokkali under salt stress
2.5 盐胁迫下3个水稻种质叶片SPS活性变化
由图6可知,随着NaCl胁迫浓度的增加,3个水稻种质的SPS活性呈先升高后降低的趋势,而且变化趋势具有同步一致性;在盐胁迫过程中IR29的SPS活性明显高于JX99、Pokkali,在0.2%胁迫水平下达到峰值,而后急剧降低,但仍保持较高水平。不同盐胁迫水平间,3个种质的SPS活性均呈显著差异;同一胁迫水平下这3个种质的SPS活性也达到显著差异。说明盐胁迫影响了SPS活性,这3个水稻种质的SPS活性对盐胁迫的响应具有一致性。盐敏感型种质在盐胁迫下,SPS活性保持较高的水平。

同一个种质不同小写字母表示不同质量比之间差异显著。图6 盐胁迫下水稻种质IR29、JX99、Pokkali叶片磷酸蔗糖合成酶(SPS)活性变化Fig.6 The sucrose phosphate synthase (SPS) activity in leaves of rice germplasms IR29, JX99, Pokkali under salt stress
2.6 盐胁迫下水稻SS、SPS活性与糖代谢指标的相关性
由表2可见,盐胁迫下,水稻植株SPS活性与蔗糖含量之间不仅呈简单正相关和正偏相关关系,还达到极显著水平,而SPS活性与可溶性糖含量之间呈极显著的负偏相关关系,表明SPS活性的增强直接促进蔗糖的合成与积累,却抑制了可溶性糖的合成。SS活性与蔗糖含量之间呈负简单相关和负偏相关关系,均达到极显著水平,却与可溶性糖含量之间呈极显著的正偏相关关系,说明SS活性的升高抑制了蔗糖的合成与积累,但是促进了可溶性糖的合成。株高与蔗糖含量之间呈极显著的负偏相关和简单负相关关系,说明盐胁迫下,蔗糖作为小分子有机物参与渗透调节,维持植株正常的生命活动,生长发育却受到抑制。参与糖代谢的两个关键酶SPS和SS活性之间呈极显著的正偏相关关系,共同促进调节糖代谢平衡。
3 讨 论
不同程度的盐胁迫对水稻的生长发育有显著影响[33]。本研究结果表明,中度盐胁迫(添加0.4%~0.5% NaCl,质量比)显著抑制了水稻的生长发育,表现为植株变矮、叶面积较小、分蘖数减少、叶片枯萎等,这与李姝晋等[34]的研究结论一致。正常生长条件下,在“源”叶片的细胞质中,植物通过光合作用合成并积累蔗糖和可溶性糖,一部分用于维持自身代谢,另外一部分运输到“库”组织供自身生长[35]。水稻植株的蔗糖、可溶性糖的合成与积累与株高的变化趋势具有同步一致性。但在盐胁迫下,盐敏感型种质IR29的蔗糖、可溶性糖积累量较另外2个耐盐种质更为明显,但其植株生长发育受到的抑制作用也更为明显。盐敏感型植株通过光合作用合成并积累的蔗糖和可溶性糖,有一部分用于缓解盐胁迫造成的细胞渗透作用以及抗逆生理的恢复,导致用于植株生长的蔗糖和可溶性糖不足,而表现为随盐胁迫水平的增加植株变矮、叶面积较小、分蘖数减少、叶片枯萎等。

表2 盐胁迫下水稻SS、SPS活性与糖代谢指标的相关性
*表示相关性显著(P<0.05);**表示相关性极显著(P<0.01)。左下区域为简单相关性,右上区域为偏相关性。
通过相关性分析发现,盐胁迫下,SPS与SS共同参与糖代谢平衡,但SPS直接促进蔗糖的合成,却抑制了可溶性糖的合成,而SS促进可溶性糖的积累却抑制了蔗糖的积累,说明盐胁迫对水稻植株蔗糖和可溶性糖的合成与积累的影响是SS与SPS共同调控的结果,这与刘海波等[36]的研究结论一致。
轻度盐胁迫激发SS、SPS活性显著增强,缓解细胞渗透压,促进植株生长发育,维持正常生命活动。而中度、重度盐胁迫下,SS、SPS活性降低,但敏感型种质IR29的SPS活性仍保持较高水平,促进蔗糖合成与减少积累,有助于缓解糖代谢对光合作用的负反馈抑制,保持正常光合作用,维持正常生命活动,提高水稻植株的抗逆性[37],但表现为植株生长发育受到明显的抑制。
参考文献:
[1] 张 战,张丽丽,倪善君,等.滨海盐碱土对水稻苗期生长及生理特性的影响[J].江苏农业科学,2016,44(6):111-114.
[2] 刘 梅,郑青松,刘兆普,等. 盐胁迫下氮素形态对油菜和水稻幼苗离子运输和分布的影响[J]. 植物营养与肥料学报,2015,21(1):181-189.
[3] 王恩旭,张方亮,商德虎,等. 海水和NaCl胁迫对水稻种子萌发与幼苗生长影响的比较[J]. 山东农业科学,2016,48(10):54-57.
[4] 夏秀忠, 张宗琼, 杨行海,等. 广西地方稻种资源核心种质的耐盐性鉴定评价[J].南方农业学报,2017,48(6):979-984.
[5] 周 毅,崔丰磊,杨 萍,等.盐胁迫对不同品种水稻幼苗生理生化特性的影响[J].江苏农业科学,2016,44(1):90-93.
[6] WANG J J, TANG Z H. The regulation of soluble sugars in the growth and development of plants[J]. Botanical Research,2014, 3:71-76.
[7] 岳 川. 茶树糖类相关基因的挖掘及其在茶树冷驯化中的表达研究[D]. 北京:中国农业科学院,2015.
[8] 王以斌,缪锦来,姜英辉,等. 脯氨酸和可溶性糖在南极冰藻低温适应机制中的作用[J]. 生物技术通报,2016,32(2):198-202.
[9] QIU Z B,WANG Y F,ZHU A J,et al. Exogenous sucrose can enhance tolerance ofArabidopsisthalianaseedlings to salt stress[J]. Biologia Plantarum,2014,58(4):611-617.
[10] YOSHIDA S, ITO M, NISHIDA I,et al. Identification of a novel gene HYS1/CPR5 that has a repressive role in the induction of leaf senescence and pathogen defence responses inArabidopsisthaliana[J]. Plant Journal, 2002,29(4):427-437.
[11] BALIBREA L M E, GONZALEZ G M C, FATIMA T, et al. Extracellular invertase is an essential component of cytokinin-mediated delay of senescence[J]. Plant Cell,2004,16 (5):1276-1287.
[12] STURM A. Invertases: Primary structures, functions and roles in plant development and sucrose partitioning[J]. Plant Physiol,1999,121(1):1-8.
[13] 牛俊奇,黄静丽,赵文慧,等. 甘蔗工艺成熟期SS和SPS酶活性与糖分积累的相关性研究[J]. 生物技术通报,2015,31(9):105-110.
[14] 郭艳利,杨肖芳,蒋 黎,等. 蔗糖代谢相关酶与果实糖代谢[J]. 现代园艺,2012(9):10-12.
[15] FISHER D B, WANG N.Sucrose concentration gradients along the post-phloem transport pathway in the maternal tissue of developing wheat grains[J]. Plant Physiology,1995,109(2):587.
[16] LING S E. Sugar metabolism during growth and development in sugarcane internodes[J]. Crop Sci,1999,39:480-486.
[17] 陈俊伟,张上隆,张良诚,等. 柑橘果实遮光处理对发育中的果实光合产物分配、糖代谢与积累的影响[J]. 植物生理学报,2001,27(6):499-504.
[18] 张明方,李志凌.高等植物中与蔗糖代谢相关的酶[J]. 植物生理学报,2002,38(3):289-295.
[19] LUNN J E, FURBANK R T. Localisation of sucrose-phosphate synthase and starch in leaves of C4 plants[J]. Planta,1997,202(1):106.
[20] 刘凌霄,沈法富,卢合全,等. 蔗糖代谢中蔗糖磷酸合成酶(SPS)的研究进展[J]. 分子植物育种,2005,3(2):275-281.
[21] HUBER S C. Role of sucrose-phosphate synthase in partitioning of carbon in leaves[J]. Plant Physiology,1983,71(4):818-821.
[22] HUBER S C, HUBER J L. Role and regulation of sucrose phosphate synthase in higher plants[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1996,47(2):431.
[23] ISHIMARU K, ONO J, KASHIWAGI T. Identification of a new gene controlling plant height in rice using the candidate-gene strategy [J]. Planta,2004,218(3):388-395.
[24] 刘洪博,陆 鑫,毛 钧,等. 甘蔗蔗糖磷酸合成酶研究进展[J]. 湖南农业大学报,2013,39(1):31-36.
[25] 陈丽芳,陆 巍,孙 锦,等. 外源亚精胺对盐胁迫下黄瓜幼苗光合作用和根叶碳水化合物积累的影响[J]. 南京农业大学学报,2011,34(3):31-36.
[26] 韩 涛.孕穗期冷水胁迫对水稻碳水化合物形成积累规律的影响[D].哈尔滨:东北农业大学,2014.
[27] 张明方,李志凌. 高等植物中与蔗糖代谢相关的酶[J]. 植物生理学报,2002,38(3):289-295.
[28] 邱献锟,周海庆,崔玉花. 水稻大粒种质籽粒SS、SPS酶活性研究[J]. 延边大学农学学报,2013,35(4):322-327.
[29] 肇 莹,王丽萍,肖 军,等. 水稻转导外源总DNA变异后代盐胁迫下株高及生理指标分析[J]. 生物技术通报,2012(12):71-75.
[30] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry,1976,72(1/2):248-254.
[31] 张志良,瞿伟菁.植物生理学实验指导[M].北京:高等教育出版社,2003:128.
[32] 杨 明. 甜高粱蔗糖代谢相关酶SPS、SS表达与蔗糖积累的相关性研究[D].保定:河北农业大学,2008.
[33] 荆培培,崔 敏,秦 涛,等. 土培条件下不同盐分梯度对水稻产量及其生理特性的影响[J]. 中国稻米,2017,23(4):26-33.
[34] 李姝晋,朱建清,叶小英,等. 干旱和盐胁迫下水稻品种的双重耐性差异[J]. 西南农业学报,2005,18(2):128-132.
[35] 刘春娟,冯乃杰,郑殿峰,等. 植物生长调节剂S3307和DTA-6对大豆源库碳水化合物代谢及产量的影响[J]. 中国农业科学,2016,49(4):657-666.
[36] 刘海波,魏玉清,周维松,等. 土壤盐分胁迫对甜高粱茎秆糖分积累及蔗糖代谢相关酶活性的影响[J]. 西北农林科技大学学报(自然科学版),2017,45(5):41-47.
[37] 陈丽芳. 外源亚精胺对盐胁迫下黄瓜幼苗CO2同化代谢的影响[D].南京:南京农业大学,2011.

