血清miR-21和CA199对胰腺癌临床诊断的应用价值探讨
茅肖娜,汪莉莉
(浙江省宁波市鄞州区第二医院检验科 315000)
胰腺癌是一种恶性程度和病死率极高的癌症之一,近年来发病率呈上升趋势,严重威胁着患者的生命安全[1-2]。胰腺癌在病情早期无明显症状,多数患者在确诊时病情已进展至丧失根治性切除时机,加上胰腺在解剖结构上毗邻关系复杂,穿刺活检操作难度大[3];且胰腺癌具有明显的侵袭性生物学行为[4],因此目前主要的诊断手段穿刺活检对胰腺癌的临床应用价值非常有限,迫切需要寻求一种能够在较为早期提示病情且便于操作的诊断方法[5]。检测血液中的肿瘤标志物在目前恶性疾病的筛查和诊断中发挥着越来越重要的作用。有研究报道显示,CA199是一种糖蛋白肿瘤标志物,在胰腺癌患者的血清中水平增加明显,是目前对胰腺癌诊断最为常用的肿瘤标志物[6],但其特异度和敏感度均不甚理想[7]。随着研究的不断深入,有研究发现多种恶性疾病的发生发展过程中都伴随着微小RNA(miRNA)的表达变化,miRNA近年来也被作为一种潜在的肿瘤标志物受到了研究者的普遍关注,已有研究指出miR-21对胰腺癌的发生发展起着重要作用[8-9]。因此,本研究通过检测胰腺癌患者血清中的miR-21和CA199的表达情况,并评价其对胰腺癌的诊断价值,旨在为临床实践提供参考依据。
1 资料与方法
1.1一般资料 选择2015年1月至2016年6月在本院就诊的胰腺癌患者124例(癌症组),良性胰腺疾病患者100例(良性对照组)及同期健康体检者100例(健康对照组)作为观察对象。其中,癌症组男59例,女65例,年龄47~72岁,平均(52.7±12.8)岁;良性对照组男51例,女49例,年龄45~76岁,平均(53.9±11.6)岁;健康对照组男53例,女47例,年龄43~74岁,平均(54.2±14.3)岁。所有疾病患者均经病理学确诊,且入组前未行放疗化疗及其他免疫疗法,健康对照组患者的所有体检指标均正常。经统计分析,3组患者的年龄及性别构成比较差异均无统计学意义(P<0.05),具有可比性。所有研究对象对本研究均知情同意并签署知情同意书。
1.2方法 采集所有研究对象的空腹静脉血,2 h内在4 ℃低温离心机中以4 000 r/min离心10 min,分离血清置于4 ℃保存待测。其中用于检测miRNA的血清样本再次以12 000 r/min离心10 min以确保血清样本中不含任何细胞碎片,置于不含RNA酶的EP管中待测。CA199采用瑞士Roche公司的全自动生化分析仪E170模块及其配套试剂检测,严格按照仪器操作规程进行操作,正常参考值范围小于或等于37 U/mL。miR-21采用德国Qiagen公司提供的miRNeasy Serurn/Plasma试剂盒,按照操作说明书进行,提取200 mL血清中的总RNA并使用脱氧核糖核酸酶(RnaseⅠ)酶解后,使用QIAGEN miScript Reverse Transcripition Kit试剂盒进行反转录,按照试剂盒说明书进行操作,最后使用瑞士Roche公司的Real time PCR仪LightCycler Ⅱ480进行检测,选择Absoulute Quantification,PCR起始-反应条件为95 ℃ 15 min;而后依次为94 ℃ 15 s变性、55 ℃ 30 s退火、70 ℃ 30 s延伸3步循环,共循环40次。内参为RNU6,待测样品和内参同时扩增,在96孔板中每个样品各重复3次,平均Ct值作为样品的结果Ct值。

2 结 果
2.1不同组别人群miR-21与CA199表达情况比较 癌症组患者的CA199和miR-21表达量均显著高于良性对照组和健康对照组(P<0.05),且良性对照组CA199表达量也显著高于健康对照组(P<0.05),而miR-21在良性对照组和健康对照组间的表达差异无统计学意义(P>0.05),见表1。

表1 不同组别人群miR-21与CA199表达情况比较
a:P<0.05,与良性对照组比较;b:P<0.05,与健康对照组比较
2.2CA199与miR-21对鉴别健康人群和胰腺癌患者的诊断价值情况 单独用于鉴别健康人群和胰腺癌患者时,CA199的敏感度和特异度均不高,分别为63.71%和56.00%,均显著低于miR-21的敏感度和特异度(79.84%和78.00%),差异均有统计学意义(P<0.05)。当两者联合时,其灵敏度和特异度较单独使用时有显著升高,曲线下面积明显增加,差异均有统计学意义(P<0.05),见表2、图1。
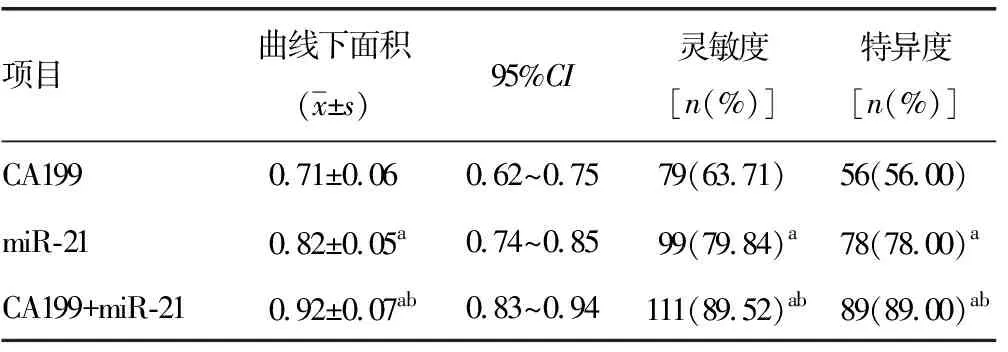
表2 CA199与miR-21对区分健康人群和胰腺癌患者的诊断价值情况
a:P<0.05,与CA199比较;b:P<0.05,与miR -21比较
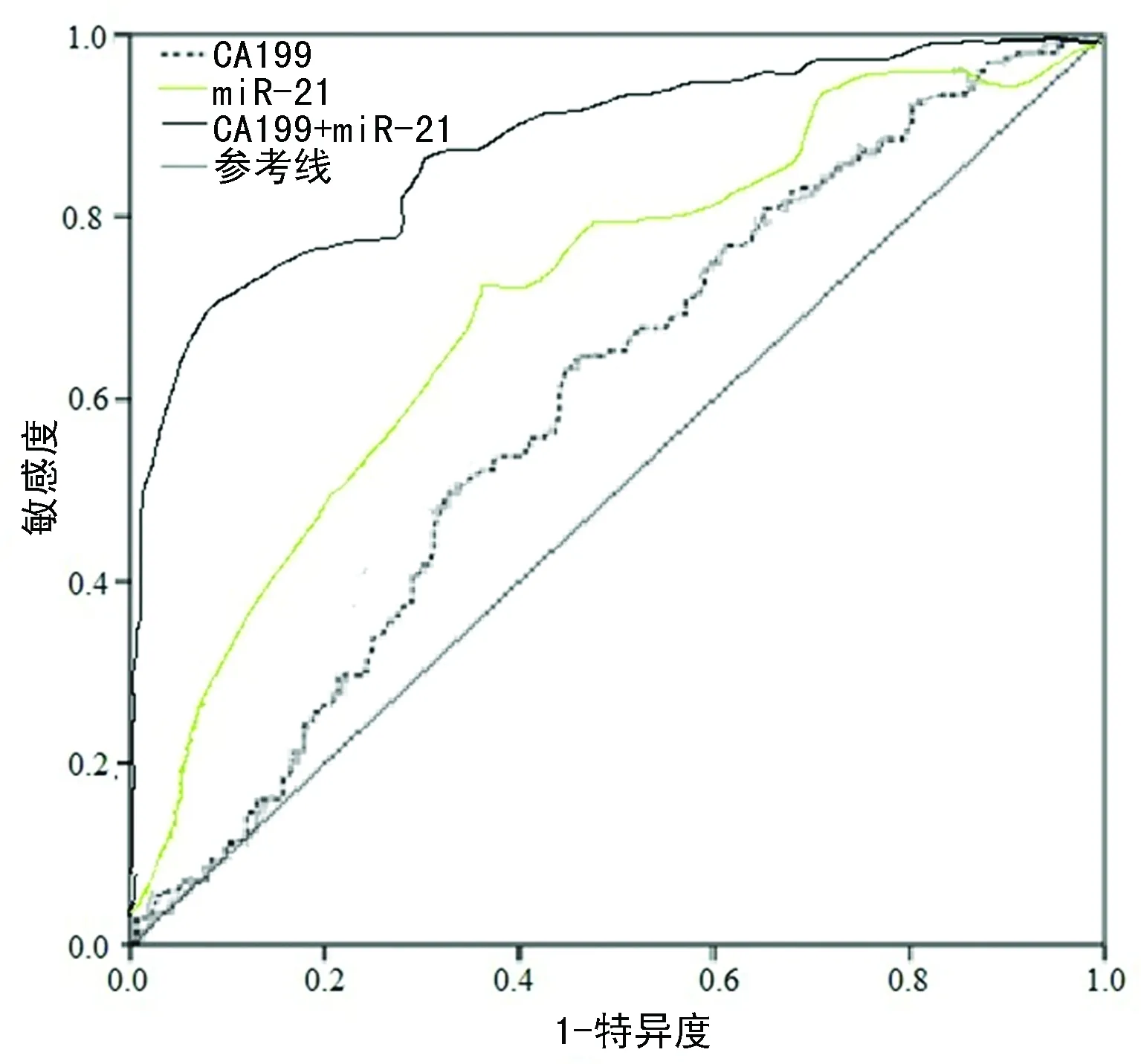
图2 CA199与miR-21对鉴别健康人群和胰腺癌患者的ROC曲线
2.3CA199与miR-21对鉴别良性胰腺疾病和胰腺癌患者的诊断价值情况 单独用于鉴别良性胰腺疾病和胰腺癌患者时,CA199的敏感度和特异度分别为53.23%和51.00%,均显著低于miR-21的敏感度和特异度(72.58%和74.00%),差异有统计学意义(P<0.05)。当两者联合时,其灵敏度和曲线下面积较单独使用有明显增加,差异有统计学意义(P<0.05),但特异度与单用miR-21比较差异无统计学意义(P>0.05),见表3、图2。
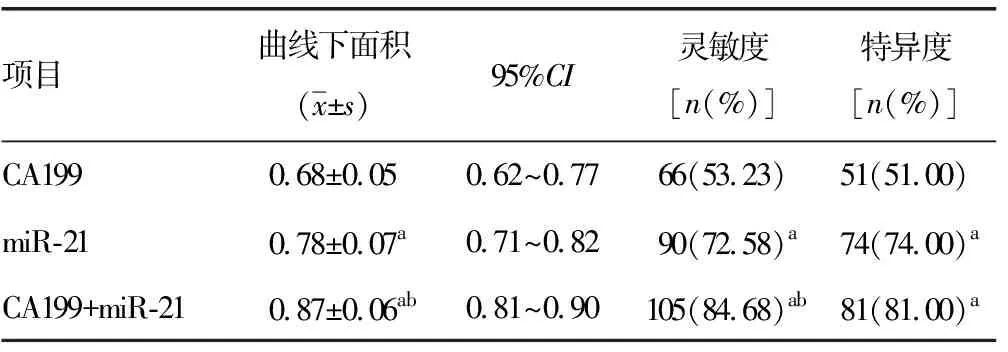
表3 CA199与miR-21对鉴别良性胰腺癌疾病和胰腺癌患者的诊断价值情况
aP<0.05,与CA199比较;bP<0.05,与miR -21比较

图2 CA199与miR-21对区分良性胰腺癌疾病和胰腺癌患者的ROC曲线
3 讨 论
胰腺癌是一种恶性程度和病死率都很高的疾病,现已成为消化系统恶心疾病导致患者死亡的主要原因之一,严重威胁着患者的生命健康[10]。手术切除是目前惟一可能治愈胰腺癌的治疗手段,然而如前文所述,胰腺癌患者在发病早期并无明显的临床症状或体征,更无特异性表现,加上胰腺解剖位置毗邻脏器多,组织活检的应用受到限制[11]。目前胰腺癌的诊断主要依赖于影像学检查,但对胰腺癌诊断的敏感度和特异度不甚理想,尤其是难以发现早期病变。多种原因使得多数患者在确诊时已发展至病情晚期而失去了手术切除的机会,因此临床迫切需要探寻更为简便的筛查和诊断胰腺癌的技术手段。
CA199是目前临床应用较为普遍的一种筛查胰腺癌的肿瘤标志物,已有诸多研究报道指出CA199对胰腺癌的诊断具有较好的敏感度和特异度,且根据胰腺癌患者血清CA199的水平对判断胰腺癌手术患者的预后及术后复发情况也具有较好的预测价值[12]。但也有研究指出CA199表达升高缺乏特异性,可见于多种疾病,如肝胆疾病或良性胰腺疾病等,且有数据指出约有30%的胰腺癌患者可不出现血浆中CA199表达增高[13]。本研究中的数据也显示,CA199在胰腺癌患者和良性胰腺疾病患者均有高表达,在区分健康人群与胰腺癌患者、良性胰腺疾病患者与胰腺癌患者方面,其敏感度和特异度均不高,这使得CA199对胰腺癌诊断的应用价值受到限制。因此,在临床实践中仍需要联合其他指标。
关于CA199与其他肿瘤标志物联合应用于诊断胰腺癌的临床研究,近年来已有较多的相关报道,如将CA199与miRNA联合时,可明显提高对良性胰腺疾病与胰腺癌的诊断敏感度和特异度,且有助于早期诊断胰腺癌[14]。诸多研究已证实多种miRNA在胰腺癌的发生发展中的起着重要作用[15-17],在此不做赘述。研究表明,miR-21在胰腺癌患者中表达明显升高,指出miR-21是一种胰腺癌化疗相关的肿瘤标志物,且其高表达往往预示着预后差,在预测患者预后方面具有潜在的应用价值[18]。潘文征等[19]研究共检测了胰腺癌患者血浆中6种miRNA(分别是miR-21、miR-210、miR-155、miR-196a、miR-20a、miR-25)的表达情况,发现miR-21对胰腺癌的单独诊断价值最高。郭学青等[20]新近报道的研究数据显示miR-21对于胰腺癌具有一定的辅助诊断价值,与CA199联合检测可以为临床胰腺癌的诊断提供一种潜在的辅助诊断方法。但该研究未比较CA199与miR-21在单用时的诊断价值,且该研究中发现miR-21在良性胰腺疾病中也有显著升高,与刘建强等[21]报道的数据存在一定的矛盾,究其原因,可能与两项研究纳入的病例数均较小有关,且其他研究也指出miR-21对胰腺癌的诊断价值仍需要进一步多中心大样本的研究加以证实[22]。为了进一步探讨miR-21的应用价值,因此本研究分析了miR-21与CA199联合应用时对胰腺癌的诊断价值。结果显示,胰腺癌患者的miR-21表达量显著高于良性胰腺疾病患者和健康对照人群,而在良性胰腺疾病患者和健康对照人群之间,其表达量未见明显差异,这一结果提示miR-21对筛查胰腺癌具有一定的特异性;在诊断价值方面,本研究分别从区分健康人群和胰腺癌患者、良性胰腺疾病和胰腺癌患者两个角度分析比较CA199与miR-21及其联合使用时的诊断价值,结果显示miR-21的敏感度和特异度均优于CA199,其诊断价值更高,两者联合应用有助于提高对胰腺癌的诊断价值。
综上所述,当前胰腺癌的诊断和治疗水平仍未达到临床需求,尤其是提高胰腺癌早期诊断能力仍然是目前临床迫切而具有挑战的难题。CA199作为目前应用较为广泛的一种肿瘤标志物,其敏感度和特异度欠佳;miR-21是新近发现的一种标志物,其诊断价值优于CA199,两者联合应用有助于提高对胰腺癌的诊断鉴别能力。
[1]刘鹏飞,张剑青.循环miRNAs与胰腺癌早期诊断的研究进展[J].现代肿瘤医学,2017,25(4):638-640.
[2]钟志惟,殷香保.胰腺癌的分子靶向治疗研究进展[J].中国普通外科杂志,2016,25(9):1351-1356.
[3]WANG P,ZHUANG L P,ZHANG J,et al.The serum miR-21 level serves as a predictor for the chemosensitivity of advanced pancreatic cancer,and miR-21 expression confers chemoresistance by targeting FasL[J].Mol Oncol,2013,7(3):334-345.
[4]陈文举,陈美芳,王攀,等.血清miR-210和CA199联合检测在胰腺癌诊断中的应用[J].中国卫生检验杂志,2015,26(20):3481-3483.
[5]KHURUM K,DAVID C,CLARE P,et al.miR-21 expression and clinical outcome in locally advanced pancreatic cancer:exploratory analysis of the pancreatic cancer erbitux,radiotherapy and UFT(Peru)trial[J].Oncotarget,2016,7(11):12672-12681.
[6]SZAJDA S D,WASZKIEWICZ N,CHOJNOWSKA S,et al.Carbohydrate markers of pancreatic cancer[J].Biochem Soc Trans,2011,39(1):340-343.
[7]陈俊华,赵美芳,李雪芬,等.胰腺癌肿瘤标志物的研究进展[J].国际检验医学杂志,2009,30(2):141-143,146.
[8]SLOTWINSKI R,SLOTWINSKA S M.Diagnostic value of selected markers and apoptotic pathways for pancreatic cancer[J].Cent Eur J Immunol,2016,41(4):392-403.
[9]吴阳,黄李雅,王佐正,等.MicroRNA在胰腺癌血浆中的表达及临床意义[J].宁夏医科大学学报,2016,38(6):620-623.
[10]杨柳,闫欢,石燕,等.晚期胰腺癌患者血清CA125,CA199水平与肝转移的关系[J].中国实验诊断学,2017,21(5):770-773.
[11]李翠芬.胰腺癌血清肿瘤标志物联合检测的意义及中医治疗对肿瘤标记物的影响[J].辽宁中医杂志,2015(10):1917-1919.
[12]杨鹏,赵建勇,江建新.血清 Try-2 CA 199 CA125与胰腺癌的相关性研究[J].河北医学,2015,21(9):1413-1415.
[13]林文科,吴吉芳,郑志昂.多种肿瘤标志物在胰腺癌中的诊断价值及相关性研究[J].中国免疫学杂志,2017,33(1):120-125.
[14]朱成林,余安,黄强.用于胰头癌可切除性判断的术前血清标志物筛选[J].中国普通外科杂志,2017,26(3):265-270.
[15]赵欣,尤胜义.miRNA 在胰腺癌发生发展及临床应用中的研究进展[J].山东医药,2015,59(24):101-103.
[16]王熠,熊龙辉,贺德.微RNA与胰腺癌研究进展[J].医学综述,2016,22(11):2124-2127.
[17]YUAN W,TANG W,XIE Y,et al.New combined microRNA and protein plasmatic biomarker panel for pancreatic cancer[J].Oncotarget,2016,7(48):80033-80045.
[18]KARAMITOPOULOU E,HAEMMIG S,BAUMGARTNER U A,et al.MicroRNA dysregulation in the tumor microenvironment influences the phenotype of pancreatic cancer[J].Modern Pathology,2017,30(8):1116-1125.
[19]潘文征.与胰腺癌诊断相关血浆miRNA的研究[D].济南:山东大学,2014.
[20]郭学青,高宏伟,李晓阳.血清miR-21与CA199联合检测对胰腺癌诊断的临床意义[J].中华检验医学杂志,2017,40(5):400-403.
[21]刘建强,高军,任艳,等.血浆miR-21对胰腺癌的诊断价值[J].世界华人消化杂志,2011(8):860-863.
[22]刘书中,李子全,李政垚,等.外周血 miR-21检测在胰腺癌中的意义研究进展[J].中国实验诊断学,2016,20(6):1038-1042.

